Гормонотерапия в акушерстве и гинекологии. Иллюзии и реальность [Елена Петровна Березовская] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
Елена Березовская Гормонотерапия в акушерстве и гинекологии Иллюзии и реальность
Шрифты предоставлены компанией «ПараТайп»© Елена Березовская, 2017 18+ Создано в интеллектуальной издательской системе Ridero
* * *
От автора
Дорогие читатели! Часто в письмах женщин, проходящих через перипетии беременностей, в том числе через их потери, звучат слова: «Я знаю, как Вы относитесь к прогестерону, но…» и дальше обычный сценарий, что врач напугал, вынудил принять прогестерон и еще несколько препаратов якобы сохраняющих беременность. Логически напрашивается вывод, что я отношусь к прогестерону негативно и чуть ли не являюсь его врагом. Но так ли это? Ни один вопрос, ни один случай, с которым мне пришлось столкнуться, не проходит мимо меня бесследно. Я анализирую все случаи, как и все полученные вопросы, независимо от того, каким был мой ответ. Я анализирую свои ответы не меньше, чем вопросы «что еще в конкретной ситуации можно было посоветовать?». Слово «прогестерон» мелькает в вопросах постсоветских женщин чаще, чем любое другое слово, особенно если речь идет о беременности или подготовке к ней. Объяснить каждой женщине в двух словах почему я не рекомендую прогестерон всем подряд, как это делают врачи в бывших советских республиках, сложно, да и вообще невозможно. Большинство все равно не поймет или не примет мои слова всерьез. Но получив оценку моего «отношения» к прогестерону в очередной раз, я задумалась: а как на самом деле я к нему отношусь? Я не отношусь к прогестерону как к божеству, на которое молятся чуть ли не все женщины, особенно планирующие и вынашивающие беременность, страдающие фактически прогестероновым фанатизмом (тоже религия), или прогестерономанией; как к божеству, которому тупо-слепо служат многие врачи, считая себя если не тоже богами, то посредниками Бога ибо у них в руках сам «господь прогестерон» (и за это многие из них получают вознаграждения от владельцев аптек и представителей фармакологических компаний); как к божеству, которое приносит баснословные прибыли производителям и продавцам этого гормона. Я благодарна тем десяткам тысяч женщин, которые задавали мне вопросы, так или иначе связанные с использованием прогестерона. Без них я, возможно, так бы и осталась в стороне от этого уникального органического вещества, а не просто гормона. Но именно желание объяснить все правильно и доходчиво вынудило меня углубиться в изучение прогестерона — от А до Я, то есть от его химического строения и связи с другими гормонами до применения этого вещества вне репродуктивных органов, а также его синтетических «сородичей». Когда я начала работать над этой книгой, я думала, что 100 страниц для такой темы будет достаточно. Но, расширяя собственные знания о прогестероне, я не заметила, как было создано 200 страниц книги, а дальше счет дошел до 300 страниц. Наконец работа над книгой завершена, и она представлена вам — моим читателям, интересующимся вопросами женского здоровья. Я с уверенностью и гордостью могу сказать, что такой «дотошный» анализ прогестерона не был проведен до этого никем. Др. Джон Ли, книги которого о прогестероне были популярны в США и других странах в 90-х годах прошлого столетия, избегал серьезных научных данных в своих публикациях, хотя пропагандировал использование прогестерона по всему миру (чаще всего как заместительную гормональную терапию у женщин в климактерическом периоде). Его книги привели к тому, что миллионы женщин начали бесконтрольное использование прогестерона, а также оказались жертвами обыкновенного мошенничества, когда вместо прогестерона им предлагали экстракт дикого ямса, содержащего диосгенин, а не прогестерон, хотя в аннотациях часто такой экстракт назывался и до сих пор называется «натуральным прогестероном». Повышение уровня заболеваний раком молочной железы и других осложнений после приема прогестерона, часто в комбинации с эстрогенами, привело к тому, что врачи на Западе забили серьезную тревогу и стали предупреждать своих пациентов о потенциальном вреде гормонов. Эти истории не дошли до «ушей» постсоветских врачей и женщин, тем более что их не интересовала тема гормональной заместительной терапии — их внимание было сконцентрировано на «угрозах» прерывания беременности, а не на менопаузе. Изучив тысячи публикаций на тему прогестерона, я открыла для себя столько нового и интересного, что с удовольствием делюсь этими открытиями в своей новой книге. Так что же значит для меня прогестерон? Как в возникновении всего человечества существуют прародители Адам и Ева, так и в возникновении стероидных гормонов есть свои прародители. Праотцом всех стероидных гормонов является холестерин (правильное международное название все же холестерол — окончание «ол» говорит о его родстве со стеролами), то есть это Адам. А прогестерон — это Праматерь всех стероидных гормонов, в том числе и половых — женских и мужских, или древняя гормональная Ева. Прогестерон был задолго до тестостерона и эстрогена, задолго до появления мужчины и женщины. Я привела такое сравнение не зря — важно, чтобы мои читатели поняли, что и в «жизни» гормонов существует определенная иерархия. А значит их функция и влияние на другие ткани и органы тоже определены упорядоченными законами природы, которая заложила в живые существа одну и ту же программу самореализации, только разных по сложности уровней — от вирусов и бактерий до человеческого организма. Но прогестерон — это не только прародитель. Для меня это целая автономная Вселенная, в которой есть свои яркие солнца и черные дыры, есть свои законы, тайны и секреты. Автономная потому, что до сих пор многие процессы, связанные с выработкой, усвоением и действием прогестерона, являются загадками даже для самых эрудированных умов. В отличие от всех других стероидных гормонов, прогестерон может усваиваться и воздействовать на клетки несколькими путями и одновременно проявлять независимость в выборе этого воздействия. Другими словами, прогестерон обладает диалектическими свойствами, то есть может оказывать совершенно противоположное действие. Изучение роли прогестерона — это как хождение по лезвию ножа или по краю пропасти (как, впрочем, и само его действие): в одном случае — он друг и помощник, а в другом — настоящий враг и вредитель. И такая контрастность воздействия прогестерона наблюдается во всем: в овуляции, зачатии, беременности, поведении женщины, возникновении заболеваний. Во всех процессах ключом нормальности, когда прогестерон не меняет свою «полярность» и не становится врагом вместо друга, важную роль играет четкая синхронная динамическая пропорция гормонов: гонадотропинов, прогестерона, половых гормонов (мужских и женских) и еще ряда многих других веществ. Любое вмешательство в эту синхронность и пропорцию, в том числе введением прогестерона, может закончиться нарушением «натуральности» процессов: овуляция не наступит, зачатие не произойдет, плодное яйцо не прикрепится и погибнет. Это далеко не все мысли, которые возникают при слове «прогестерон». Именно поэтому и была создана эта книга. Так как же я отношусь к прогестерону? Я восхищаюсь его уникальностью, я поражаюсь его каверзности, я вижу в нем ключ к разгадкам многих биохимических, гормональных и физиологических процессов в организме человека. Но я также уверена, что прогестерон останется независимым от управления им человеком еще на очень долгий период жизни, пока существуют многие тайны зачатия и продолжительности человеческого рода. Приятного чтения!Почему мы говорим о «Прогестероновой нации»?
Тема «прогестерона» является специфической, уникальной и сложной. Со дня открытия этого вещества, что произошло почти столетие тому назад, интерес к гормону то повышался, то понижался, но, тем не менее, о прогестероне говорят и пишут постоянно. В процессе создания этой книги я провела поиск информации через поисковые системы библиотеки Университета Торонто, которая объединяет несколько известных популярных поисковых систем (PubMed, Ovid, WebMd, OmniMedicalSearch, MEDLINEplus, The Cochrane Library и др.). В феврале 2013 года, когда я начала работу над книгой, запрос по теме «прогестерон» выдал 221 879 публикаций, в основном на английском языке (в небольшом количестве на французском, немецком, испанском и ряде других языков). На самом деле это далеко не все статьи и книги о прогестероне, которые когда-либо были опубликованы во всем мире. В этот список включены публикации известных научных, профессиональных и популярных издательств. Существует множество других публикаций, которые не зарегистрированы в профессиональных и популярных источниках информации.
Из приведенного графика, показывающего зависимость между количеством публикаций и годами (промежутками времени), виден пик интереса — 2000–2009 годы, когда начали широко внедряться репродуктивные технологии, а также возник вопрос о пользе и вреде прогестерона и прогестинов для лечения симптомов климактерического периода. Этот период был решающим в разоблачении многих мифов и слухов о пользе прогестерона и его бесконтрольного применения, которые возникли на Западе в 90-е годы прошлого столетия. Тем не менее, интерес к прогестерону и его производным продолжает расти, и во многих странах проводится немало научных и клинических исследований, посвященных изучению этого гормона и его синтетических заменителей, поэтому количество публикаций на тему прогестерона растет с каждым днем. В начале мая 2013 года оно увеличилось еще на 1000 названий статей. Другими словами, во всем мире каждый месяц появляется 400–500 публикаций о прогестероне и прогестинах. Запад уже пережил период бесконтрольного применения прогестерона. На территории же бывшего СССР, где вот уже почти тридцать лет доминирует миф об универсальности этого гормонального вещества, вопрос остается чрезвычайно актуальным. В реальности это уже не просто миф, а глобальная психологическая зависимость от препаратов прогестерона, созданная врачами постсоветской медицины и распространенная среди женщин искусственно. В первую очередь, из-за профессиональной малограмотности, во вторую очередь, через запугивание и создание страхов как из чисто традиционного подхода (запугивание больного — это особенность советской медицины), так и с корыстной целью для манипулирования жизнью (и доходами) женщины. За эти тридцать лет два поколения женщин «выращено» на прогестероне. Если возрастной контингент заграничных женщин, которые применяли или применяют прогестерон, включает в основном женщин старшего климактерического возраста, в постсоветских странах прогестероном «питаются» женщины репродуктивного возраста (15–45 лет), в том числе девочки-подростки. Идефикс об «универсальности прогестерона», который якобы лечит чуть ли не все женские болезни, развивают и поддерживают современные фармацевтические компании, производящие и продающие гормоны, так как этот глобальный миф и созданная искусственно психологическая зависимость от прогестерона, дюфастона, утрожестана и ему подобных приносит баснословные доходы их производителям. Поэтому я называю современное женское население бывших республик Советского Союза прогестероновой нацией. В разных странах мира существуют искусственно созданные мифы в отношении применения тех или иных лекарственных препаратов или разных видов лечения. Например, американское и европейское общества страдают мифами о депрессии, и продажа антидепрессантов здесь достигла апогея, фармакологические компании поставили цель «посадить» на антидепрессанты чуть ли не каждого взрослого жителя США и ряда стран Европы. Еще один миф, которым болеет современное общество развитых стран, — увлечение синтетическими мультивитаминными и минеральными комплексами, неэффективность которых давно уже доказана. Тем не менее, повсеместная многолетняя реклама, как и продажа разного вида добавок, являются частью создания огромного дохода очень многих людей и компаний. Современные люди хотят быть здоровыми и жить чуть ли не вечно, но не путем ведения здорового образа жизни, которому родители должны обучать детей с момента их рождения, которому должны быть посвящены уроки здоровья в школах и высших учебных заведениях. Для большинства такой путь неприемлем, потому что он требует работы над собой — самообучения, самоусовершенствования, самодисциплины. Многие люди предпочитают чрезвычайно упрощенный вариант «улучшения здоровья»: бросил «волшебную» таблетку в рот и «здоровье обеспечено». Точно такое же «упрощенное» отношение к планированию беременности и зачатию детей, часто основанное на нетерпеливости и спешке, создало не просто искусственное бесплодие среди многих постсоветских женщин, но и ошибочное мнение, что появление детей зависит от приема таблеток, в частности прогестерона. Без него многие женщины боятся пробовать беременеть. Но практически никто из женщин не знает, что прогестерон обладает противозачаточным действием. Беременность — это нормальное физиологическое состояние женщины, очень короткий период ее жизни, связанный с зачатием, вынашиванием и рождением потомства. Но постсоветские женщины и врачи «умудряются» превратить этот период в «ужасное состояние», когда с первых недель беременности и до самых родов, а также первые месяцы послеродового периода, жизнь женщин заполняется бесконечными страхами, нервотрепкой, рыданиями, эмоциональным стрессом. Все боятся потерять желанную беременность, но никто не задумывается, да и не знает, что негативные эмоции и стресс могут спровоцировать потерю беременности, что потом «спишут» на скрытые инфекции и «токсикоз». И ради «спасения» этой беременности женщина готова идти на все: принимать огромное количество разных препаратов, лежать в стационаре, отказывать себе в нормальных человеческих отношениях с мужем и другими членами семьи. Беременность постсоветской женщины становится нередко ее наказанием, о котором она вспоминает многие годы с болью и слезами. Можно смело назвать беременных женщин бывших республик СССР самыми «захимиченными» и самыми запуганными женщинами в мире. Для меня, как для врача, наблюдение за происходящим в сфере женского здоровья на территории постсоветского пространства и его анализ являются морально болезненным процессом, в первую очередь из-за понимания того, что там современная система здравоохранения отстала на 25–30 лет от прогрессивной медицины мира. Ведь медицина — это фактически знания и опыт как поколений врачей, так и науки. Но даже самые передовые и прогрессивные знания не могут быть использованы на практике, если нет качественных, грамотных, добросовестных специалистов, которые работают врачами по призванию, а не из корыстолюбия и ради финансовой выгоды, да еще и из-за престижности профессии. Медицинская этика, которая когда-то являлась прерогативой в отношениях с больными людьми, давно уже не принимается во внимание многими врачами. Хуже всего дела обстоят с повышением уровня знаний специалистами. Большинство врачей не владеет иностранными языками, поэтому не имеет доступа к мировым кладовым современной прогрессивной научной информации. Литература, которая распространяется среди постсоветских врачей, не просто страдает неточностью информации, но и насыщена чрезвычайно устарелыми и ошибочными данными. Директивность, когда на врачей «давят сверху» приказами, регламентирующими диагностику и лечение разных состояний и заболеваний, приводит к тому, что врачи «перегибают палку» во всем. И не просто перегибают, а умудряются, идя на поводу у принципа «чем больше, тем лучше», проявить такую агрессию в количестве анализов, лекарственных препаратов и процедур, что само понятие «улучшение здоровья» теряет свою актуальность. Слова «война» и «борьба» (с недугом, с заболеванием, с болезнью) заменили слово «лечение». Все грубо, интенсивно борются с невидимым врагом, который прячется в организме человека! А значит, просто «ведут войну» с самим человеком. Врачебная агрессия стала атрибутом современной системы здравоохранения, и она существует во всех отраслях медицины. Всегда при всех недостатках, всей отсталости и некачественности системы здравоохранения страдают люди, нуждающиеся в медицинской помощи. Они становятся заложниками малограмотности и ошибок врача. Здоровье современных женщин подвергается опасности, часто из-за необоснованного, грубого, агрессивного и непрофессионального вмешательства тех, кто по идее должен помочь, а не навредить. Советская система здравоохранения, особенно в эпоху ее создания и развития Семашко Н. А, была одной из лучших в мире, впрочем, как и одной из самых передовых. Николай Александрович придавал огромное значение вопросам профилактики заболеваний через обучение здоровью и гигиене в школах, здоровому образу жизни через занятия физической культурой и спортом. Во всем мире о здоровом образе жизни и профилактике заболеваний начали говорить не так давно — не более тридцати лет тому назад, когда начали расти уровни сердечно-сосудистых заболеваний, ожирения и рака. Но в бывших республиках СССР произошло кардинально противоположное явление. Прогрессивная, передовая система здравоохранения превратилась в одну из самых отсталых, в агрессивно настроенную и полностью зависящую от лекарственных препаратов. Губящую здоровье людей, калечащую их жизнь и поощряющую взяточничество, плодящую чрезвычайно малограмотные кадры, особенно административно-руководящие и академические, когда уровень знаний заменяется количеством денежного вознаграждения и понятием «блата». Опять же, всегда страдают люди, которые попадают в сети этой исковерканной системы здравоохранения. Создание психологической зависимости от приема лекарственных препаратов, в частности прогестерона, привело к тому, что миф о всемогуществе некоторых препаратов достиг не просто опасного уровня. Его распространение и влияние стало бесконтрольным. И вместо того чтобы остановить это пагубное влияние общественных мифов и слухов в отношении ряда лекарств и веществ, которые даже не являются лекарствами, но успешно выдаются за таковые и продаются на современном аптечном рынке, руководящая верхушка системы здравоохранения остается в стороне, не принимая кардинальных мер в этом направлении. Прогестероновая нация — это уже не просто группа женщин, принимающих прогестерон чуть ли не в постоянном режиме до беременности, во время беременности и после нее. Это уже десятки миллионов женщин, которым в мышление-сознание введена ложная идея о «всемогуществе» прогестерона и которые иначе и думать не могут. Срабатывает псевдологика: если все женщины бывшего СССР столько лет принимают прогестерон, если почти все врачи назначают его, значит, от него есть польза и только этот препарат поможет и никакой другой. Эта книга предоставляет большое количество новейшей информации о прогестероне — гормоне, который является важным органическим веществом в организме человека, как женщины, так и мужчины. Без него жизнь невозможна, но из друга и очень полезного вещества он может превратиться в настоящего врага, тихого и незаметного. Это не просто гормон беременности, он — матрица очень многих гормонов человека. Прогестерон очень важен для развивающегося плода, но он может предотвратить зачатие ребенка и даже погубить это зачатие и привести к серьезным осложнениям беременности. Всему своя мера — таков не только философский закон, но и закон Природы. Но чтобы знать эту меру, все те, кто принимает или назначает прогестерон, должны как можно больше знать об этом гормоне. Книга о прогестероне предназначена для тех, кто хочет повысить свой уровень знаний об этом гормоне и помочь другим избавиться от опасного мифа, порождающего «прогестероновую нацию». Постановка диагноза и назначение лечения не могут быть проведены только по одному результату одного анализа, особенно когда другие результаты не отклонены от нормы. Профилактика заболеваний не подразумевает назначение массы препаратов «на всякий случай», в том числе прогестерона, который постсоветские врачи назначают почти всем подряд женщинам при любых «женских» диагнозах. Вознаграждение врачей фармакологическими компаниями и аптеками не должно становиться стимулом использования этого гормонального препарата повсеместно. Но пока в системе здравоохранения будут царствовать отсталость и коррупция, единственным стражем здоровья человека остается и будет сам человек. И эта книга создана для тех, кто желает знать больше, кто понимает, что прогресс существует и в медицине, а не только в других отраслях человеческой деятельности. С каждым днем, месяцем, годом мы будем знать об устройстве и функционировании человеческого тела все больше и больше. Поэтому важно повышать, а точнее, обновлять свои знания постоянно. Важно использовать эти знания рационально, без искажений и псевдотеорий, без нанесения вреда здоровью. Для успешного лечения и избавления от болезни человек должен стать другом здоровья, другом собственного тела, прислушиваться к нему, научиться понимать его. Предложенная вашему вниманию книга поможет вам лучше понимать устройство и функцию женского организма.
1. О ДОСТОВЕРНОСТИ ИНФОРМАЦИИ
Мы живем в Эру Информации, поэтому неудивительно, что с появлением компьютеров и Интернета у людей появился доступ к огромнейшему количеству информации — на любую тему, в любом количестве, на любом языке. Благодаря электронной почте и веб-страницам обмен информацией проходит очень быстро — о каком-то событии в считанные секунды может узнать весь мир. Но не секрет, что количество не означает качество, и в океане информации есть немало ложной, неправдивой и даже опасной. Ведь ложь, слухи и мифы распространяются намного быстрее, чем правдивая информация, потому что они нередко затрагивают эмоционально-чувственную сторону человека, воздействуют на его мышление через определенные психологические каналы. Многие слухи и мифы создаются с целью воздействия на массы людей, чтобы руководить их действиями. В отношении здоровья ситуация получения и обмена информации еще сложнее, потому что это личная тема каждого человека — она затрагивает каждого индивидуума, она связана с теми, с кем человек живет, общается, кому приходится родственником, другом, коллегой, знакомым и т. д. Здоровье и человек — неотделимы, как и неотделимы жизнь и человек. Поэтому большинство людей хотят быть не только здоровыми, но и жить долго. А помимо здоровой жизни, понятие физического и морального благополучия включает здоровое потомство, здоровую семью, здоровые отношения с людьми и окружающим миром. Проблема состоит в том, что здоровому образу жизни люди начинают учиться уже в весьма зрелом возрасте, когда появляются определенные проблемы со здоровьем. Другая проблема — это «нездоровое» направление в обучении и создании кадров системы здравоохранения: врачей и медсестер учат смотреть на всех без исключения людей как на больных (пациентов), фактически клиентов, этой системы. Если человек обратился к врачу за советом или помощью, значит он однозначно больной. И вот здесь наружу выплывают многочисленные страхи, основанные на многочисленных слухах и мифах. А что такое слух или миф? Это неправдивая, обманчивая информация, лжетеория — все то, что в преимущественном большинстве случаев создано из-за незнания и непонимания происходящего как внутри человека, так и вне его организма, но имеющего отношение к здоровью и болезням. Это чужие мысли, засевшие в голове людей и руководящие поступками тех, кто не в состоянии понять, что не все чужие мысли являются полезными для их хранения. Человек — это своеобразный радиоприемник. Он будет поглощать ту информацию, на которую настроено его сознание-мышление. Анализ полученной информации требует развитого аналитического мышления, а как показывают результаты исследований, почти три четверти взрослых людей (в основном до 40 лет) имеют примитивное аналитическое (логическое) мышление, то есть не способны фильтровать и анализировать информацию на том уровне, который позволит им контролировать свое поведение осознанно и мудро. Не зря говорят в народе, что мудрость появляется после 40 лет. Но до этого возраста многие люди идут на поводу той информации, которая больше и сильнее «давит на психику», то есть создает страх. Страх за жизнь — это доминирующее чувство не только у людей, но и у животных. Вот и получается, что воспринимают люди чаще всего ту информацию, которая привносит в их души страх и опасение за здоровье и жизнь — собственные или близких людей. Эта информация может не только не принести пользы, но и навредить. Она может погубить человеческую жизнь. Однако, несмотря на желание многих людей разобраться в том, что есть правда, а что есть выдумка, определить достоверность информации при наличии такого огромного ее количества не так просто. В вопросах медицины и здоровья достоверность информации — это ключевой момент, потому что от этого будет зависеть правильное обследование, лечение, профилактика. От достоверности информации будет зависеть цепочка последствий, которая отразится на здоровье и жизни человека. Как в современном потоке информации определить ее достоверность?1.1. Преграды в распространении новых знаний в медицине
Если окунуться в историю медицины, можно обнаружить, что она полна примеров регистрации и публикации информации о заболеваниях, их диагностике и лечении, поиске врачами и учеными оптимальных методов диагностики и лечения, начиная еще с древнеегипетских времен. Некоторые методы лечения прошлого сегодня выглядят анекдотично или же просто настоящим варварством и издевательством над человеческим телом. Эта история содержит также немало примеров ошибочных направлений в медицине, ложных теорий и догм, которые руководили действиями врачей целые столетия, а некоторые из них сохранились и до сих пор. Когда такие ложные убеждения доминируют в нескольких поколениях врачей, естественно, они определяют и общественную мысль, поведение людей, которые обращаются за помощью к системе здравоохранения. В итоге, избавиться от ложной информации, хранившейся в мышлении людей нескольких поколений, не так просто. Поэтому нередко ученые и врачи, пытающиеся мыслить по-новому, передающие новые знания другим людям, подвергались гонению, критике, репрессиям и даже изгнанию. На принятие обществом «новой трезвой мысли» уходит приблизительно 20–30 лет, а иногда и больше (например, до сих пор постсоветских беременных женщин врачи вынуждают сдавать посевы из носоглотки на стафилококк и проходить лечение в случае его обнаружения, что не делается в других странах мира уже более 50–60 лет). В современную эпоху скоростного обмена информации распространение новых данных науки и медицины проходит быстрее. Но на фоне увеличивающегося лавинообразно потока ложной и неправдивой информации, опять же, достоверные данные, особенно если они противоречат общепринятой мысли и высказываниям, теряются и пробиваются через тернии точно так же, как и сто, двести, триста лет тому назад. В медицинских кругах (как, наверное, и во всех остальных) до сих пор имеется «идолопоклонничество», когда высказывание «известного ученого/врача» принимаются большинством за чистую монету. Чем выше положение такого светила, тем меньше сомневающихся в его высказываниях. Однако на Западе многие профессиональные издательские агентства давно уже не указывают должности и титулы авторов публикаций. Свобода слова и печати все же позволяет многим ученым и врачам опровергать слухи и мифы, созданные на основании публикаций их предшественников. В постсоветской медицине преклонение перед титулами и должностями все еще порождает некое плебейство и боязнь опровергнуть порой чрезвычайно нелепые и глупые высказывания некоторых академиков, профессоров, заведующих кафедрами и отделениями, а отсутствие знаний иностранных языков не дает возможности использовать убедительные данные из публикаций зарубежных коллег. Другой негативный аспект, существующий в медицине тысячелетиями, это скептицизм в отношении новых результатов (данных). Консерватизм мышления присущ многим людям, независимо от их образования, рода деятельности, возраста. Очень многие врачи «зацикливаются» на том минимальном уровне знаний, которые они получили в медицинских школах, причем большая часть этих знаний отсеивается и забывается, а остаются только те, которыми врачи пользуются в течение всей своей трудовой деятельности до пенсии. Если по окончании института или университета эти знания и могли быть передовыми, то через 20–30 лет они становятся устарелыми, а значит, далеко не достоверными. Колоссальным является негативное влияние средств массовой информации. Важно понимать, что на сенсационных новостях и публикациях все, кто вовлечен в средства массовой информации, зарабатывают больше денег, чем на обыденных новостях, поэтому создание искусственных сенсаций — это часть бизнеса, выгодного многим людям. Сенсации на тему здоровья и «потрясающих научных открытий в медицине» — не менее популярная тема, чем жизнь светской элиты и голливудских звезд. Но очень часто журналисты и все, кто вовлечен в эту индустрию, создают сенсации на исковерканных данных научных публикаций, хватаясь за какую-то цитату или высказывание авторов. Таких примеров много. Еще одна проблема в распространении новой достоверной информации — это невосприятие людьми новых данных, особенно если они перечат вековым постулатам и догмам. Например, на принятие идеи о микроциркуляции крови в мелких сосудах (капиллярах) ушло более 400 лет. На принятие данных о связи курения с возникновением рака легких — более 50 лет и около 40 лет дополнительно на запрет курения в общественных местах. На использование ядерного магнитного резонанса в диагностике заболеваний — более 60 лет, и т. д. Такое противостояние всему новому нельзя назвать природной, натуральной реакцией людей, привыкших к стабильности, а поэтому не желающих менять ситуацию и принимать новое в свою жизнь. Наоборот, в природе существует постоянная адаптация живых индивидуумов к изменениям окружающей среды, то есть постоянное принятие всего нового, что происходит в их жизни. Неприятие нового у людей, в частности нового в медицине, чаще всего начинается с верхушки — академического мира, где идет постоянная борьба (та же политическая борьба) за должности, звания, титулы, известность и власть. Многие данные научно-клинических исследований остаются не только неопубликованными из-за противостояния группы редакторов какого-то профессионального издания, но подвергаются критике только потому, что они не совпадают с общественным мнением. Даже если врачи примут во внимание какие-то новые данные, общественность чаще всего не готова к таким данным (как это произошло с борьбой с курением и алкоголизмом, с ростом числа кесаревых сечений, проводимых без всяких серьезных показаний, с отказом от естественных родов после кесарева сечения, с внедрением вакцинации от опасных инфекционных заболеваний). Прогрессивные врачи не будут запугивать, даже если новые научные данные серьезны и требуют срочного привлечения внимания общественности. И как раз отсутствие агрессивности и навязчивости в предоставлении современной достоверной информации является тем барьером, в основном этическим, который не позволяет вытеснить ложные теории и догмы, постулаты и мифы не только из общественной мысли, но и из практики врачей и других специалистов, оказывающих помощь в оздоровлении населения.1.2. О клинической эпидемиологии и доказательной медицине
В прошлом ученые и врачи публиковали свои труды без должного контроля достоверности информации, которую они предоставляли в своих публикациях. Не все прогрессивные врачи имели возможность публично делиться своими наблюдениями, теориями, результатами экспериментов. Не все прогрессивные врачи имели доступ к кладовым мировой литературы и новым публикациям своих соотечественников и иностранных коллег. Хотя во многих странах в прошлых столетиях и проводились переписи населения и учет ряда заболеваний, однако насколько полученная и зарегистрированная информация была достоверной, никто не знал. Никто не знал, насколько высказывание того или иного врача является правдой, пока другие думающие врачи-исследователи не подтвердили или опровергли эти высказывания с использованием более прогрессивных методов анализа полученных данных. Что означает достоверность данных в медицине? Это не просто констатация факта, что получены такие данные, а не другие. За понятием достоверности всегда стоит ряд вопросов: как получены эти данные, какая следственная связь существует между данными и теми факторами, которые могут влиять на их получение? В отношении болезней достоверность показывает, насколько прочна зависимость причины и следствия (возникновения заболевания, эффективности или неэффективности лечения, возникновения побочного эффекта и т. д.) с учетом факторов среды, как внешних (окружающая среда), так и внутренних (внутри тела человека), способствующих или противодействующих возникновению этой причинно-следственной зависимости. Эпидемиология — это наука, изучающая закономерности возникновения и распространения заболеваний различной этиологии с целью разработки профилактических мероприятий. Она рассматривает причинно-следственные связи в возникновении заболеваний, но не на конкретном человеке, а на группе людей, потому что это позволяет провести оценку существующей связи и назвать ее случайной или же достоверной. Эпидемиология включает несколько других наук, которые имеют относительную самостоятельность: социальную гигиену, основы здравоохранения (часто в иностранных публикациях эти две отрасли называются одним понятием — общественное здоровье), доказательную медицину (evidence-based medicine), научно-клинические исследования, медицину профилактики заболеваний, этиологию и ряд других. Она тесно связана с биологией, физиологией, статистикой, социологией, антропологией, экономикой и другими современными науками. Клиническая эпидемиология — это часть медицины, касающаяся проведения научных и клинических исследований и анализа полученных данных. Доказательная медицина — это новая отрасль медицины, которая использует математический и статистический анализ существующих и новых данных в отношении диагностики, лечения и профилактики заболеваний. Другими словами, доказательная медицина определяет достоверность данных или качество достоверности. В доказательной медицине существуют определенные правила — критерии оценки информации. Например, какой-то врач решил опубликовать данные об эффективности лечения по его схеме. Он может утверждать, что у 90 % его пациентов наблюдалось значительное улучшение состояния после проведенного лечения. Фактически, именно такими данными пестрели публикации прошлого. С одной стороны, это может быть правдой. С другой стороны, эти показатели могут быть ложными, если принять во внимание несколько важных факторов. Чтобы сравнивать эффект от чего-то, необходима контрольная группа, где это что-то не применялось. Необходимо также учитывать количество участников, их возраст, наличие других заболеваний, многие другие факторы и условия. Необходимо устранить заинтересованность самого исследователя — он мог подбирать участников по своим личным критериям, зная наперед, что применение его схемы лечения поможет этим людям. Таким образом, доказательная медицина учитывает все эти «мелочи», которые в совокупности будут подтверждать или опровергать причинно-следственную связь.1.3. Несколько слов о научно-клинических исследованиях
Для того чтобы понимать и оценивать степень достоверности данных (фактов), необходимо иметь хотя бы элементарные знания о том, как проводятся современные исследования в медицине и других смежных науках, а также как проводится анализ полученных данных. Для человека без медицинского образования любое высказывание о пользе или вреде чего-либо может быть принято без сомнения, особенно если такие высказывания звучат со стороны экспертов. Интерпретация данных врачами и другими специалистами тоже может быть искажена. Около десяти лет тому назад в Англии было проведено интересное исследование, которое показало, насколько по-разному можно объяснять полученные данные, если не учитывать важные факторы. Группа людей старшего возраста принимала сердечно-сосудистые препараты для предотвращения кровоизлияния в мозг и сердечных приступов. Оказалось, что у тех, кто принимал препараты регулярно, уровень заболеваемости был ниже. И, наоборот, люди, которые пропускали прием таблеток, страдали серьезными сердечно-сосудистыми заболеваниями чаще. Какой вывод можно сделать из таких данных? Большинство людей скажет, что такие результаты показывают, что регулярный прием лекарств понижает частоту серьезных сердечно-сосудистых заболеваний и их осложнений. Но это исследование было направлено на изучение соблюдения режима приема лекарств, а не на их эффективность (ведь лекарства могли быть разные). С учетом всех факторов реальные выводы исследования звучали бы следующим образом: люди, которые соблюдают режим приема лекарственных препаратов, а также стараются вести более здоровый образ жизни, то есть более ответственны, — физически активнее, питаются здоровее, регулярно посещают врача, — имеют более низкие уровни серьезных осложнений сердечно-сосудистых заболеваний. Поэтому любые выводы любого исследования необходимо рассматривать в комплексе с критериями отбора участников исследования, методами анализа полученных данных и другими важными факторами. Нередко сами же ученые и врачи не видят погрешностей собственного исследования, потому что ограничены узким наблюдением чего-либо без связи с факторами, которые в реальности кардинально меняют интерпретацию полученных данных.1.3.1. Виды клинических исследований
Степень достоверности данных во многом зависит от вида и дизайна клинического исследования. История эпидемиологии и доказательной медицины отражает процесс усовершенствования проведения научно-клинических исследований и статистической обработки и анализа полученных результатов. Все существующие виды исследований, данными которых пользуются врачи и другие люди, можно разместить в виде пирамиды, отражающей повышение качества достоверности (до вершины) с прогрессом дизайна исследований. Первые наблюдения (обсервации) пациентов проводились врачами в течение тысячелетий, и эти наблюдения нередко записывались в дневниках, рукописях, учебниках, а позже публиковались исследователями в журналах и книгах по вопросам медицины. Такие наблюдения проводятся до сих пор многими врачами. У каждого врача есть свой контингент больных, поэтому наблюдение может проводиться и для целой группы людей. С практической точки зрения такие исследования могут иметь низкую степень достоверности, потому что диагнозы могут быть ошибочными, а определение причинно-следственной связи неточным. Но они все же играют большую роль в медицине, особенно в определении побочных или положительных сторон какого-то лекарства (Виагра, создаваемая для лечения легочной гипертензии, в результате случайных наблюдений оказалась впоследствии популярным препаратом для лечения эректильной дисфункции) или новой схемы лечения, что не было замечено при их испытании в других исследованиях в силу определенных обстоятельств (например, несоблюдение правил выборки или фальсификация результатов). До появления строгих правил контроля введения в практику новых лекарственных препаратов, проверки их качества и эффективности, именно регистрация и публикация случаев, например, осложнений после применения какого-то препарата, позволила выявить опасность ряда лекарств и запретить их продажу (диэтилстильбэстрол при беременности и пороки развития половых органов у новорожденных девочек).
Исследования «случай-контроль» тоже относят к группе обсервационных исследований, но они организованы лучше, а также благодаря им появляется возможность обнаружить или проверить факторы, ведущие к развитию заболевания, то есть подтвердить или опровергнуть причинно-следственную связь. Такие исследования могут иметь несколько групп участников, в том числе контрольную группу, в которую обычно входят здоровые люди, или же это могут быть люди, страдающие одинаковым заболеванием, но имеющие разную степень (стадию) этого заболевания по сравнению с другими группами. Этот вид исследования очень удобен в изучении редких заболеваний, так как может проводиться длительный период времени. Когортные или панельные исследования тоже относятся к обсервационным исследованиям, но они затрагивают большие группы людей-участников, нередко тысячи и десятки тысяч людей. Когорта — это выборка, создание группы участников-добровольцев по определенным критериям. Такие исследования могут проводиться в нескольких центрах, в том числе в разных странах, а также длительный период времени. Когортные исследования могут быть ретроспективные, то есть «со взглядом» в прошлое. Например, исследователь изучает заболеваемость какой-то болезнью в течение последних двадцати лет в определенном медицинском учреждении или местности. Часто ретроспективные исследования проводятся для изучения факторов риска, которые могли привести к заболеванию. Однако большим упущением таких исследований является неточность информации, зарегистрированной в амбулаторных карточках и историях болезни. Часто важная информация может отсутствовать по разным причинам. Чтобы проследить зависимость между причиной и следствием в рамках реального временного периода, проводят проспективные исследования — с перспективой в будущее. Такие исследования позволяют изучить влияние разных факторов на получение определенного исхода. Они также могут быть интервенционными, то есть сиспользованием какого-то лечения, или неинтервенционными (исследования без вмешательства). Исследования эффективности, а также вреда новых лекарственных препаратов, схем лечения, новых методов лечения (например, хирургических), приборов, аппаратов требуют более сложного дизайна, с помощью которого устраняется влияние исследователя и участников эксперимента на полученные результаты. Для этого проводят рандомизацию, которая подразумевает случайную выборку групп участников в отношении получения ими лечения, или разных видов лечения, или наблюдения без вмешательства. Такие исследования очень важны в оценке эффективности и полезности лечения, в том числе в обнаружении и изучении побочных эффектов и осложнений. Практически любые исследования новых лекарственных препаратов и приборов должны быть рандомизированными. Нерандомизированные исследования по изучению лечебных вмешательств проводятся редко, их называют квазиэкспериментами. Такой вид исследования могут применять тогда, когда необходимо изучить влияние вмешательства на какую-то конкретную группу населения (популяцию) и их рандомизация нерациональна. Рандомизация, то есть выборка добровольцев, которые подходят по определенным критериям для участия в исследовании, проводится до того, как участники получат терапевтическое вмешательство (интервенцию). Чтобы результаты имели большую степень достоверности, важно свести к минимуму влияние исследователя на подбор групп добровольцев. Ведь не исключено, что он может выбирать участников по своим личным критериям, стараясь получить желаемые результаты, например, для внедрения в будущем на рынок исследуемого препарата (собственно говоря, так проводились исследования вплоть до конца прошлого века, когда результаты подтасовывались подборкой «нужных» участников). Хотя рандомизацию описывают как результат «орел или решка» при броске монеты, на самом деле первая рандомизация проводилась с помощью заклеенных, без надписей, конвертов, в которых было уведомление, в какую лечебную или контрольную группу включен участник. С усовершенствованием техники начали использовать телефоны, компьютерные программы, а сейчас рандомизацию можно провести онлайн через веб-сайты исследований. Нередко в исследованиях, изучающих эффективность лечебного препарата или прибора, используют плацебо (пустышку). Использование плацебо ограничено, так как учитывают риск серьезного и необратимого ущерба для здоровья участников в случае получения плацебо, то есть отсутствия лечения. Существует также понятия единичного или двойного слепого исследования, когда говорят о рандомизированных контролируемых исследованиях. Понятие «слепое» все чаще заменяется корректным понятием «маскированное», чтобы не обидеть людей, имеющих проблемы со зрением. Маскировка необходима для того, чтобы устранить не только влияние исследователя на исход и результаты исследования, но и влияние самих участников-добровольцев. Например, если одна группа будет принимать лекарство, а другая — плацебо, и участники будут знать, что они принимают, результаты получатся недостоверными из-за психологического влияния и даже негативного отношения к выполнению требований исследования. Поэтому при единичной маскировке участники не знают, к какой группе они принадлежат и что они принимают. Такая маскировка не всегда возможна (например, при проведении хирургического вмешательства, когда пациент знает об этом и готовится к операции). При двойной маскировке не только участники не знают, что они получают в виде лечебного препарата, но и врач не знает этого тоже. После завершения наблюдения за участниками и сбора всей необходимой информации маскировка снимается и проводится статистический анализ полученных данных. Рандомизированные контролируемые двойные маскированные исследования считаются золотым стандартом для изучения эффективности лечения и безопасности лекарственного препарата. После обсуждения правил проведения клинических исследований многие страны приняли международные стандарты Good Clinical Practice (Надлежащая клиническая практика) — этические нормы и стандарты качества научных исследований — в 1980–1990-х годах как результат «Интернациональной конференции по гармонизации технических требований для регистрации фармакологических средств для использования людьми» (ICH). Существует также Надлежащая лабораторная практика. Международные стандарты позволяют проводить исследования схематично с ведением необходимой документации, что может быть проверено рядом инстанций. Документация хранится от 10 до 25 лет. Практически основной целью принятия этих международных стандартов является защита прав людей, добровольных участников, от злоупотребления их телом и биологическим материалом, полученным от участников, и предотвращения вреда их организму. Поэтому при проведении большинства исследований требуется информационное согласие пациентов, нередко в письменной форме, что защищает права человека в первую очередь. Информационное согласие требуется не только при проведении клинических исследований, но и при лечении в виде хирургического (инвазивного) вмешательства, если человек находится в сознании и компетентен в принятии решения. Исследования новых лекарственных препаратов и приборов имеют клинические и неклинические фазы. Неклиническая фаза (фаза 1) может проводиться на животных или в лабораторных условиях. В клинические фазы (2–4) вовлечены добровольцы. Каждая фаза имеет свои цели — от определения безопасности препарата до его эффективности, а также зависимости эффекта от дозы. Проведение этих фаз исследований требует длительного периода времени. На внедрение нового лекарственного препарата в практику (фактически введение на рынок) в развитых странах уходит 15–20 лет и требуются финансовые затраты минимум в 15–20 миллионов долларов. Это колоссальные затраты времени и денег без гарантии получения разрешения на производство и продажу лекарства. Поэтому во всем мире наблюдается значительное уменьшение количества регистрируемых новых лекарственных препаратов. Наименьшее количество применения лекарств и введения новых наблюдается в акушерстве (практически не более 1–2 препаратов в течение 10–15 лет), что связано с вопросами безопасности в отношении влияния препаратов на развивающийся плод. Чтобы получить статистически значимый результат, исследователь (нередко с помощью специалистов по биостатистике) должен определить, какое количество участников необходимо, и часто это количество может изменяться в зависимости от скорости проведения исследования и многих других факторов, способствующих или препятствующих этому проведению. Чем больше участников, тем более достоверные статистически результаты можно получить.
1.3.2. Систематические обзоры и мета-анализ данных
Каждый год во всем мире проводится от нескольких тысяч до нескольких десятков тысяч исследований — лабораторных, клинических, рандомизированных и обсервационных. Каждый год публикуется несколько десятков тысяч статей и других видов публикаций на тему медицины и здоровья. Как определить в этом бесконечном потоке информации ту, которую можно назвать достоверной, а значит, использовать на практике, для обучения и с другими целями? Большинство врачей и других специалистов не имеют времени не только читать, но даже просматривать все интересующие их публикации, а также анализировать полученные результаты. Данные какого-то исследования на первый взгляд могут показаться правдивыми и точными, но анализ критериев выборки участников, метода проведения исследования, сбора информации может выявить немало погрешностей, что кардинально изменит восприятие полученных результатов. Многие исследователи используют сравнительный анализ полученных данных, часто с данными других исследований. А так как все данные выражены в показателях, а значит цифрах, можно провести определенные математические расчеты, характеризующие статистическую обработку результатов. Благодаря такому анализу можно также определить уровень вероятности ошибки и другие статистические показатели. Но опять же, большинство врачей, в том числе исследователей, не знают, как правильно проводить статистическую обработку полученных данных. Арчи Кокран (1909–1988) — шотландский врач и основатель доказательной медицины, большую часть своей трудовой жизни посвятил сбору и систематизации публикаций результатов разных клинических исследований. Он был также отличным статистиком, поэтому сравнивая данные разных публикаций, в том числе на одну и ту же тему, он пришел к выводу, что заключения могут быть настолько противоречивыми, что трудно выбрать самый достоверный результат для использования его на практике или с другими целями. В 1972 году он опубликовал монографию «Эффективность и действенность: случайные отражения на медицинской службе», которая имела колоссальное влияние на многих врачей и привела к возникновению Кокрановской библиотеки, а в дальнейшем Кокрановского сообщества. Сейчас данными систематических обзоров (ревью) пользуются все врачи и ученые мира. Что собой представляет систематический обзор публикаций и чем он отличается от литературного обзора? Например, какой-то врач решил исследовать имеющиеся публикации на интересующую его тему и написать свою статью или книгу. В обзор литературы он может включить результаты исследований, независимо от метода и качества их выполнения, а также со статистической обработкой данных и без нее. Другими словами, подбор статей и других публикаций может затрагивать личные предпочтения врача. Систематический обзор начинается с подбора качественных исследований, а личные предпочтения врача или статиста при этом устраняются. Например, исследователя интересует вопрос влияния какого-то фактора на исход какого-то заболевания. Проведя поиск публикаций через доступные ему библиотеки, он обнаружил, что существует несколько сот публикаций на интересующую его тему. Одни данные показывают положительную связь, другие отрицательную, третьи — противоречивую. Как узнать, какие данные являются самыми достоверными? Для этого необходимо оценить качество проведения исследований и проанализировать критерии выборки, методы сбора и анализа показателей, их статистическую обработку. При изучении текста публикаций исследователь приходит к выводу, что, например, возрастные группы в разных исследованиях были разными, что для оценки связи причины и следствия использовались разные показатели, что такая оценка требует контрольной группы, а ее не было, и т. д. В итоге, просмотрев все эти публикации, исследователь может остановиться только на нескольких, которые проведены по требованиям доказательной медицины. Систематические обзоры публикаций обычно проводит целая группа специалистов — это врачи, ученые, биостатистики, математики и другие. Из нескольких десятков тысяч публикаций после просмотра их содержания для анализа оставляют несколько десятков. Затем после более детального анализа и учета многих критериев публикаций остается еще в несколько раз меньше, иногда остаются единичные публикации. Фактически подготовка материала для систематического обзора и мета-анализа является чрезвычайно кропотливой поисково-аналитической работой и требует знания и понимания международных стандартов проведения клинических исследований, основ статистического анализа, а нередко специализации в какой-то отрасли медицины. После выбора самых качественных публикаций полученные данные нескольких исследований сводятся в одно целое, и проводится их мета-анализ — глубокий статистический анализ, который увеличивает статистическую надежность, может обобщить несколько исследований, обнаружить ошибки в систематизации, объяснить разнообразие данных. Статистический анализ проводят с помощью специальных компьютерных программ, которые значительно облегчают проведение различных математических расчетов и устраняют многие ошибки, которые могут быть вызваны влиянием разнообразных факторов. Нередко систематическое ревью и мета-анализ могут привести к заключению, что имеющихся данных разных исследований недостаточно для выводов, потому что их достоверность низкая, с учетом данных статистической обработки, даже если было проведено уже несколько сот и даже тысяч исследований на выбранную тему. Это означает, что требуется проведение новых клинических исследований, но по правилам доказательной медицины. Интересно, что систематические обзоры и мета-анализ сотен тысяч публикаций, накопившихся за последнее столетие, опровергли многие утверждения, пошатнули многие догмы, вынудили ученых и врачей посмотреть на многие методы диагностики и лечения по-новому, принять факты неэффективности многих лекарственных препаратов и схем лечения. Они стали тем революционным толчком, который изменил медицину, соединив научные данные с практикой и позволив врачам оказывать помощь эффективнее.1.4. Когда научная информация считается достоверной
При рассмотрении различных методов научно-клинических исследований, становится понятным, что не все данные таких исследований могут быть достоверными. Значит ли, что результаты, полученные при наблюдении заболеваний или побочных эффектов терапии, имеют меньшую значимость и достоверность, чем результаты крупных рандомизированных исследований? Нет, такие результаты тоже могут быть точными и достоверными — это зависит от того, насколько устранены погрешности в проведении наблюдений, сбора данных и их анализе. История медицины знает множество примеров, когда крупные рандомизированные исследования закрывались преждевременно, потому что они проводились не по правилам доказательной медицины или же появлялись новые данные о вреде исследуемого лекарственного препарата или прибора. Для человека без медицинского образования определить достоверность информации не так просто, если вообще возможно. Чаще всего он получает такую информацию не из научных и профессиональных медицинских источников, а из средств массовой информации и публикаций людей, не имеющих медицинского образования. Она подается нередко в виде «сенсационных открытий» — такие-то ученые или такой-то известный ученый открыли то да это. Известность часто создана искусственно, особенно если это заграничный врач, вовлеченный в продажу каких-то «чудо-препаратов». Для большей «достоверности» добавляются титулы (академик, профессор) или премии (нобелевский лауреат, обычно мнимый). Поэтому все же основным источником правдивой и достоверной информации должен быть врач, к которому обращаются за помощью. Этот вариант идеальный и в реальной жизни чаще отсутствует, чем присутствует. Какими критериями оценки достоверности информации пользуются прогрессивные врачи или какие данные исследований они могут использовать на практике, в том числе с целью повышения уровня собственных знаний и знаний своих пациентов? На современном этапе развития медицины считается, что информация, предоставленная систематическими обзорами и мета-анализами публикаций, является самой достоверной, так как она прошла проверку через критерии доказательной медицины, клинической эпидемиологии и биостатистики. Второй источник достоверной информации — это данные контролируемых рандомизированных исследований, проведенных по правилам доказательной медицины. Нередко на одну и ту же тему проводилось или проводится несколько исследований, в том числе рандомизированных. Преимущество в таких случаях отдается результатам тех исследований, которые не только правильно проведены, но и статистическая обработка полученных данных тоже проведена современными методами биостатистики. Третий источник достоверной информации представляет собой данные контролируемых клинических исследований, но без рандомизации, а также из хорошо организованных когортных исследований и по типу случай-контроль. При оценке полученных данных учитываются многие показатели. Современные публикации требуют от авторов (исследователей) соблюдения определенной схемы содержания статьи, которая включает описание дизайна исследования, как проводился подбор участников, сбор данных и их статистический анализ. Для думающего прогрессивного врача важно знать не только результаты и выводы, но и проводить собственную оценку исследования, данные которого его заинтересовали. Выявление достоверности информации требует определенных навыков от тех, кто читает (и изучает) публикации на тему медицины и здоровья. Эти навыки, как вообще любые навыки, формируются со временем и практикой изучения статей и книг. В помощь врачам многие профессиональные издания оценивают полученные данные клинических исследований или утверждения авторов публикаций и обозначают буквами алфавита или цифрами, отображающими степень или качество доказанной достоверности таких утверждений (evidence-based levels and recommendations). В каждой стране могут быть незначительные различия в оценке данных, но практически уровень I или А считается самым высоким, а уровни III или D-I — самыми низкими по степени достоверности данных или утверждений. Существует несколько других систем оценки достоверности опубликованных статей, особенно с результатами данных проведенных исследований. Популярной становится «GRADE working group» — новая система оценки данных, включающая несколько десятков критерий-параметров, по которым проводят сравнительный анализ и оценку не только качества результатов исследования, но и выводов и рекомендаций, предлагаемых авторами публикаций. Благодаря компьютеризации и интернетизации многих процессов разрабатываются новые методы оценки достоверности данных научных и клинических исследований. В скором будущем это позволит ориентироваться в интенсивном потоке научной и медицинской информации как многим врачам, так и людям без медицинского образования, а также пользоваться данными этих исследований с большей уверенностью в их правдивости, точности и достоверности. Все чаще прогрессивные врачи предоставляют современные медицинские публикации своим пациентам во время приема, несмотря на то, что многие статьи могут быть написаны сложным для понимания человеком без медицинского образования языком. Тем не менее, когда речь идет о выборе вида лечения и, если такое лечение может сопровождаться рядом серьезных осложнений, предоставление важной информации о болезни, новых достижениях в диагностике и лечении, альтернативных методах лечения, осложнениях заболевания и лечения является не только необходимым для принятия решения, но и частью образования пациента и просветительной работы.2. ЧТО ТАКОЕ ПРОГЕСТЕРОН
2.1. Понятие об органических веществах
Биохимия — это наука, которая изучает химические вещества и химические процессы в живых организмах. Первоначально эта отрасль химии называлась органической химией, так как первыми веществами, которые начали использоваться людьми, были животные жиры в производстве мыла. Живая материя, или материя организмов, обладала уникальными свойствами, интригующими многих ученых прошлых веков, поэтому была наделена ими мистической витальной силой. В 1816 году из жиров и ряда других веществ было создано мыло, а в 1828 году удалось получить искусственную мочевину, свойства которой не отличались от природной мочевины (читайте также раздел «История открытия прогестерона»). Позже органическими веществами начали называть те, которые в своей структуре содержали атомы углерода. Углерод (С) — является неотъемлемым химическим элементом, одним из самых важных наряду с кислородом и водородом, — основой строения любого живого существа. Помимо органических веществ, живые организмы содержат многие другие ингредиенты — воду, металлы, соли, газы, кислоты, щелочи и др. Практически функционирование живой материи, начиная с доклеточного уровня и заканчивая органным и организменным уровнем, происходит благодаря обмену веществ путем биохимических реакций и обмену энергии путем биофизических процессов.2.2. Знакомство с прогестероном
Прогестерон — это уникальное вещество, которое вырабатывается живыми организмами, в том числе человеком. Несмотря на то, что без него невозможна жизнь очень многих животных, прогестерон может быть, как полезным, так и вредным для человека, в зависимости от многих факторов и условий, а также вмешательства в биохимические процессы организма со стороны. Другие названия прогестерона следующие: гормон желтого тела, лютеиновый гормон, прогестационный гормон, лютеальный гормон, лютеогормон, лютин, NSC-9704, гормон беременности, прегнандион, прогестеронум, 4-прегнен-3; 20-дион. В некоторых странах могут быть свои специфические названия этого гормона. Химическая формула прогестерона C21H30O2. На современном рынке существует более сотни препаратов прогестерона, химическое строение которого идентично натуральному, хотя между современным «натуральным» прогестероном и человеческим прогестероном имеется различие, о чем упоминается в других главах книги.
Так ли необходимо знать о строении прогестерона и деталях его синтеза и обмена? Для человека без медицинского образования эти данные покажутся скучными и ненужными. Но врачам, особенно тем, кто пользуется разными формами прогестерона и прогестинов в своей практической деятельности, эта важная информация необходима. Проблема современной подготовки медицинских кадров почти во всем мире состоит в том, что знания, получаемые в результате изучения органической химии, биохимии, биофизики, физиологии, анатомии и других наук — основ медицины, редко используются в интеграции с клинической медициной; функция организма и заболевание рассматриваются через призму разных наук порознь. Задача будущих врачей — это соединение и совмещение полученных знаний на начальных курсах обучения с практической медициной, которой они обучаются значительно позже. Но к этому времени многие знания забываются. Заболевания рассматриваются поверхностно: причины, симптомы, диагностика, лечение, часто в виде краткосрочного запоминания для сдачи экзаменов, но не для понимания работы человеческого организма. Почему и как возникают отклонения на химическом и физическом уровне, чтобы понять также действие лекарственных препаратов при этих отклонениях — эта связь остается в стороне или теряется в процессе обучения. Только самоусовершенствование и самообучение, с обретением опыта, помогают врачам восстановить утерянные и забытые логические цепочки между полученными знаниями в прошлом. Однако большинство врачей так и остается всю свою практическую деятельность на уровне примитивных знаний, заученных наизусть нескольких распространенных заболеваний. Миф о всемогуществе прогестерона порожден, в первую очередь, теми врачами, которые верили в другой миф, а точнее, лжетеорию — «прогестерон — гормон беременности, поэтому без него она невозможна». С одной стороны, такое утверждение правдиво. Но, с другой стороны, если только придерживаться этого утверждения и не понимать механизма действия прогестерона в организме человека, в том числе беременной женщины, можно сделать немало ложных выводов, что и произошло в жизни постсоветских женщин, которые вслед за врачами начали развивать эту лжетеорию и жить ею.
2.3. Понятие о стероидных веществах
Прогестерон называют стероидным гормоном и обозначают Р4. Все без исключения стероидные вещества по строению имеют общее образование — 4 углеродных кольца, которые часто называют ядром стероидов, или гонаном, и обозначают латинскими буквами по порядку слева направо — А, В, С и D. Помимо 17 атомов углерода, образующих гонан, в состав стероидных веществ могут входить атомы кислорода и водорода, образующие целые химические группы (метиловая группа, гидроксильная группа и другие). В природе существует несколько сот стероидных веществ. Стероиды находят в растениях, насекомых, животных и грибках. Также современная фармакопея насчитывает несколько сот синтетических стероидов, которые используются не только в медицине, но и в некоторых хозяйственных отраслях. Считается, что появление стероидов в природе связано с повышением уровня кислорода в атмосфере. Большинство процессов в живых организмах проходит по принципу присоединения атомов кислорода (окисления) и их потери. Традиционно все стероидные гормоны делятся на пять классов: эстрогены, прогестероны, андрогены, глюкокортикоиды и минералокортикоиды. Минералокортикоиды отвечают за регуляцию обмена солей и электролитный баланс. Глюкокортикоиды принимают участие в обмене углеводов, а также влияют на выведение калия и на обмен азота. Половые гормоны регулируют работу репродуктивных органов, но также оказывают влияние на многие другие системы органов. В гинекологии чаще всего применяются эстрогены, прогестероны и андрогены. В акушерстве — глюкокортикоиды, редко прогестерон и эстроген. В эндокринологии — все пять классов, в зависимости от вида заболевания. В 50-х годах прошлого века о биологическом воздействии стероидных гормонов знали мало. Основное внимание было отведено глюкокортикоидам, особенно кортизолу, который начали широко использовать для лечения различных заболеваний. Исследования прогестерона и эстрогенов оставались в стороне вплоть до 70-х годов, хотя ученые и врачи интенсивно работали над созданием гормональных контрацептивов, а поэтому были в поиске новых синтетических гормонов, заменителей прогестерона и эстрогена.2.4. Прогестерон как гормон
Можно не помнить детально строение прогестерона (даже биохимики не знают наизусть строения всех органических веществ), можно не знать процесса обмена веществ в организме человека, но все же важно запомнить несколько важных «моментов», касающихся строения и функции этого органического вещества. Обретенные знания помогут понимать, как функционирует организм человека, какие процессы происходят в нем и как эти процессы влияют на определенные органы и весь организм в целом. Итак, важно запомнить, что прогестерон — это стероидное вещество, и этот факт должен создать у думающих людей понимание, что между стероидами существует взаимосвязь, как существует связь между представителями одной большой семьи: родители, братья, сестры, внуки, правнуки и т. д. Между прогестероном и другими стероидными гормонами тоже существует «родственная» связь, о чем мы поговорим ниже. Многие читатели знают, что гормональные препараты необходимо назначать с осторожностью, что существуют анаболики, гормоны стресса (кортизол), многие слышали о глюкокортикоидах. Стероидные гормоны начали тоже назначаться многими врачами необоснованно в результате малограмотности, гипердиагностики и некомпетентности, в том числе и беременным женщинам. Но пока что в постсоветском обществе не существует миф о необходимости назначения глюкокортикоидов чуть ли не всем подряд людям при чуть ли не всех заболеваниях или для профилактики этих заболеваний. Пока что здравый смысл и определенное понимание серьезности гормонального вмешательства в работу человеческого организма контролируют тотальное увлечение стероидными препаратами. Исключением из этой группы лекарственных препаратов является прогестерон, и такая исключительная привилегия поглощения этого стероида женщинами наблюдается только в бывших странах СССР и нигде более.2.4.1. Прогестерон — половой гормон?
О прогестероне знают практически все женщины. В очень многих источниках информации, в том числе медицинских, можно найти определение прогестерона как полового гормона. Это вещество назвали женским половым гормоном еще в начале прошлого столетия, когда были обнаружены мужские половые гормоны. Если у мужчин имеются мужские половые гормоны, считалось, что у женщин должны быть женские половые гормоны. А так как из яичников получали экстракт, содержащий прогестерон, и позже этот гормон был обнаружен в плаценте (детском месте), то возникло предположение, которое стало ложным постулатом на многие-многие годы, что прогестерон — это женский половой гормон. В организме человека в действительности имеются женские и мужские половые гормоны независимо от того, мужчина это или женщина, но в разном количестве и разной пропорции. Мужские половые гормоны называют андрогенами, а женские половые гормоны — эстрогенами. Хотя прогестерон воздействует на женскую репродуктивную систему и участвует в регуляции менструального цикла, однако этот гормон не является половым гормоном. Наибольшее количество прогестерона вырабатывается во время беременности плацентой — почти в 15 раз больше, чем яичниками женщины в первые недели беременности. Поэтому прогестерон называют нередко гормоном беременности. Но важно понимать, что выработка прогестерона при беременности после успешного прикрепления плодного яйца к стенке матки (имплантации) не зависит от работы яичников женщины, от желтого тела беременности, а происходит независимо и автоматически за счет биохимических процессов в плаценте, которая является производным плодного яйца, а не матери. Независимо от того, является ли плод девочкой или мальчиком, количество вырабатываемого прогестерона плацентой и частично плодом одинаково. Таким образом, ни пол будущего ребенка, ни женский пол матери не определяют выработку прогестерона при беременности. Вырабатываемый же плодным местом прогестерон практически не усваивается организмом матери, а употребляется плодом для выработки важных гормонов и других химических веществ. Ошибочно принято считать, что для женского организма ключевым моментом в его функционировании играет соотношение эстрогенов и прогестерона. Но что же в таком случае является ключевым моментом в функционировании мужского организма? Уровень мужских половых гормонов — тестостерона, так обычно звучит ответ. Но верно ли это? Если учитывать биохимические процессы и выработку всех половых гормонов, то и для женщины, и для мужчины важна нормальная физиологическая пропорция трех гормонов — прогестерона, тестостерона и эстрогена, и не иначе. Важно понять, что в процессе созревания половых клеток доминирует не пропорция эстроген/прогестерон, а пропорция тестостерон/эстроген через матричный гормон — прогестерон и гормоны гипофиза. Степень пропорции зависит не только от дня менструального цикла, но и от возраста, питания, режима отдыха и работы, наличия стресса и довольно часто может колебаться.2.5. Роль холестерина в выработке прогестерона
Прогестерон является производным холестерина (международное название — холестерол). О вреде этого вещества создано немало мифов и слухов, однако только сейчас, благодаря интенсивному изучению биохимических процессов на молекулярном и атомном уровне, врачи и ученые начали говорить о холестерине положительно, понимая его огромное значение для нормального функционирования человека. Слово «холестерол» является производным двух греческих слов: «холе» означает желчь, а «стереос» (как и в слове «стероиды») — «твердый», потому что он впервые был выделен в 1769 году в твердом состоянии из желчных камней французским врачом и химиком Пулетье де ла Саль. Окончание «ол» означает, что холестерол принадлежит к классу спиртов. Холестерин является очень важным веществом — основой стероидных гормонов и желчных кислот. Он также входит в состав клеточных оболочек (мембран), делая их прочными и водостойкими. Все без исключения клетки человека вырабатывают собственный холестерин, но наибольшее количество этого органического вещества производится печенью, кишечником, репродуктивными органами и надпочечниками. Для синтеза холестерина необходимы жиры, которые поступают с пищей. Поэтому при нехватке жиров наблюдается нарушение выработки не только холестерина, но и стероидных, и особенно половых гормонов, и репродуктивная функция человека может тормозиться или полностью выключаться. Большое количество готового холестерина также поступает с продуктами питания, в частности животного происхождения.2.6. Прогестерон как матрица стероидных гормонов
Итак, прогестерон не является половым гормоном, поэтому не принадлежит ни к эстрогенам, ни к тестостеронам. Он также не является глюкортикоидом и анаболиком. К какой группе стероидных гормонов он принадлежит в таком случае? Ни к какой — и это важно понимать. А чтобы понимать, почему прогестерон вне всяких групп стероидных гормонов, необходимо вспомнить синтез (выработку) стероидных гормонов в организме человека. Синтез прогестерона, как и холестерина, тоже зависит от достаточного количества жиров в организме. Но говоря о прогестероне как об особенном виде вещества, его смело можно назвать «прародителем» всех стероидных гормонов, в том числе половых. Приведенная ниже схема отражает не только процесс выработки стероидных и половых гормонов надпочечниками и яичниками, но и взаимосвязь между всеми стероидными гормонами человека.
Обычно в учебниках по медицине вопросы выработки гормонов освещены поверхностно, поэтому врачам и людям, интересующимся вопросами здоровья и заболеваний, увидеть и понять взаимосвязь между многими веществами в организме человека очень трудно. Любая болезнь обычно рассматривается в каком-то отдельном ракурсе, хотя известное древнее выражение «если страдает один орган — страдает все тело» отражает философские законы, в том числе закон перехода количества в качество, и наоборот. Можно не помнить названий всех промежуточных и конечных продуктов выработки стероидных гормонов — и таких веществ множество (далеко не все они приведены в схеме). Можно даже забыть последовательность химических реакций, однако важно принять к сведению несколько фактов: Прогестерон является матрицей всех стероидных и половых гормонов — и именно этой важной ролью, ролью прародителя, определяется его функция для всего организма. Все женские половые гормоны (обозначены красным цветом на схеме) являются производными мужских половых гормонов (обозначены синим цветом) — понимание этого важного факта позволит избежать многочисленных ошибок при интерпретации результатов обследования, когда на мужские половые гормоны и продукты их обмена смотрят как на лютых врагов женского организма и стараются всеми силами «откорректировать гормональные погрешности». Существует несколько параллельных путей выработки того или иного вещества, и выбор этого пути зависит от вида клеток, которые вовлечены в процесс синтеза стероидных и половых гормонов, и от вида органа и его функции. Все биохимические реакции, вовлеченные в процесс обмена холестерина, а значит прогестерона и его производных, возможны только при наличии определенных условий, а также при наличии специальных органических веществ — ферментов или энзимов. Эти субстанции чаще всего белковой природы и играют роль ускорителей (катализаторов) биохимических реакций путем понижения энергетических затрат для возникновения этих реакций. Существуют тысячи энзимов, но чаще всего в одно звено биохимической реакции вовлечен один вид энзимов. Выработка энзимов регулируется генами, поэтому поломка на уровне генов (чаще всего в виде так называемого единичного нуклеотидного полиморфизма) может привести к нарушению их выработки. Но природа всегда находит компенсаторные пути синтеза веществ и помогает организму функционировать, несмотря на поломки на уровне генов. Благодаря наличию разных ферментов многие процессы обмена стероидных гормонов в организме человека являются обратимыми, что позволяет одним видам стероидов превращаться в другие, а также в их метаболиты. Все стероидные гормоны могут превратиться в своего предшественника. Исключение — прогестерон, метаболиты которого могут быть превращены в другие стероидные гормоны, но не могут заново участвовать в синтезе самого прогестерона. Понимание того, что прогестерон является матрицей для других гормонов — это не только ключик к пониманию многих процессов на гормональном уровне, но и к пониманию функционирования органов репродукции, надпочечников, а также возникновения зачатия и развития беременности.
3. ИСТОРИЯ ОТКРЫТИЯ ПРОГЕСТЕРОНА
Когда речь идет о мифах и слухах, доминирующих в обществе, экскурс в историю нередко помогает установить начало появления мифа, определить причину возникновения неправдивой и ложной информации. Тысячелетиями людей интересовали вопросы, в чем различие живого и неживого, как устроены живые организмы и как они функционируют, в том числе как устроен и работает человеческий организм. Но науки того времени находились на примитивном (по сравнению с современным) уровне и давали весьма туманные и неправдоподобные ответы на такие вопросы.3.1. Витализм
Врачи 17–18-го столетий были прекрасными анатомами, потому что проводили тысячи вскрытий. А люди в те времена умирали в таком количестве, что для современного человека такие уровни смертности кажутся просто невероятными. Например, в Европе конца 17-го века и начала 18-го века из 100 родившихся детей до 16 лет доживало только 25. Часто захоронение трупов даже не проводилось, поэтому некоторые анатомы проводили на городских свалках мертвецов чуть ли не каждый день. Изучение строения тела человека позволило создать анатомические атласы, которыми с учетом небольших поправок современные врачи пользуются до сих пор «Урок анатомии Фредерика Рюйша» (худ. Адриан Баккер) Однако жизнь оставалась покрытой тайной. Как функционирует живой организм — ни врачи, ни ученые не могли толково объяснить. Попытки найти вещество, которое движет жизнью, были равносильны попыткам изобрести вечный двигатель или найти философский камень. Так возникла теория витализма, согласно которой все живые существа имели внутри мистическую жизненную субстанцию. Эту субстанцию невозможно было определить, потому что у мертвых ее нет, а попытки вскрыть живого человека или животное в поисках этой субстанции, конечно, приводили к гибели организма, то есть эта субстанция каким-то образом «удалялась», испарялась, исчезала, чтобы не быть обнаруженной. В эту теорию верили многие ученые, и она в значительной степени парализовала изучение веществ живых организмов на продолжительный период времени.
3.2. Появление органической химии
В начале и середине 19-го столетия химия начала обретать силу, она стала вытеснять алхимию, применяя научный подход в анализе полученных данных. До этого алхимики и химики проводили эксперименты, смешивая различные вещества в разных пропорциях, но они практически ничего не знали о химических элементах и не умели записывать уравнения химических реакций. Нередко открытия в прикладных науках — это дело случая. В 1828 году немецкий химик, Фридрих Вёлер, проводил эксперимент, который завершился «неудачно», потому что вместо желаемого вещества ученый получил мочевину. Витализм утверждал, что все органические вещества являются продуктами «жизненной силы» и не встречаются в неживой природе. Но получение мочевины синтетически из «неживого» вещества опровергало теорию витализма, потому что теперь между живым и неживым устанавливалась связь, а также выходило, что живые существа созданы из тех же элементов, что и неживые. Хотя Вёлера считают отцом органической химии, за такие смелые идеи и эксперименты его осуждали и критиковали длительный период времени.
Вёлер первым установил связь между живым и неживым, однако практическое применение в медицине такая связь получила только почти шестьдесят лет спустя. Во многих исторических источниках химики того времени характеризуются как упрямые, гордые, независимые ученые, мало интересующиеся применением результатов своих экспериментов в медицине.
3.3. Эксперименты Уильяма Генри Перкина
Иногда я в шутку говорю, что своим появлением прогестерон обязан хлопку. Когда Индия стала колонией Англии, тысячи кораблей с хлопком стали направляться в Английское Королевство. Это привело к резкому подъему и развитию текстильной промышленности и получению дешевой хлопчатобумажной ткани. Англия стала не только империей по количеству колоний, но и монополистом в текстильной промышленности. Однако для окраски тканей имелось всего два вида натуральных красителей — красный (бордовый) и синий (индиго). Остальные красители были слишком дорогими и использовались только аристократией.
Проблема состояла в том, что производство красителей было длительным и дорогостоящим, требовало определенных навыков от производителя, а результат не всегда был продуктивным, да и количество получаемых красителей было слишком небольшим, чтобы удовлетворить нужды текстильщиков. В 1856 году 18-летний английский студент Уильям Генри Перкин, проводя химические эксперименты в своей небольшой жилой комнате, половину которой занимал стол с реактивами, получил первый синтетический краситель — анилин, окрашивающий шелк в фиолетовый цвет. Так как Перкин увлекался рисованием и фотографией, сначала он хотел создать новые краски для живописи. Однако вскоре этим красителем заинтересовались текстильщики, так как производство нового красителя было очень дешевым, быстрым и легким.
3.4. Возникновение немецкой школы органической химии
Пока Перкин концентрировал внимание на продаже своего красителя, новость об анилине распространилась по всей Европе. Исторически так сложилось, что мир уже был разделен на колонии и захвачен Англией, Испанией, Францией и Германией.Развитие текстильной индустрии делало Англию мировым монополистом. Получалось, что Германия оставалась в стороне от экономики Европы, не имея первенства ни в чем, хотя до 1918 года Германская империя имела влияние на огромной территории, куда входили и Австрия, и Венгрия, часть Польши и Украины, и ряд колоний в Африке, Азии и Тихом Океане. И тогда несколько талантливых немецких химиков объединились и начали интенсивную работу по созданию дешевых синтетических красителей. Вскоре Германия тоже стала мировым монополистом по производству и продаже анилиновых красителей, которые начали использоваться во многих индустриях. Именно с появлением сильной, хорошо оснащенной школы органической химии в Германии мы связываем и появление прогестерона.3.5. Первый союз органической химии и медицины: работа Пауля Эрлиха
Многие врачи, особенно немецкие, увлекались органической химией, которая начала процветать в Германии в конце 19-го века. Но они не могли проводить эксперименты в том количестве и на том уровне, как это делали ученые-химики. Опять же, химики не были заинтересованы в сотрудничестве с врачами. Они грезили созданием новых синтетических веществ. Тем не менее, среди тысячи врачей были уникумы, которые пробовали соединить достижения органической химии с медициной.
Пауля Эрлиха, немецкого врача, который был увлечен изучением тканей и организмов на микроскопическом уровне, интересовал вопрос, как получить такое качество образцов тканей и клеток, чтобы хорошо рассмотреть их под микроскопом. В 1878 году он обнаружил, что некоторые красители могут окрашивать ткани выборочно и что разная окраска помогает увидеть некоторые структурные части клеток, которые не видны при простом окрашивании. Чуть позже у Эрлиха возникла идея целенаправленного действия лекарства, на которой базируются принципы химиотерапии. В 1908 году за эти идеи и другие разработки Эрлих был награжден Нобелевской премией. В 1910 году в лаборатории Эрлиха был создан первый химический препарат с целенаправленным действием против возбудителя сифилиса. Сальварсан (от слова salvation — спасение) прошел тестирование в лечебных учреждениях Санкт-Петербурга, а потом успешно был введен на рынок. В 1940 году он был заменен пенициллином. Несмотря на токсичность, эти «чудодейственные пули», как называли препарат, были довольно эффективными в лечении сифилиса. Это заболевание было очень распространенным в Европе в те времена. Самая сильная школа и база органической химии находилась в Германии. Немецкие и австрийские врачи имели больший доступ к информации, и это стало предпосылкой открытия прогестерона. Приоритет в обнаружении прогестерона и создании синтетического прогестерона мы должны отдать немецким ученым. С началом первой мировой войны началось тесное взаимодействие немецких химиков и врачей, но в антигуманном направлении — производстве иприта (горчичного газа) и других ядовитых газов и веществ массового поражения и изучении влияния этих веществ на организм человека.
3.6. В погоне за открытием прогестерона
Во многих источниках информации и публикациях вы найдете утверждение, что первыми прогестерон открыли американцы, или утверждение, что в поисках прогестерона участвовало четыре независимых группы ученых, две из которых были немецкие, а две — американские. Фактически приводятся публикации 1934–1935 годов, когда четыре независимые группы исследователей опубликовали идентичные статьи о выделении гормонов желтого тела яичников. Но это не совсем точные данные. Хотя в те времена не было компьютеров, интернета, и обмен информацией не мог проходить на скоростном уровне, между учеными существовала определенная связь, так как все они были участниками серьезного соревнования в поисках чудодейственного контрацептива, которым был и есть прогестерон. Совершенно верно, это не оговорка. Содержимое желтого тела интересовало ученых только с точки зрения предохранения от беременности. Три немецко-австрийские группы исследователей состояли из талантливых химиков, которые хоть и пользовались идеями врачей, однако были заинтересованы в прогестероне только как в органическом веществе, которое можно использовать для создания гормонального контрацептива. С приходом к власти нацистов в 1933 году, многие химические лаборатории были закрыты, а ученых вынудили покинуть Германию. При Третьем рейхе аборты и контрацепция были запрещены, потому что стране нужна была раса чистокровных немцев. Адольф Бутенандт, автор одной из статей о гормоне желтого тела, тесно сотрудничал с нацистами и в 1936 году стал членом нацистской партии, что позволило ему получить от правительства крупные инвестиции на продолжение создания синтетических половых гормонов, но уже не с целью контрацепции. В лаборатории Бутенандта был выделен из мочи женский половой гормон — эстрон. Благодаря поддержке нацистов этот ученый получил в 1939 году Нобелевскую премию за открытие половых гормонов. Оказалось, что одновременно с Бутенандтом эстрон был открыт и американскими врачами. Эдвард Дойзи получил Нобелевскую премию в 1943 году, но уже за синтез витамина К. Политические игры всегда имели влияние на вручение престижных премий, в том числе Нобелевской, и имеют до сих пор. Уильярд Аллен, американский гинеколог, тесно работал с австрийским химиком Оскаром Винтерштейнером, который имел связь с немецкими и австрийскими химиками и знал об их попытках выделения и синтеза прогестерона. Хотя существует некая путаница в отношении Аллена. Было два Аллена, которые причастны к открытию гормонов яичников. Эдвард Аллен работал вместе с Эдвардом Дойзи, и вместе они обнаружили эстрон в 1923 году. Уильярд Аллен работал с Оскаром Винтерштейнером, а потом с Джорджем Корнером, который к тому времени уже был известен своими публикациями на тему овуляторных циклов у животных и людей. Их совместная работа привела к выделению прогестерона. Но Аллен с коллегами всего лишь повторял эксперименты Людвига Френкеля, о которых был хорошо осведомлен от австрийского коллеги (о Людвиге Френкеле упоминается ниже). Интерес к поиску гормонов был настолько велик, что в начале 20-го столетия всего в течение двух десятилетий были опубликованы сотни статей на тему гормонов яичников, и особенно гормонов желтого тела. Не все они были напечатаны в престижных научных и медицинских журналах, поэтому не все доступны для нашего изучения сегодня. Тем не менее, колоссальный интерес ученых и врачей к вопросам женской эндокринологии поражает своим размахом. Другими словами, о гормонах яичников знали задолго до выделения прогестерона в чистом виде. Но снова вернемся в 19-е столетие.3.6.1. Первые врачи-ученые, изучавшие работу яичников, и связь между ними
Феликс-Архимед Пуше, французский врач и натуралист, был одним из первых, кто начал детально изучать репродукцию живого мира, как растений, так и животных, человека в том числе. В 1842–1847 годах он опубликовал несколько работ о значении овуляции в оплодотворении у млекопитающих. Одна из публикаций так и называлась: «Теория спонтанной положительной овуляции и зачатия (фертилизации) у млекопитающих и человека». Однако Пуше не мог объяснить механизм овуляции и зачатия — почему это происходит, что или кто контролирует эти процессы. Немецкий ученый Густав Яков Борн, увлеченный гистологией и анатомией, выдвинул гипотезу о том, что желтое тело яичников является эндокринным органом, то есть вырабатывает вещество, которое готовит матку к принятию плодного яйца, и доказал, что такое вещество существует. Он поддерживал связь со многими известными учеными, в том числе с Паулем Эрлихом, о котором упоминалось раньше. Борн изучил строение репродуктивной системы, эмбрионов и плодов многих животных, но в своих экспериментах он чаще всего использовал яйца амфибий. Он также первым провел искусственную инсеминацию лягушек, причем разных видов. За свои новшества он получил в 1887 году престижную премию.
У Борна были последователи и ученики, с которыми он обсуждал свои идеи, включая идею о роли желтого тела в возникновении беременности, и среди них были Людвиг Френкель и Франц Кон. Френкель был гинекологом, поэтому мог совмещать теорию с практическими экспериментами.
3.6.2. Появление термина «гормон»
20 июля 1905 года английский физиолог Эрнест Старлинг впервые использовал слово «гормон». Слово «гормон» в переводе с греческого означает «возбуждаю, побуждаю». Ученый записал его при обсуждении своих идей с коллегами во время обеда — один из коллег предложил назвать «странные вещества», которые уже были известны химикам и врачам, гормонами. Во время лекции на тему «Химический контроль функционирования тела» Старлинг назвал химические вещества, которые вырабатываются одними органами и переносятся кровью к другим органам-мишеням, гормонами. О каком-то конкретном гормоне речи не было. Но такое новое определение химических субстанций послужило серьезным толчком для ученых и врачей к поиску этих веществ. Первый гормон был обнаружен, выделен и синтезирован в 1901 году американским химиком японского происхождения, и это был эпинефрин, который больше известен как адреналин. Вслед за адреналином открыли секретин, потом тироксин, инсулин. К 1923 году были известны четыре гормона. Важно отметить, что многие ученые и врачи были весьма молодого возраста и горели желанием открыть что-то новое, участвовать в экспериментах, что и развивало быстрыми темпами медицину, органическую химию и ряд других наук, связанных с медициной.3.6.3. Получение прогестерона из экстракта желтого тела
Как врачи, так и алхимики, а позже и химики, пользовались экстрактом желтого тела в своих экспериментах, в том числе и в медицинских. И получали этот экстракт или вытяжку из яичников или яиц многих животных: крыс, мышей, обезьян, кроликов, коров, свиней и т. д. — вплоть до середины 20-го века. Чаще всего ученые отдавали предпочтение какому-то одному виду животных, поэтому многочисленные публикации о получении гормонов желтого тела описывали способ экстракции или кристаллизации прогестерона из желтого тела разных животных.
Людвиг Френкель не только выделил экстракт желтого тела и использовал его в лечении ряда гинекологических проблем, но и сумел привлечь внимание известного немецкого химика Карла Генриха Слотты, который в 1927 году стал зятем Френкеля. Слотта был скрупулезным в отношении химических формул и первым из химиков опубликовал книгу-атлас с формулами почти всех известных химикам того времени веществ (в основном, лекарств). Этот ученый успешно выделил прогестерон в 1930 году, а в 1933 году правильно описал его формулу. Тогда прогестерон имел название лютеостерон. Ученый использовал 1 кг желтых тел, изъятых из яичников коров, чтобы получить 30 мг твердого прогестерона. Карл Слотта славился своей неординарностью, и даже экстравагантностью в исследовании тех или иных веществ, и был известен своими работами со змеиными ядами, кофе и беременностью. Многие ученые и врачи считают этого ученого пионером гормональной контрацепции. Несмотря на активные поиски прогестерона американцами, все же немецкие, в том числе австрийские, химики и врачи начали опережать американцев в этой сфере женской эндокринологии. Имя Оскара Винтерштейнера, австрийца по происхождению, с которым работал Др. Аллен, уже упоминалось раньше. Он выделил три вещества (компонента) из вытяжки желтого тела, которые так и назвал — компоненты А, В и С. Оказалось, что компонент А не имел гормональной активности. Ни Винтерштейнер, ни Аллен не знали, что экстракт желтого тела имел несколько веществ, в том числе и прогестерон. Химическую формулу веществ тоже не удалось записать правильно. К сожалению, Слотта был изгнан из Германии с приходом к власти нацистов. Он был «чистокровным арийцем», однако его жена, дочь профессора Френкеля, была из семьи евреев. Он перебрался в Бразилию, чуть позже — в США. Немецкая школа органической химии была разрушена, уничтожена, а те ученые, которые остались в Германии, были вовлечены в совершенно другие эксперименты.
3.6.4. Россия, СССР и женские половые гормоны
Этот весьма поверхностный анализ истории гормонов желтого тела подводит к факту, что ни российские врачи в царской России, ни потом советские в СССР не принимали участия в получении и синтезе женских половых гомонов, в том числе прогестерона. Сначала Россия была поглощена первой мировой войной, а потом революцией и становлением советской власти. Интеллигенция, лучшие умы страны преследовались и уничтожались Сталиным, а те, кому удалось выехать за границу, оказались в почти каторжных условиях существования, несмотря на свою образованность (а ведь многие из них получили образование в известных европейских университетах). Правительство Советского Союза не было заинтересовано в развитии науки, особенно медицины, если ее исследования не имели военного значения. Получалось, что советские врачи не только не могли участвовать в изучении вопросов женской эндокринологии, но и пользоваться знаниями и опытом заграничных ученых и врачей. Железный занавес закрыл доступ к любой информации на эту тему. Вторая мировая война еще больше отдалила советскую медицину и науки от прогресса Европы, и Америки, больше, чем на полстолетия. Отсталость существует до сих пор. Не имея новых данных регулярно и постоянно, постсоветские врачи заполняли свои умы, а потом и умы своих пациентов теориями и предположениями, которые стали мифами. Одним из таких мифов была искаженная и неточная информация о прогестероне.3.6.5. Попытки создания синтетического прогестерона венгерским предпринимателем
Многим известно имя венгерской фармакологической компании «Гедеон-Рихтер», препаратами которой были заполнены прилавки советских аптек и теперь заполнены прилавки российских, украинских и аптек ряда других стран. История о том, как препараты этой компании оказались на советском рынке, заслуживает особого внимания, потому что она тесно переплетается с производством синтетического прогестерона и создания советского мифа о прогестероне. Гедеон Рихтер был крупнейшим, богатым венгерским предпринимателем еврейского происхождения, владельцем фармакологических компаний, фармацевтом по образованию. Он объездил всю Европу, и в 1901 году, когда был открыт первый гормон — адреналин, загорелся идеей производства и продажи гормональных препаратов и лекарственных веществ с гормональными свойствами. В этом же году он создал компанию, которая существует до сих пор. Он часто бывал в Австрии, был знаком там со многими химиками, в том числе с Людвигом Габерландтом.
Людвиг Габерландт в те годы уже был известным ученым, и многие считают его отцом гормональной контрацепции, как и Карла Слотту. Людвиг был австрийским ученым. Как и его отец, он детально изучал репродуктивную систему животных и человека. В 1921 году он сделал пересадку яичников беременной самки кролика небеременной крольчихе и получил временный контрацептивный эффект. В 1931 году он опубликовал книгу «Die hormonale Sterilisierung des weiblichen Organismus», в которой утверждал, что временная стерилизация женщин (имелось в виду контрацепция) станет весомым вкладом в создание идеального общества. К 1930 году Людвиг предложил проект производства синтетического прогестерона, однако в Австрии, да и в Европе вообще, проект по контрацепции приняли в штыки. Поэтому Людвиг обратился к Гедеону за помощью — у Рихтера были финансовая власть, высокое социальное положение, влияние на общество, многочисленные связи. Рихтер принялся за интенсивное внедрение проекта и создание первого синтетического гормонального контрацептива на основании прогестина — норэтинодрела, который Людвиг назвал инфекундином. Однако преследования семьи Габерландта продолжались — все члены семьи были изолированы от австрийского общества, да и обществ других стран, их нигде не принимали, фактически они стали домашними заключенными. Поэтому ученый не выдержал такого натиска и в начале 1932 года покончил жизнь самоубийством, когда препарат уже был готов к клиническому тестированию. Гедеон Рихтер был шокирован таким ходом событий и приостановил работу над «контрацептивным проектом», а в 1944 году он был убит фашистами. Американцы были отлично осведомлены о появлении первого синтетического контрацептива в Австрии, и уход лучших немецких и австрийских умов, их устранение как сильных конкурентов, открывали дорогу к первенству в сфере гормональной контрацепции без особых препятствий. И, к слову, забегая наперед, надо сказать, что норэтинодрел стал основой первого американского лицензированного контрацептива Эновида. Случайность? Нет, закономерность. Воплощение чужих идей и проектов.
3.6.6. Изучение контрацептивного эффекта прогестерона
Многие ученые Европы и Америки пытались выделить, то есть кристаллизовать прогестерон, что было непростой задачей. Зачем нужна была твердая форма гормона? Разве нельзя было использовать вытяжку желтого тела? Можно, и ее использовали в гинекологии, но не для сохранения беременности. Собственно говоря, абсолютно никого из врачей и ученых не интересовал вопрос о сохранении беременности. Ранние потери беременностей, как у животных, так и у человека, считались проявлением природного отбора, и это никто не оспаривал, и это было известно еще столетие тому назад. Никто из врачей не вмешивался в процесс потерь беременностей на ранних сроках. Врачи заметили, что во время беременности женщины (впрочем, как и самки млекопитающих и других представителей животного мира) не могут забеременеть повторно. Не только не могут забеременеть: у беременных женщин прекращались менструации. Точно такой же эффект наблюдался, когда животным-самкам и женщинам вводили вытяжку из желтого тела — возникала ложная беременность, прекращались менструации и такие самки и женщины теряли способность беременеть. Дальнейший поиск привел к мысли, что при беременности выделяется такое вещество, которое также имеется в желтом теле, и это вещество обладает сильным контрацептивным действием. И таким веществом оказался прогестерон. Именно с получения синтетического прогестерона началась и развилась вся гормональная контрацепция, и принципы этой контрацепции не изменились до сих пор. Основным контрацептивным веществом во всех без исключения гормональных контрацептивах является прогестин — синтетическая форма прогестерона. Чаще всего контрацептивные свойства вытяжки желтого тела использовались для лечения эндометриоза. Эндометриоз не был распространенным заболеванием и не является им до сих пор, несмотря на ажиотаж вокруг этого диагноза, созданного нашими женщинами и врачами. Тем не менее, в практике гинекологов встречались женщины, которые жаловались на очень сильные боли внизу живота или даже в других органах, и эта боль имела тесную связь с менструальным циклом. Врачи заметили, что как только женщина беременела или у нее наступала менопауза (климакс), боли исчезали самопроизвольно. И беременность, и климакс — это физиологические менопаузы, то есть состояния отсутствия овуляции и, вследствие этого — менструаций. И тогда врачи начали применять вытяжку желтого тела для лечения эндометриоза — у женщин в процессе лечения прекращались менструации, но прекращались и боли тоже. Самое главное, что все процессы были обратимы, в том числе фертильность женщины — она снова могла беременеть после прекращения лечения. Фактически, такое лечение было прототипом современной контрацепции, и человечество обязано прогестерону за его контрацептивное действие. Первые препараты для лечения эндометриоза были синтетическими прогестеронами, или прогестинами, и многие из этих препаратов на рынке до сих пор являются ими. Потребность в гормональной контрацепции начала расти в 20–30-е годы, когда началось интенсивное движение феминисток, поддерживающих эмансипацию женщин, а значит, их право контролировать зачатие и рождение потомства, как, впрочем, и сексуальную раскрепощенность. Количество абортов начало расти драматически, хотя во многих странах аборты были запрещены (в некоторых запрещены до сих пор), а врачи, выполнявшие прерывание беременности, подвергались гонению и наказанию. Именно такая возросшая потребность в получении вещества, которое бы блокировало репродуктивную систему, ускорила поиск синтетического прогестерона. Прогестерон уже был известен, но под другими названиями, и его контрацептивные свойства тоже были известны. Оставалось только получить это вещество в таком виде, чтобы использование прогестерона было удобным, а усвоение — максимальным.3.7. Происхождение названия «прогестерон»
Теперь несколько слов о самом названии гормона. Во многих источниках имеется утверждение, что название «прогестерон» является идеей Уильярда Аллена. Но это не совсем так. Аллен во всех публикациях вплоть до 1935 года использовал слово «прогестин», которое до сих пор употребляется в характеристике синтетических форм прогестерона. Почему «прогестин»? Приставка «Про» означает «предшествие» или «до», а слово «гестация» означает беременность. Таким образом, прогестин — это вещество, которое предшествует беременности, и речь всегда шла о веществе желтого тела. Ранние эксперименты на разных моделях животных в 20–30-е годы прошлого столетия показали, что удаление яичников на ранних сроках беременности приводит к потере беременности, поэтому ученые-врачи предположили, что именно вещество желтого тела ответственно за возникновение и развитие беременности. В 1933 году вместе с коллегами-химиками Аллен получил прогестерон, фактически одновременно с немецкими коллегами. Исторически сложилось так, что в это же время несколько независимых групп ученых опубликовали свои статьи о получении прогестерона, но первенство было отдано Слотте не только потому, что его статья появилась первой, а потому, что он первым в 1934 году опубликовал правильную формулу прогестерона. Конечно, американцы пробовали оспорить такое первенство и делают это до сих пор. Аллен начал широко внедрять свое название прогестерона — прогестин. Даже сегодня в Википедии и других популярных источниках информации вы найдете утверждение, что слово «прогестерон» Аллен придумал из трех слов, характеризующих химическую классификацию прогестерона — Progestational Steroidal ketone. Это неправда. Существуют достоверные факты возникновения слова «прогестерон». В 1935 году в Лондоне прошла конференция ученых, подытоживающая результаты открытий нескольких научно-экспериментальных групп. К тому времени и Карл Слотта, и профессор Людвиг Френкель, и Эрих Фелс, принимавшие участие в открытии прогестерона, были изгнаны из Германии. Лаборатория и больница, где они работали, были закрыты. Но с помощью своих коллег Слотте все же удалось приехать в Англию для участия в конференции. И тогда, учитывая заслуги этого ученого в открытии прогестерона и идя на компромисс с американцами, группа ученых предложила использовать название «прогестерон», в честь прогестина Аллена и лютеостерона (лутеостерона) Слотты. Прогестин (Аллена) + Лютеостерон (Слотта) = Прогестерон3.8. Ограничения в использовании прогестерона
И вот, казалось бы, успех! Наконец-то прогестерон удалось извлечь в чистом виде из животного сырья. И этот прогестерон идентичен человеческому! Но каково было разочарование врачей и химиков, которые обнаружили, что в таком виде, то есть в виде чистого прогестерона, этот гормон не оказывает необходимого терапевтического действия. Еще 80 лет тому назад стало известно, что прогестерон очень быстро распадается, то есть метаболизируется в организме человека — в считанные минуты. Другими словами, прогестерон очень быстро выводится из организма. Вводить женщинам большие дозы инъекций прогестерона каждый день, а иногда и несколько раз в день, чтобы создать контрацептивный эффект, оказалось настоящим абсурдом. Оказалось, что, если принимать прогестерон внутрь, он совершенно не усваивается. И именно поэтому только сейчас некоторые компании начали использовать особую форму прогестерона в комбинации с растительными маслами (чаще всего арахисовым). Другие пути введения прогестерона тоже себя не оправдывали. Таким образом, открытие прогестерона повлекло за собой массу разочарований — практического применения этот препарат не находил долгие-долгие годы, в отличие от его синтетических аналогов.3.9. Первые таблетированные контрацептивы
Несмотря на то, что нацистскую Германию покинуло очень много ведущих ученых, все же вплоть до начала Второй Мировой войны немецкие химики имели приоритет в открытии многих синтетических форм прогестерона — прогестинов. Но самое важное в этих открытиях было то, что к концу 1938 года была получена оральная (таблетированная) форма синтетического прогестерона — этистерон, которая положила начало оральным гормональным контрацептивам. Это означало, что такой вид прогестина хорошо усваивался и не терял свой эффект, выполняя контрацептивное действие после введения в желудочно-кишечный тракт в виде таблетки.
Как раз перед Второй Мировой войной в Европе было создано крупное фармацевтическое объединение, фактически картель, куда вошли такие известные компании как нидерландская Органон, швейцарская Сиба (сегодня Новартис), французская Рассел и другие. Эти компании были заинтересованы в производстве и продаже гормональных контрацептивов, но война помешала их планам. Начатый выпуск первого в мире немецкого гормонального контрацептива, состоящего из прогестина — этистерона, был прекращен в Европе с началом второй мировой войны. В США из-за второй мировой войны тоже были приостановлены многие исследования в области женской эндокринологии и гормональной контрацепции. Лаборатории были закрыты или перепрофилированы в такие, что выполняли военные заказы, а также занимались поиском новых лекарств — обезболивающих, антисептиков, антибиотиков и других, необходимых для армии. О гормональных контрацептивах заговорили только после войны, когда снова началась волна рождаемости, а вместе с ней и потребность в предохранении от беременности — количество одиноких женщин тоже увеличилось, особенно в Европе. Немецкая научная база была полностью разрушена. Кому достались разработки немецких ученых после распределения Германии между Советским Союзом и США и их сторонниками, можно только догадываться. Советские ученые, даже если и получили такие разработки, ими не воспользовались. В 1952 году в США появился первый гормональный прогестиновый контрацептив — норэтинодрел, или НЕТ. В 1960–1961 годах в США и Англии был лицензирован первый комбинированный оральный контрацептив — эновид (1957 г.), который содержал не только синтетический прогестерон (норэтинодрел Людвига Габерландта), но и синтетический эстроген. Эновид был на рынке вплоть до 1988 года, пока его производство не прекратили из-за слишком высокой дозы эстрогенного компонента.
3.10. Гормональная контрацепция в СССР
Потребность в контрацепции в послевоенные годы в СССР тоже росла, однако о сексе в этой стране говорить было не принято. А так как сексуальные отношения приводили к зачатию детей, особенно незапланированных, то начали поощряться аборты, но не контрацепция, даже не применение презервативов или внутриматочных средств (спиралей). Можно смело сказать, что Советский Союз стал лидером по абортам, и постсоветские страны лидируют в процентном количестве абортов во всем мире до сих пор. Трудно поверить, но многие советские женщины имели от 10 до 25 абортов в течение всей жизни. В 1964 году было зафиксировано максимальное число искусственных прерываний беременности за всю историю страны — 5,6 миллионов. Конечно, официально это не разглашалось, а кроме того, в СССР начала процветать индустрия нелегальных абортов. И с этого момента начинается порождение слуха о мифической силе прогестерона сохранять беременности. О венгерской компании Гедеон Рихтер уже упоминалось раньше. Какое отношение имеет эта компания к возникновению тотальной психологической зависимости наших женщин от прогестерона? Самое прямое. Из истории известно, что в 1947 году в результате парижских мирных договоров (того же политического разделения власти и влияния между СССР и США) Венгрия перешла из рук Австрии в руки Советского Союза и стала социалистическим государством. Дележ и перераспределение территорий мира завершились, а борьба за политическое и экономическое влияние между США и СССР продолжалась еще немало лет. Владелец фармакологической компании Гедеон Рихтер к тому времени уже умер, а сама компания была приватизирована государством. Однако переход Венгрии в социалистический лагерь автоматически закрыл ей дверь в Европу. Продукция компании оказалась никому не нужной, хотя до войны эта продукция, особенно ряд гормонов, славилась во всем мире. Кроме того, самые лучшие умы этой компании или сбежали в другие страны, или попросту были уничтожены. Поэтому в 1948 году венгерские специалисты Гедеона Рихтера попросили финансовой поддержки у советского правительства. Для СССР было важно иметь весомое влияние на «братьев и сестер» государств социалистического лагеря, поэтому советское правительство никогда не отказывало просящим и фактически тем самым контролировало развитие экономики и политические режимы многих стран. Венгры получили не только деньги, им была открыта широкая дверь для реализации их продукции в социалистическом лагере. Венгерские препараты не только не проходили серьезного тестирования, но даже без всякого тестирования они повсеместно вводились в советскую медицинскую практику. Своя фармакологическая индустрия в СССР была чрезвычайно слабенькой, препараты неэффективными и некачественными, а у американцев и других представителей капиталистического мира просить лекарства не хотели и не могли. Поэтому «заграничная» венгерская фармакопея, неважно насколько она была безопасной и эффективной, стала неотъемлемой частью советской фармакопеи.3.10.1. Попытки создать прогестерон в СССР
Здесь необходимо упомянуть очень интересный факт. 10 марта 1947 года в Бюро патентов СССР было подана заявка на получение авторского свидетельства на изобретение от О. С. Мадеевой под названием «Способ получения гормона желтого тела — прогестерона», которое было опубликовано в феврале 1948 года. В свидетельстве описан метод синтетического получения прогестерона из холестерина, а не из других веществ, что было чрезвычайно рациональным процессом, потому что натуральный прогестерон является производным холестерина. О самой Мадеевой нет никакой информации, как и нет информации, был ли когда-либо использован ее патент в производстве прогестерона. Скорее всего не был, потому что советских врачей в то время прогестерон не интересовал, тем более, что за границей уже существовали синтетические формы прогестерона. А возможно, это был результат переключения внимания правительственных чиновников на помощь венгерской компании, поэтому все средства для этого были направлены в Венгрию, а не в советские лаборатории.
3.10.2. Противостояние советских врачей гормональной контрацепции
Чтобы выжить в условиях нового политического режима и получать постоянные инвестирования от советского правительства, венгры решили воспользоваться разработками Людвига Габерландта. Ведь препарат уже был готов к производству и клиническому исследованию, начать которые помешала смерть Людвига, а потом вторая мировая война. Наконец, в 1967 году советским женщинам (и врачам) был представлен первый оральный контрацептив под названием инфенкундин, который под другими названиями уже использовался в США и Европе. К удивлению правительственных чиновников, реакция наших врачей на появление этого контрацептива была не просто негативной, но даже агрессивной — врачи наотрез отказывались рекомендовать инфекундином своим пациентам. Свою неприязнь они объясняли отсутствием достоверных данных о безопасности этого препарата. Другими словами, на гормональные контрацептивы наши врачи смотрели как на настоящее исчадие ада. Кроме того, воспользоваться препаратом могли далеко не все женщины, а только «избранные» и жены «избранных народом», потому что препарат был недешевым, да и не было его в том количестве, которое было необходимо для детородного женского населения СССР. Для венгров такое отношение означало чуть ли не фиаско их многолетней работы. А в это время за рубежом, то есть у американцев и других «врагов социализма», начали появляться публикации о серьезных побочных эффектах гормональных контрацептивов, особенно их эстрогенного компонента. Эти данные дошли и до советских врачей, поэтому вместо принятия контрацептивов началась настоящая война против них, и в эту войну снова были втянуты правительственные чиновники, которые даже создавали директивы абсолютно ненаучного содержания, но зато раздувающие беспредельно информацию о вреде гормональной контрацепции. А абортарии продолжали процветать на всей территории Советского Союза. Хотя венгерские специалисты меняли состав гормональных контрацептивов и предлагали их уже под другими названиями, однако наши врачи были слепы и глухи к гормональным препаратам, впрочем, как и женщины, вплоть до начала 90-х годов. Панический страх в отношении контрацептивов сковывал СССР вплоть до его «кончины».3.11. Получение полусинтетического прогестерона
«Натуральный» прогестерон в виде очищенных вытяжек содержимого желтого тела существовал с момента открытия прогестерона. Однако получали такой прогестерон не путем синтеза или создания из неорганических веществ, как например ряд других гормонов, витаминов, лекарств, а чаще всего из яичников или яиц животных. Для массового производства такой способ получения прогестерона был совершенно непригоден. Кроме того, такой прогестерон не усваивается через кишечник, очень быстро распадается и выводится организмом, если его вводить в виде инъекций. Водные растворы прогестерона оказались нестойкими и неэффективными (прогестерон практически не растворяется в воде), а применение жировых растворов имело немало побочных эффектов. В 1940 году Маркер Рассел получил прогестерон, молекулярное строение которого было идентично прогестерону человека, из диосгенина ямса, или сладкого картофеля. Такое получение гормона называли полусинтезом. Благодаря работам Перси Джулиана из растительного сырья начали получать и другие стероидные гормоны. И только в 1971 году Уильяму Джонсону удалось синтезировать прогестерон, то есть получить его в лабораторных условиях без применения растительного или животного сырья. Конечно же, получение дешевого синтетического прогестерона, идентичного по строению и свойствам натуральному, вызвало вопрос, где и как использовать этот прогестерон? Гормональная контрацепция вошла в эру расцвета в США и ряде других стран Европы, и в ней использовались разные формы синтетического прогестерона, которые к тому же имели свое специфическое воздействие на организм женщины (например, могли понижать уровень мужских половых гормонов). Введение в гормональную контрацепцию прогестерона с натуральными качествами оказалось в какой-то степени тупиковым направлением. Его начали использовать в гинекологии при ряде заболеваний, а также началось исследование его действия в акушерстве. На современном рынке существует более 500 наименований и форм синтетического прогестерона — прогестинов. Тем не менее, прогестерон и прогестины не нашли широкого применения в акушерстве, за исключением тех стран, в которых все еще доминирует миф о пользе прогестерона для сохранения беременностей.3.12. Почему возникают мифы о лекарствах-панацеях?
Распространение слухов о пользе того или иного препарата чаще всего начинается с «сенсационного» заявления какого-то врача, случайно или умышленно. Некоторые врачи, гоняясь за славой, которая равнозначна большим доходам, сотрудничают также с рядом фармакологических компаний, хотя такое сотрудничество обычно скрывается. Но в реальности эти компании платят огромные гонорары и вознаграждения врачам, особенно высокого должностного ранга или имеющих связи и влияние на представителей «сливок» общества, за «продвижение» их препаратов. Публикация статьи, чаще всего не в профессиональном медицинском журнале (потому что достоверность информации в современных профессиональных изданиях проверяется целой группой редакторов-экспертов), а в престижном популярном журнале или газете общего профиля, оказывается тем начальным моментом цепной реакции, которая порождает миф. Другой вариант возникновения мифов тоже связан со средствами массовой информации, особенно телевидением — достаточно какому-то популярному ведущему или его гостю высказать мнение по какому-то вопросу, и это высказывание начинает повторяться многими. Постепенно срабатывает игра в испорченный телефон — информация перекручивается, дополняется, искажается. Мифы о прогестероне — не исключение, тем более что женщины — это основная мишень среди взрослого населения, а как известно, женщины живут чаще эмоциями и чувствами, чем рациональным мышлением. Часто мифы поддерживаются известными людьми, не имеющими медицинского образования, но которых легко удивить и убедить «необычными фактами» о важности или вреде чего-либо. Имея власть, популярность и деньги они становятся или ярыми сторонниками, или, наоборот, противниками какого-то «новшества». Мифы о прогестероне на Западе начали возникать не так давно — около 20–25 лет тому назад, среди женщин предклимактерического и климактерического возрастов. Это было связано с активным обсуждением симптомов менопаузы, на которые жаловались женщины развитых стран, в основном белой расы. Поэтому врачи искали панацею, чтобы удовлетворить запросы своих пациенток, не жалевших к тому же денег на «сохранение молодости», поскольку во многих странах начала расти волна увлечения средствами «омоложения», против старения и т. п. Попытки применения прогестерона и прогестинов в 70–80-х годах в лечении угрозы прерывания беременности и профилактики спонтанных выкидышей оказались не только безуспешными, но и повлекли за собой крупные скандалы и судебные процессы из-за регистрации пороков развития у ряда женщин, принимавших прогестерон на ранних сроках беременности. В СССР к прогестерону относились чрезвычайно прохладно, нейтрально, используя его в основном в гинекологической практике. С появлением туринала, венгерского прогестина, появился и миф о сохраняющей терапии с использованием синтетических форм прогестерона. После распада СССР на рынке постсоветских стран возникла определенная анархия, и одновременно многие импортные лекарственные препараты исчезли. Туринал перестал пользоваться популярностью, а потребность в «сохраняющей терапии» возрастала с геометрической прогрессией, как и акушерская агрессия. На смену туриналу пришли таблетированные формы прогестерона (утрожестан, дюфастон и другие), назначение которых при любых «женских проблемах» начало щедро вознаграждаться их производителями. Прогестерон стал гормональным божеством на территории бывших советских республик.3.12.1. Др. Джон Ли и его участие в создании мифа о прогестероне
Говоря о мифах и слухах, необходимо упомянуть о деятельности калифорнийского врача Джона Ли, который создавал «прогестероновую империю» и был «прогестероновым проповедником № 1». Проработав семейным врачом 30 лет, ли вышел на пенсию и решил заняться написанием книг и путешествиями по всему миру для продажи этих книг — так началась пропаганда использования прогестерона женщинами старшего возраста. В феврале 1996 года американская журналистка Лин Мак-Таггарт опубликовала книгу «О чем врачи не говорят вам», которая была публичной атакой на современную медицину. В своей книге автор критиковала вакцинацию, перепутав противовирусное лекарство тамифлю с вакциной. Тем не менее, книга обрела большую популярность среди людей, которые разочаровались в официальной медицине. Необходимо сказать, что Лин Мак-Таггарт является талантливой журналисткой и писателем, и ею создано несколько популярных книг, ставших бестселлерами. В мае 1996 года появилась книга Др. Ли «Что ваш врач не говорит вам о менопаузе» (не является ли выбор названия книги обыкновенной копией ставшей популярной книги Мак-Таггарт?), в которой он выступал как ярый противник заместительной гормональной терапии, но всячески поддерживал и рекламировал «натуральный» прогестероновый крем. Ли утверждал, что в климаксе наблюдается не понижение уровня гормонов, а, наоборот, повышение уровня эстрогенов, источником которых является загрязненная пестицидами окружающая среда. Разговоры об экологии в то время были очень популярны, потому что «борьба с загрязнением окружающей среды», как и «борьба с потеплением климата», уже тогда начали приносить огромные доходы. Нехватка прогестерона, по мнению этого врача, была причиной горячих приливов и других неприятных симптомов менопаузы. Ли считал, что для понижения этого «патологического» уровня эстрогенов необходимо применять прогестерон в виде крема из ямса. Слова врача с таким большим стажем работы, а тем более выпускника Гарварда,срабатывали как магические пилюли, поглощающиеся сознанием многих людей. В 1999 году он издал книгу «Что не говорит вам врач о предменопаузе», где «натуральный» прогестерон снова фигурировал как важный гормон «природной» заместительной гормональной терапии. Он также был автором книги «Натуральный прогестерон: множественная роль этого необыкновенного гормона».3.12.2. Противостояние прогестроновому мифу Др. Ли
Лин Мак-Таггарт, несмотря на отсутствие медицинского образования, а также учитывая ошибки прошлых публикаций, в 2000 году напечатала статью в популярном британском журнале «Эколог» в знак протеста против высказываний Джона Ли. Она считала книги Др. Ли обыкновенной рекламной пропагандой, за которой стояли фармакологические компании, вырабатывающие «натуральный» прогестерон. Лин писала, что слово «натуральный», который использует ли и продавцы прогестеронового крема, вводит в заблуждение многих людей, особенно женщин. Джон Ли также утверждал, что прогестерон, всасываясь через кожу, якобы минует метаболизм в печени и переносится по всему телу в неизмененном виде. Мак-Таггарт в противовес словам врача писала, что натуральным может быть только прогестерон, вырабатываемый в организме человека. Она не знала, что препараты ямса не содержат прогестерон, но она правильно считала, что прогестерон, получаемый из растительного сырья, является полусинтетическим, а не натуральным. Она также утверждала, что постоянное втирание прогестерона (а Др. Ли рекомендовал втирать в кожу прогестерон минимум 4–5 раз в день), приведет к интоксикации женского организма прогестероном и повысит риск развития рака молочных желез. Исследования показали, что, если наносить прогестерон на кожу молочных желез, в ткани молочной железы почти в четыре раза повышается не только уровень прогестерона, но и эстрогена, однако уровень прогестерона в крови остается на прежнем уровне. Молочные железы являются органами-мишенями по воздействию прогестерона, поэтому могут накапливать этот гормон. Дополнительное введение прогестерона вызывает появление соответствующего количества эстрогена для поддержания гормонального баланса и нейтрализации лишнего прогестерона.3.12.3. Миф Др. Ли о лютеиновой недостаточности
Миф о лютеиновой недостаточности и необходимости ее лечения прогестероном тоже возник благодаря публикациям Др. Джона Ли, который был не просто сторонником прогестерона, но и ездил по всему миру и рекламировал кожный крем с «натуральным» прогестероном. Хотя некоторые его утверждения звучали правдиво, однако их можно было интерпретировать по-разному. Др. Ли писал в одном из выпусков своего бюллетеня 1994 года: «Растения вырабатывают вещества, похожие на прогестерон, как и в случае с фитоэстрогенами. В обществах, диета которых богата свежими овощами разных видов, прогестероновая недостаточность не существует. Женщины в этих обществах не только имеют здоровые яичники с фолликулами, вырабатывающими достаточное количество прогестерона, но и в менопаузе эти диеты предоставляют им достаточное количество проэстрогенных веществ. Эти вещества поддерживают либидо высоким, кости крепкими и делают прохождение через климакс спокойным и без симптомов». Невозможно не согласиться с этими словами, однако ни вещества, из которых можно получить прогестерон, ни фитоэстрогены гормональными свойствами в организме человека не обладают — они попросту не усваиваются, потому что для этого нет специальных ферментов. Как решение проблем женщин, у которых диета бедна овощами, Джон Ли предлагает дополнительное использование прогестерона. Какие правдивые факты упускает Др. Ли, характеризуя нормальный уровень прогестерона у женщин, в питании которых преобладают свежие овощи? Это факты демографических показателей, условий жизни и культурных традиций по отношению к замужеству и рождению детей. Обычно это женщины тех стран и тех географических регионов, где преобладает сельское хозяйство, как когда-то оно доминировало на территории Европы и Северной Америки. Эти общества отстают в развитии от городской цивилизации, а их питание полностью зависит от выращивания собственных овощей и фруктов. Когда-то мясо на столе большинства людей было редкостью, и до сих пор ограничение в мясных продуктах существует во многих странах мира. Еще один важный момент — возраст. Во многих странах женщины выходят замуж в молодом возрасте, в 18–23 года, беременеют и рожают, не откладывая процесс зачатия в долгий ящик. Естественно, такие женщины не имеют прогестероновой недостаточности, потому что они меньше всего интересуются диагнозами, а просто живут открытой половой жизнью, выполняя свой супружеский и материнский долг. И к слову, самые высокие уровни рождаемости наблюдаются в самых отсталых экономически странах мира, где нет даже развитой медицинской помощи. Восточные и африканские женщины до сих пор не знают, что такое «патологическая» менопауза и практически не страдают симптомами климакса (как и не знают, что такое лютеиновая недостаточность). Они воспринимают менопаузу как нормальный физиологический процесс. Если учесть, что практически всю свою жизнь большинство этих женщин работает физически, это не только профилактика патологического протекания менопаузы, но и остеопороза, и других негативных состояний, связанных с процессом старения. Поэтому дело далеко не в диете и получении прогестерона и эстрогенов с пищей, а в образе жизни, который включает физические нагрузки, отсутствие алкоголя и курения, адаптацию к стрессовым ситуациям (ведь многим женщинам необходимо выжить и выкормить свое потомство в таких жестких условиях, которые европейским и американским женщинам даже представить трудно).3.12.4. Появление мифа о сохраняющей терапии в СССР
Советские врачи были противниками контрацепции, но куда большими противниками заместительной гормональной терапии, считая половые гормоны и прогестерон вредными и опасными. Назначение заместительной гормональной терапии (ЗГТ) женщине в 80–90-х годах считалось чуть ли не кощунством, издевательством над женским организмом. Поэтому советские врачи назначали ЗГТ женщинам очень редко и обычно на кратковременный период времени. До сих пор во многих учебниках по гинекологии информация о применении гормонов в менопаузе является чрезвычайно скудной и поверхностной. Так как контрацепция была на низком уровне, СССР начал лидировать по количеству искусственных абортов (о чем уже упоминалось), в том числе нелегальных, которые часто проводились в условиях стационаров, но под диагнозами «спонтанный выкидыш» или «угроза прерывания беременности». Сексуальная революция не поощрялась в стране Советов, и даже запрещалась, однако процветала среди молодежи 70-х годов прошлого столетия, невзирая на запреты. До 90 % всех беременностей прерывалось искусственно. Интересно, что в СССР прогестерон был и имеется до сих пор в ампулах, но почти вплоть до распада этой страны врачи использовали его чаще всего для проведения аборта (конечно же, нелегального, хоть и оформленного документально как потеря беременности или выкидыш). Прогестерон в высокой дозе вводили в первые недели беременности, то есть при задержке менструации в несколько дней, и после его отмены возникало кровотечение и довольно часто наступало самопроизвольное прерывание беременности по типу медикаментозного аборта. Таким же методом врачи пользовались, применяя другие гормональные препараты. Хотя эти методы официально были запрещены, но большинство гинекологов закрывало глаза на эти запреты. Молодые женщины, пройдя через несколько абортов в студенческие годы, выходили замуж и планировали беременность. И вот здесь на поверхность начинали всплывать страхи о потере уже желанной беременности. Сохраняющей терапии не было почти до конца 80-х годов. Если у женщины появлялись боли и/или кровотечение на ранних сроках беременности, чаще всего проводили «чистку», после этого назначали кровоостанавливающие средства (обычно викасол) в течение нескольких дней, а потом запрещали женщине беременеть в течение минимум шести месяцев (запрещают и до сих пор). Прогестерон в виде инъекций с целью «сохранения беременности» практически не использовался. Чуть позже направление женщин в стационары и выполнение плана по койко-дням, что являлось частью пятилетнего социалистического плана, стало выгодным (без большого количества койко-дней бюджет больницы урезался). Молодые женщины, не имевшие абсолютно никакого представления о строении и функции женских половых органов, о беременности, при нескольких днях задержки менструации и появлении кровянистых выделений бежали к врачу (бегут и до сих пор). Паника, ажиотаж, страхи — все это присутствует до сих пор. Никто толком не определял наличие беременности, так как для определения требовались животные, в основном лягушки, и на получение результатов уходило несколько дней, а то и две недели. Не все женские консультации имели возможность содержать в своих лабораториях животных. УЗИ появилось в советской медицине буквально перед распадом СССР, но его редко применяли в акушерстве. УЗИ-аппараты были слишком дорогими, специалистов, которые умели проводить и интерпретировать УЗИ, не было, за исключением единиц (в основном, терапевтов), очереди для проведения этого метода обследования растягивались на несколько месяцев ожидания. Сама постановка диагноза угрозы прерывания беременности часто была ошибочной. Ведь до сих пор многие женщины и врачи считают, что цикл должен быть тютелька в тютельку ровно 28 дней, а значит, любая задержка менструации — это 100 %-ная беременность, а появление кровянистых выделений и болезненных ощущений внизу живота — это 100 %-ная угроза прерывания беременности. При осмотре, который часто был грубым, женщине говорилось, что матка «слегка увеличена» (а разве перед месячными матка не увеличивается в размерах?). Женщина тут же направлялась в стационар с диагнозом угрозы прерывания беременности, ей вводили папаверин и но-шпу, хлорид кальция или глюконат кальция, викасол — все это должно было играть роль «сохраняющей терапии». Направление в стационар всех женщин с задержкой менструации (даже в 3 дня), появлением кровянистых выделений и/или болезненностью внизу живота стало не просто традицией, а неким обязательным мероприятием (не исключено, ради того же плана по койко-дням), но одновременно это создало неимоверный страх об «угрозе потери беременности». Если учесть, что часто женщины находились в переполненных палатах, где томились до 20–24 человек с разными «стадиями» беременности, то есть сохраняющими и уже потерявшими, можно представить, какой негативный эмоциональный фон доминировал в таких «инкубаторах» беременности. В преимущественном большинстве случаев беременности срывались, несмотря на «борьбу врачей за спасение беременности». Срываются до сих пор в не меньшем количестве, несмотря на то, что арсенал медикаментов, которые применяются врачами, увеличился раз в пять. Но боялись женщины не так самой потери беременности, как последующих «чисток», которые часто проводились без всякого обезболивания. У многих врачей бытовало мнение, что использование обезболивающих медикаментов у женщин, которые и так потеряли беременность, является обыкновенной растратой лекарств (эти лекарства можно было продать на стороне). Прогестерон появился в постсоветском акушерстве по двум причинам: все та же вера и распространение мифа о сохраняющей терапии делали свое дело, тем более, что «прогестерон — гормон беременности», но и фармакологические компании усердно поощряли, в том числе крупными вознаграждениями, врачей, назначающих препараты прогестерона (дюфастона, утрожестана). Это финансовое вознаграждение существует до сих пор, хотя официально об этом нигде не говорится. Во многих странах финансовое или материальное вознаграждение врачей производителями лекарственных препаратов и диагностической аппаратуры запрещено. Такой запрет введен в медицинскую практику не так давно. Но в прошлом были и другие поощрения, например, в оплате дорогостоящих поездок на разные курорты, за границу, покупке автомобилей, яхт и прочего, что часто называлось издержками на бизнес. В отличие от невысоких бюджетов системы здравоохранения, фармацевтическая индустрия — одна из самых богатых в мире, поэтому владеет колоссальными финансовыми и материальными средствами. С распадом СССР, когда в политике и экономике всех постсоветских государств стала царить настоящая анархия, законы игнорировались, процветало взяточничество и коррупция, люди искали любые источники дохода, не брезгуя ничем, даже здоровьем других людей. Многие владельцы частных клиник становились владельцами лабораторий и аптек. Возникали и процветали подпольные заводы и фабрики по производству лекарственных препаратов и подделок, качество, эффективность и безопасность которых никем и никогда не проверялись. Любой контроль за введением на рынок медикаментов и прочих средств для улучшения здоровья основывался на наличии «важных, необходимых связей» и взяточничестве. Ситуация не изменилась до сих пор. Таким образом, введение прогестерона в постсоветскую гинекологию и акушерство было подготовлено уже созданным мифом о сохраняющей терапии. А также тотальной деградацией системы здравоохранения, редкой малограмотностью медицинских кадров и отсутствием любого контроля со стороны государства и других учреждений. Прогестерон начали использовать не только для лечения всех «женских болезней», но якобы для профилактики всех «женских болезней» и просто перестраховки, на всякий случай. Точно так же, как американцы уже несколько десятков лет лечат чуть ли не все свои болезни тайленолом, постсоветские женщины относятся к прогестерону как панацее от всех их проблем. Миф о сохраняющей терапии развивался в двух направлениях: (1) беременность прерывается из-за нехватки прогестерона, а значит, всем беременным необходимо принимать прогестерон дополнительно, (2) у всех женщин, которые не могут забеременеть, низкий прогестерон, поэтому они должны принимать прогестерон до беременности и потом чуть ли не всю беременность. Так, помимо мифа о сохраняющей терапии, возник миф о прогестероновой недостаточности. Эти два мифа «идут нога в ногу» до сих пор, поддерживая друг друга и прочно укореняясь в мышлении многих женщин. Теме прогестероновой и лютеиновой недостаточности посвящен отдельный раздел.4. ВЫРАБОТКА И ТРАНСПОРТ ПРОГЕСТЕРОНА
В организме человека «центры» синтеза прогестерона находятся в тесной связи с теми органами и тканями, которые используют прогестерон для выполнения их функции. Это специфика большинства гормональных органов и тканей: гормоны вырабатываются в одном месте и транспортируются к органам-мишеням, которые используют эти гормоны. Все процессы выработки гормонов регулируются гипоталамо-гипофизарной системой — комплексом особых нервных центров и клеток мозга, вырабатывающих специальные вещества с гормональной активностью.4.1. Регуляция выработки прогестерона
В природе все процессы имеют стадийность, или градацию. С одной стороны, такая стадийность кажется сложным многоступенчатым процессом. С другой стороны, это комбинация многочисленных простых процессов, когда поломка на одном уровне может компенсироваться быстро и эффективно переходом на другой уровень разными путями с вовлечением разных веществ. Чем важнее какое-то вещество для жизни организма, тем его получение и выработка проще, и прогестерон не исключение. Поскольку он является матрицей для большого количества других субстанций, его синтез и регуляция этого синтеза обеспечивается несколькими механизмами, когда из холестерина вырабатывается промежуточное стероидное вещество — прегненолон, участвующий в синтезе и других гормонов. В зависимости от того, на что будет «израсходован» прогестерон, то есть в каком органе он будет использован для дальнейшего синтеза веществ, регуляция выработки этого гормона контролируется рядом гормонов гипофиза, эндокринной железы мозга, вырабатывающей важные гормоны для регуляции многих процессов в организме человека. Во всех органах, вырабатывающих стероидные гормоны из прогестерона, имеются специальные рецепторы. Гормональными рецепторами называются молекулы (чаще всего жировой или белковой природы), которые могут связываться с молекулами гормонов. Для каждого вида гормона есть свои специфические гормональные рецепторы. Без формирования «замочка» между рецептором и гормоном, воздействие гормона на клетки-мишени и в целом на орган невозможно. В синтезе любых гормонов человека существует определенный узаконенный природой порядок: сначала в мозг поступают сигналы о том, что обнаружена нехватка какого-то гормона, обычно со стороны тканей, использующих этот гормон. Мозг как управляющий орган подает сигнал в гипофиз (этот сигнал может идти поэтапно через другие структурные единицы разных частей центральной нервной системы и мозга), который вырабатывает гормоны — гонадотропины, необходимые для стимуляции работы других эндокринных желез, находящихся на периферии, то есть далеко от мозга. Получив сигнал «сверху» эти железы начинают употреблять «строительные материалы», поступающие с кровью, и производить необходимый гормон. Гормон переносится кровью и другими жидкостями к тем тканям, которые сделали «запрос». Другими словами, механизм регуляции выработки всех без исключения гормонов чем-то напоминает взаимоотношения между потребителем и производителем через централизованное управление с использованием определенных средств передачи информации и транспорта «товара», хотя может иметь некую автономность (независимость) от гипоталамо-гипофизарной системы. Так как прогестерон участвует в выработке очень многих веществ, в его синтез тоже вовлечены многочисленные «стимуляторы», «активаторы», позволяющие проводить не только выработку этого важного гормона, но и дальнейший его распад и обмен с образованием других стероидных гормонов и веществ.4.1.1. Гормоны гипофиза и синтез прогестерона
В регуляцию биосинтеза прогестерона вовлечены фолликулостимулирующий гормон (ФСГ), лютеотропный гормон (ЛГ), поскольку яичники вырабатывают эстрогены — женские половые гормоны (но в первую очередь андрогены, из которых потом вырабатываются эстрогены), а также адренокортикотропный гормон (АКТГ), регулирующий биосинтез гормонов надпочечников. Рецепторы для этих гормонов имеются в яичниках, яичках и надпочечниках. После взаимодействия ФСГ, ЛГ и/или АКТГ с рецепторами клеточных мембран соответствующих эндокринных органов (яичники и яички тоже являются эндокринными органами) начинается целая цепочка биохимических реакций. Сам по себе гипофиз тоже имеет рецепторы, чувствительные к эстрогенам и прогестерону. В фолликулярную фазу (о фазах цикла читайте в разделе «Прогестерон и менструальный цикл») наблюдается рост уровня эстрогенов, поэтому в передней доле гипофиза появляется больше связанных эстрогенных рецепторов, что в свою очередь начинает понижать выработку ФСГ. Но прогестерон тоже понижает количество связанных эстрогенных рецепторов, что поддерживает уровень ФСГ, стимулирует выработку ЛГ и подавляет выработку ферментов, расщепляющих ЛГ.4.1.2. Синтез прогестерона
После присоединения гормонов гипофиза к гормональным рецепторам эндокринных желез начинается цепочка других реакций, которые часто называют G-протеин-регулируемой реактивной последовательностью. Она связана с вовлечением G-протеин-рецепторов. Это молекулы белков, которые находятся на поверхности оболочек клеток, их также называют трансмембранными рецепторами, потому что они могут проходить через мембрану. А так как они проходят «туда-сюда», активируя ответную (сигнальную) реакцию целой клетки, и могут делать это до семи раз, эту группу рецепторов называют семь-трансмембранными рецепторами, или 7TM. Эти рецепторы вовлечены во множество процессов, в том числе в возникновение заболеваний, а также в перенос лекарственных препаратов вовнутрь клетки. В синтезе прогестерона 7TM играют роль инициаторов транспорта холестерина из цитоплазматических капелек во внутрь митохондрий — энергетических структурных единиц клетки. Этот процесс проходит с помощью вовлечения белков — стерол-несущих протеинов. Первая фаза синтеза прогестерона завершается образованием прегненолона, хотя при этом могут образовываться и другие стероидные вещества — это зависит от вида фермента, вовлеченного в химическую реакцию (о чем мы поговорим ниже). Опять же, присутствие необходимых белков-катализаторов или модераторов контролируется специфичными генами. Итак, первая фаза синтеза прогестерона является митохондриальной. Во вторую фазу прегненолон под влиянием 3-гидрокси дегидрогеназы, особого энзима, превращается в прогестерон, и этот процесс происходит уже за пределами митохондрий. Часть прегненолона может превратиться в 17α-гидроксипрогестерон, метаболит стероидных гормонов, а также в 17α-гидроксипрегненолон, который может быть использован для выработки мужских половых гормонов.4.1.3. Регуляция синтеза прогестерона у беременных женщин
У беременных женщин регуляция выработки прогестерона практически не зависит от гормонов гипофиза. В первые недели беременности желтое тело яичника поддерживается гормонами беременности — хорионическим гонадотропным гормоном, вырабатываемым хорионом, но только первые 2–3 недели после зачатия, когда происходит имплантация. После того как первый этап имплантации завершен, что обычно длится две недели, на пятой неделе беременности функция желтого тела начинает угасать, а хорион, и затем плацента берут на себя выработку прогестерона, но уже плацентарного происхождения. Эта выработка становится независимой от материнских регуляторных механизмов и к 7–8 неделям желтое тело перестает функционировать. Если у беременных женщин регуляция выработки прогестерона не контролируется организмом женщины, как же в таком случае уровни этого гормона достигают таких высоких величин, которые не наблюдаются у небеременных женщин? Тело матери играет роль поставщика «строительного материала» — в частности жирных кислот. Гормоны, вырабатываемые плацентой, независимо от женщины стимулируют процессы усвоения жиров и холестерина, и материнская кровь становится насыщенной жирами — возникает состояние гиперлипидемия. Другими словами, кровь женщины становится «жирнее». Этот феномен позволяет плаценте получать большое количество жиров, необходимых для выработки прогестерона. Плод, хотя и использует прогестерон плаценты для синтеза собственных гормонов и других стероидных веществ, однако не регулирует выработку прогестерона — между ним и плацентой нет ни прямой, ни обратной связи. До сих пор механизм регуляции выработки прогестерона плацентой остается загадкой. У беременных женщин повышается уровень 5α-прегнана, который имеет непосредственное влияние на молочные железы (стимулирует деление клеток) и мышечную ткань матки (расслабляет ее). После родов активность этого прогестеронового метаболита значительно уменьшается.4.2. Ткани и органы, вырабатывающие прогестерон
В женском организме прогестерон вырабатывается яичниками и надпочечниками, в мужском — яичками и надпочечниками. Однако наибольшее количество прогестерона производится яичниками только в определенный период и при определенных условиях — наличии созревания половых клеток, что называется овуляцией, и возникновении желтого тела. Эта тема рассматривается в отдельной главе. Вне наличия желтого тела уровень прогестерона у женщин очень низкий. У беременных женщин основной производитель прогестерона — плацента, частично сам плод. При беременности вырабатывается огромнейшее количество прогестерона — в 15 и более раз выше по сравнению с выработкой его яичниками. Основная масса вырабатываемого прогестерона используется плодом, независимо от его половой принадлежности. Плод растет почти на «космических скоростях», а поэтому требует огромного количества гормональных веществ. А так как его многие ткани и органы не зрелые, плацента становится крупным заводом по производству необходимых органических веществ для плода и одновременно складом, чтобы будущий ребенок мог воспользоваться запасами необходимых веществ независимо от женского организма. Поэтому даже при плохом питании женщины или наличии у нее разных заболеваний чаще всего рождаются здоровые дети, то есть процент внутриутробной задержки роста плода и других отклонений все же невысок.4.3. Взаимодействие прогестерона и других стероидных гормонов
Все стероидные гормоны, вырабатываемые яичниками, яичками и надпочечниками, взаимосвязаны и их функция будет зависеть от трех важных факторов на клеточном уровне: 1) качества и количества рецепторов, способных связываться с гормонами 2) наличия достаточного количества ферментов (энзимов), участвующих в обмене стероидных гормонов, 3) места связывания гормонов (поверхность клетки, внутриклеточная цитоплазма, ядро клетки, митохондрии). Гормоны действуют не на все клетки организма, а только на клетки-мишени, которые имеют соответствующие рецепторы для связывания с молекулами гормонов или другой механизм усвоения молекул гормонов. Для каждого вида гормонов существует свой вид рецептора — это как ключик, который подходит только к одному виду замка. Под влиянием определенных факторов возможно соединение разных гормонов и химических веществ с некоторыми рецепторами (блокировка чувствительности рецепторов лекарствами применяется в медицине для лечения многих заболеваний). Чтобы понять взаимоотношения между эндокринными железами, рецепторами и гормонами, можно воспользоваться примером радиовещания. Радиопередача какой-то станции (эндокринная железа) передает сигналы (гормоны) постоянно во все точки местности на большие расстояния (организм), но, чтобы послушать передачу, необходимо не только включить радиоприемник (орган), но и настроить его на определенную волну-частоту (рецепторы гормона). Стероидные гормоны воздействуют на определенные ткани-мишени. Органы-мишени или ткани-мишени — это те органы или ткани, на которые прогестерон воздействует непосредственно, помогая выполнять им их функцию. В женском организме — это матка, но не все ее слои, а только внутренний слой — эндометрий. Это также молочные железы — для выработки молока.4.4. Транспорт прогестерона
Прогестерон вырабатывается яичниками, яичками и надпочечниками, и может быть использован частично «местно», например, яичниками для выработки половых гормонов, надпочечниками — для выработки стероидных гормонов, а также переноситься к тканям-мишеням, где происходит его наибольшее потребление — к матке и молочным железам. Существуют несколько путей транспорта гормональных веществ в организме человека. Основная масса гормонов переносится в связанном с белками виде. Гормоны и другие вещества, связанные с белками, называются конъюгированными. Если молекулы гормонов и других веществ не связаны с белками, говорят о неконъюгированном состоянии. Только до 2 % прогестерона (и это можно сказать и о других гормонах) в крови человека находится в свободном состоянии. В связанном с белками состоянии прогестерон является неактивным веществом, поэтому не оказывает влияния на клетки и ткани.4.4.1. Белки крови, переносящие гормоны и другие вещества
В крови человека содержится много органических веществ и клеточных структур. Белки составляют от 6 до 8 % объема крови. Наиболее распространенные виды белков — это альбумины, глобулины и фибриноген. Альбумины и глобулины называют сывороточными глобинами или глобулярными белками, потому что их молекулы имеют компактную шаровидную форму.4.4.1.1. Кровь, сыворотка и плазма — в чем разница?
В чем разница между кровью, сывороткой и плазмой? Эту разницу необходимо понимать, потому что часто определение тех или иных веществ проводится по-разному в разных лабораториях: их можно определять в цельной крови, в сыворотке и в плазме. Результаты в таких случаях тоже будут разными, и если не учитывать эти нюансы, то интерпретация полученных результатов будет ложной. Когда берут кровь из вены (забор крови желательно проводить из вены, а не пальца), получают цельную кровь, которая содержит все ингредиенты. Если в такую кровь добавить антикоагулянты, то есть предотвратить процесс свертывания крови (коагуляции), а потом отцентрифугировать ее, то на дне пробирки появится осадок, состоящий из клеток крови (эритроцитов, лейкоцитов, тромбоцитов). Оставшаяся жидкость без клеток крови называется плазмой. Если из плазмы удалить факторы свертывания крови (в первую очередь, фибриноген), то останется жидкость, которая называется сывороткой. Оставшиеся белки можно выделить с помощью электрофореза. Протеины под влиянием электрического тока передвигаются к электродам с разной скоростью, поэтому таким способом можно получить разные фракции белков крови.4.4.1.2. Альбумины
Около 50 % всех белков крови являются альбуминами. Они вырабатываются печенью и отвечают за перенос по всему телу очень многих веществ, молекулы которых имеют маленькие размеры. Также альбумины принимают участие в поддержании специального давления крови, которое называется осмотическим. Альбумины могут связываться с молекулами воды, с различными ионами (натрия, калия, кальция), с рядом гормонов, билирубином, витаминами, жирами, с многочисленными лекарственными препаратами. Во время беременности плодом вырабатывается альфа-фетопротеин (АФП), который играет важную роль в переносе многих веществ в крови ребенка и плаценте. В природе альбумины накапливаются в семенах многих растений и яйцах животных (например, белок в курином яйце). Роль альбумина в транспорте прогестерона изучена на животных моделях и на человеке еще в 70-х годах прошлого столетия. Исследования проводились у разных возрастных категорий женщин, при разных заболеваниях, а также у беременных женщин. При нормальных показателях уровня прогестерона и вне состояния беременности, до 80 % гормона связано с альбумином. При повышении концентрации прогестерона (при беременности, после введения экзогенного прогестерона) фракция связанного с альбумином прогестерона понижается, хотя в целом количество альбумина тоже повышается. Однако уровень роста белка часто не совпадает с уровнем роста гормона (как это наблюдается при беременности). Часть молекул гормона в таких случаях может связываться с другими белками — глобулинами, эритроцитами или же оставаться в свободном состоянии.4.4.1.3. Глобулины
Сывороточные глобулины также играют важную роль в транспорте многих веществ. Все глобулины можно разделить на три вида или класса: альфа, бета и гамма-глобулины. Альфа-глобулины участвуют в переносе многих гормонов и витаминов, в том числе прогестерона. С глобулинами крови связано только 20 % прогестерона. Бета-глобулины участвуют в транспорте ряда веществ (например, железа в виде трансферрина). Гамма-глобулины по своей функции являются антителами (их часто называют иммуноглобулинами), вырабатываемыми защитной (иммунной) системой человека против инородных агентов и веществ, попадающих в организм человека, или против собственных клеток и части клеток (поврежденные, раковые и т. д.). Количество антител увеличивается обычно при появлении инфекционных агентов. Существует пять классов антител (Ig), которые вырабатываются поочередно и одновременно в зависимости от вида инородного агента. Гамма-глобулины используются для лечения ряда состояний и с профилактической целью (входят в состав многих вакцин).4.4.1.4. Специфические глобулины, связывающие прогестерон
Существуют несколько видов белков, с которыми может связываться прогестерон, однако его связь с такими белками, в отличие от других гормонов, слабая. Одним из таких белков является белок, связывающий половые гормоны (SHBG), относящийся к глобулинам. Другой вид глобулина — это белок, связывающий кортикостероиды (CBG или транскортин), в частности кортизол. Молекулы этого белка крупные по строению и содержат 135 аминокислот. Белок, связывающий кортикостероиды, является «родственником» белков, которые переносят гормоны щитовидной железы. Хотя этот вид белка связывает 80–90 % кортизола в плазме крови человека, он также может связываться с прогестероном. Существует еще один вид глобулина — α1-кислотный гликопротеин (AAG), или орозомукоид. CBG и AAG содержат большое количество сахара. Такие виды белка имеются у всех млекопитающих. У беременных самок ряда животных уровень роста связанного прогестерона повышается во много раз и быстрее, чем выработка белка, связывающего кортикостероиды. Считается, что у беременных женщин — значительно увеличивается количество α1-глобулина, который связывается в основном с прогестероном, в меньшей степени с другими стероидами, в том числе тестостероном. Почему большее количество прогестерона связано все же с альбуминами, а не глобулинами? Степень формирования связей с прогестероном зависит от вида белка и температуры тела человека. Связывающая способность глобулина в 500 раз больше таковой у альбумина, но в сыворотке крови на одну молекулу CBG имеется 800 молекул альбумина. Таким образом, большое количество прогестерона связано в крови с альбумином (при беременности более 50 %). Связывание гормона с протеинами играет важную роль в обмене прогестерона. Прогестерон практически нерастворим в жидкостях человека независимо от того, вырабатывается он в организме или вводится разными путями. Поэтому его связь с белками помогает не только в транспорте прогестерона, но также выполняет защитную функцию — защищает его от атаки ферментами и, следовательно, преждевременного распада.4.4.2. Роль эритроцитов в переносе прогестерона
Особую роль в транспорте прогестерона играют красные кровяные тельца (эритроциты). Связь прогестерона с эритроцитами возникает очень быстро, так как этот гормон жирорастворимый, то есть имеет липофильные качества (фактически прогестерон может связываться с любыми жирами и жирорастворимыми веществами), а оболочка эритроцитов тоже липофильная. Поэтому перенос прогестерона эритроцитами в разные части тела женского организма может проходить за считанные минуты. Эритроциты не только могут связываться с прогестероном (как и с эстрадиолом также), но и быстро освобождать гормон в местах (тканях и клетках) его потребления. Ученые проводили подсчет «прогестерон-свободных» и «прогестерон-связанных» эритроцитов у животных. Оказалось, что во время беременности количество эритроцитов, связывающих и переносящих прогестерон, существенно повышается. Интересными также оказались данные исследований, подтвердивших факт биосинтеза прогестерона эритроцитами пуповины, что привело к появлению теории дополнительного источника прогестерона у беременных женщин. Многие врачи считают, что определение уровней прогестерона только в плазме или сыворотке крови не отражает реальную картину насыщенности крови прогестероном, так как определенная часть этого гормона может переноситься эритроцитами и рядом других веществ. Большинство анализов направлено на определение уровня прогестерона, связанного с белками, и не учитывает количество свободного прогестерона.5. УСВОЕНИЕ ПРОГЕСТЕРОНА
Усвоение прогестерона, вырабатываемого в теле человека и вводимого извне разными путями, кардинально отличается, и часто врачи об этом не знают. Внутренний прогестерон, хотя и курсирует по организму в свободном состоянии, однако количество неконъюгированного прогестерона небольшое. Какая часть этой активной формы прогестерона будет использована клетками и тканями, а какая часть распадется и будет выведена из организма, неизвестно. Большое количество свободного прогестерона атакуется энзимами крови и других тканей для уменьшения его вредного воздействия. Связанный прогестерон (98–99 % всего вырабатываемого прогестерона) тоже доставляется к разным органам, тканям и клеткам. Такой вид прогестерона путешествует по всему организму медленнее, хотя тоже частично распадается в процессе транспорта, несмотря на связь с белками, особенно в печени. Однако такой вид прогестерона не воздействует на клетки — он находится в нейтральном состоянии. Какой процент связанного прогестерона используется клетками и тканями, тоже неизвестно. Уровень прогестерона, который определяют в крови женщины, это количество связанного неактивного прогестерона, что не отражает реальную картину усвоения прогестерона клетками, а значит, степень воздействия на клетки. И здесь необходимо вспомнить ряд других гормонов. Длительный период времени, определяя уровни разных гормонов в крови, многие врачи не знали, что между показателями количества связанного, свободного и общего гормона имеется большая разница. Степень влияния гормональных веществ на организм человека определяется в первую очередь наличием свободного гормона. В большинстве лабораторий до сих пор определяют общий уровень гормонов (сумму свободного и связанного). При этом показатели многих связанных гормонов могут быть повышены, например, при беременности, в то время как неконъюгированные формы гормонов могут быть в норме. Естественно, если уровень конъюгированного гормона выше, то причин повышения этого уровня может быть несколько, но чаще всего это проявление хорошей компенсаторной реакции: появилось каким-то образом лишнее количество гормона, его активность и нанесение вреда клеткам и тканям необходимо не только подавить связью с белками, но и быстро вывести из организма. Поэтому неудивительно, что уровни определенных видов метаболитов (продуктов распада) могут быть повышены в ряде жидкостей тела (кровь, моча) или кале. Чем больше развивается медицина, тем понятнее становятся многие вопросы в отношении правильного измерения уровней гормонов. Поэтому, например, нарушение функции щитовидной железы уже не ставят только по определению одного уровня общих гормонов этой железы (Т4 и Т3), но учитывают уровень свободных гормонов, а также уровень гормона гипофиза (ТТГ), регулирующего работу железы. То же самое можно сказать об определении уровней мужских половых гормонов — уровень свободных андрогенов куда важнее уровня связанного или общего тестостерона. При измерении уровня пролактина тоже учитывается свободная и связанная с белками форма гормона. Но в современной женской эндокринологии царит настоящий хаос, потому что до сих пор в диагностике многих заболеваний репродуктивной системы, функция которой зависит от уровней разных гормонов, проводят измерение уровней не тех гормонов и не тех метаболитов, без учета их связи с белками. Другими словами, никто не определяет уровень свободного эстрадиола, как и свободного прогестерона, активных форм гормонов, но зато все выводы делаются на основании определения уровней конъюгированных форм гормонов. При этом ни врачи, ни ученые не знают, какой же процент гормонов будет усвоен организмом, а какой процент будет выведен с мочой и калом. К тому же, каждый день менструального цикла, как и время суток, характеризуется своей уникальной пропорцией уровней разных гормонов. Исследователи и врачи знают об этой пропорции пока что чрезвычайно мало, точнее, почти ничего не знают. Какой должна быть эта пропорция в норме не просто за весь цикл, а в отдельно взятом дне менструального цикла, утром, вечером, ночью? Меняется ли она в разных циклах? Что влияет на изменение уровней этой пропорции? Как изменения пропорции влияют на овуляцию, зачатие и имплантацию? Графики уровней гормонов в течение суток существуют, но они отражают колебания гормонов у женщин, принимавших участие в экспериментах и клинических исследованиях, то есть они индивидуальны. Такие графики не могут характеризовать изменения уровней гормонов у всех без исключения женщин. Поэтому при отсутствии ответов на эти важные вопросы возникает другой вопрос: насколько рационально вмешательство в виде гормональной терапии, тем более, что все лекарственные препараты являются полусинтетическими или синтетическими формами гормонов и даже новыми искусственными стероидными веществами, которых в организме человека никогда нет? Усвоение и обмен синтетических форм прогестерона, точнее прогестинов, детально не изучены. Их применение в медицине основано чаще всего на гипотезах и предположениях, но не на достоверных данных больших клинических исследований. Таким образом, в современной женской эндокринологии существуют сплошные дилеммы не только в диагностике ряда эндокринных нарушений, но и в выборе методов лечения. Еще большая дилемма наблюдается в назначении гормонов в предклимактерическом и климактерическом периодах.5.1. Гормонально-рецепторный комплекс
Молекулы прогестерона в соединении с белком переносятся по всему организму, но усваиваются органами и тканями, имеющими клетки-мишени с гормональными рецепторами. Связываясь с разными рецепторами клетки, прогестерон образует гормонально-рецепторный комплекс. Гормонально-рецепторный комплекс проникает вовнутрь цитоплазмы и ядра клетки. ДНК клетки содержит специальные «ответные элементы», к которым может прикрепляться гормонально-рецепторный комплекс, который действует как фактор транскрипции (переписки), поэтому включает, или иногда выключаеттранскрипцию генов, что в свою очередь приводит к ответной генетической реакции (экспрессии). Это наиболее распространенный механизм воздействия прогестерона на клетки.5.2. Прогестероновые рецепторы
Существует несколько механизмов проникновения прогестерона вовнутрь клетки, усвоения и воздействия на них. Вид механизма зависит от вида клеток, использующих прогестерон, а также от концентрации прогестерона в плазме крови и от того, в каком виде находится прогестерон — связанном или свободном. Существуют классические рецепторы прогестерона — нуклеарные и мембранные, а также новые — те, которые открыты совсем недавно и до сих пор изучаются учеными. Не исключено, что структур, через которые прогестерон может проникать в клетки, может быть и больше. Помимо рецепторов прогестерона, существуют рецепторы на некоторые его метаболиты. Поэтому прогестерон может воздействовать и через продукты своего распада.
Прогестероновые рецепторы (ПР) размещены как на поверхности клеточных мембран, так и на поверхности ядерной оболочки. Кроме того, единичные прогестероновые рецепторы находят в цитоплазме клеток. ПР контролируют рост клеток, апоптоз (самоуничтожение), участвуют в транскрипции ДНК, стероидном и жировом (липидном) обмене. Разные клетки человеческого организма могут использовать разные рецепторы для усвоения прогестерона, и благодаря этому влияние гормона на функцию клеток может быть разным. Прогестерон часто называют самым нейтральным гормоном, подразумевая его универсальность. С одной стороны, способность «не вмешиваться» во многие процессы, как и не связываться с разными веществами. С другой стороны, как основа всех стероидных гормонов молекулы прогестерона могут связываться с разными стероидными рецепторами, частично имитируя действие этих гормонов, или же, наоборот, блокируя их действие.
5.2.1. Ядерные прогестероновые рецепторы
Прогестероновые рецепторы человека (ПР, ЧПР, hPR) относятся к семейству нуклеарных (ядерных) рецепторов, к которым принадлежат тироидные, эстрогенные, андрогенные, глюкокортикоидные и минералокортикоидные рецепторы. Единичный уникальный ген, который находится в 11-й хромосоме — 11q22–23, отвечает за появление и работу прогестероновых рецепторов, позволяет существовать двум разным изоформам ПР — А и В, отличающимся не только функцией, но и строением. Два вида цинксодержащих прогестероновых рецепторов есть у всех представителей млекопитающих, за исключением кроликов. Когда молекула прогестерона связывается с прогестероновым рецептором, возникает цепочка химических реакций, позволяющих прогестероновому комплексу (гормон-рецепторному комплексу) быть перенесенным в клетку и ее ядро. Этот комплекс соединяется со специальным участком гена, помогая гену проявить свое действие. Прогестероновые рецепторы в большом количестве имеются в матке, яичниках, маточных трубах и молочных железах. Несмотря на почти идентичное строение, два разных вида прогестероновых рецепторов вызывают разное воздействие гормона на ткани человека. ПР-А принимают участие в контроле функции яичников и матки, в то время как ПР-В отвечают за рост (пролиферацию) молочных желез. По силе воздействия ПР-В намного активнее и сильнее ПР-А, и своей активностью они могут подавлять функцию других стероидных рецепторов: ПР-А, андрогенных, глюкокортикоидных, минералокортикоидных и других. Фактически ПР-В являются активатором транскрипции ДНК, в то время как ПР-А выполняют противоположное действие, и частично подавляют активность ПР-В. в этих различиях проявляется диалектическая роль прогестероновых рецепторов (как и самого прогестерона). Из всех генов, которые регулируются ПР, ПР-В контролируют 65 % этих генов, а также 25 % в комбинации с ПР-А, ПР-А — около 4 % генов. Но, несмотря на разную активность рецепторов и разный объем генного контроля, в нормальных тканях женского организма существует определенный баланс-пропорция взаимодействия всех рецепторов. Когда этот баланс нарушается и возникает диспропорция, нарушаются процессы усвоения и обмена прогестерона и ряда других гормонов клетками и тканями, что может привести и к появлению раковых изменений. Мужской организм тоже не лишен прогестероновых рецепторов. Их находят в тканях репродуктивной системы — яичках, простате, придатках. Прогестероновые рецепторы имеются и в других тканях и органах человеческого тела: тимусе, костной ткани, в гладких мышцах сосудов, центральной и периферической нервной системе, легких, поджелудочной железе, в незрелом мочевом пузыре. Роль ПР в этих тканях и органах до сих пор неизвестна. Оказывается, что существуют не только прогестероновые рецепторы, но и рецепторы к некоторым метаболитам этого гормона. В тканях молочных желез обнаружены рецепторы к 3α-дигидропрогестерону и 5α-дигидропрогестерону. Эти два вида метаболитов оказывают противоположный эффект на клетки эпителия молочной железы.5.2.2. Пропорция прогестероновых рецепторов
Пропорция ПР-А/ПР-В разная в разных тканях-мишенях (эндометрии, молочной железе, яичниках), и она может меняться у многих животных в зависимости от периода их жизни, а значит, уровней гормонов. У человека количество ПР и их пропорция тоже зависят от дня менструального цикла. Например, наибольшее количество ПР наблюдается перед овуляцией. Также, несмотря на то, что в течение всего цикла в эндометрии есть ПР-А, прогестероновые рецепторы появляются на 9-й день цикла и их количество значительно уменьшается на 18-й день цикла. Количественное отношение прогестероновых рецепторов отличается у женщин, применяющих гормональные контрацептивы и гормональные препараты с другими целями. Так уровень пропорции ПР-А/ПР-В выше у женщин, принимающих комбинированные оральные контрацептивы (КОК), по сравнению с женщинами с естественными овуляторными циклами. У женщин, пользующихся монофазными контрацептивами, количество ПР-В намного ниже, чем у других групп женщин. Такое явление объясняется тем, что ПР-А менее чувствительны к гормональным колебаниям, в том числе при использовании экзогенных гормонов. Чем больше уровень эстрогенов, тем более выражена активность ПР-А, но в целом количество ПР-А является более или менее постоянным фактором, в то время как ПР-В зависимы от колебаний уровней гормонов больше (в 4 раза). Так же количество прогестероновых рецепторов стабильно приблизительно до 8–10-го дня цикла, а потом наблюдается их рост. Необходимо заметить, что количество эстрогенных рецепторов тоже меняется в течение менструального цикла и такие изменения имеют тесную связь с колебаниями количества и пропорции прогестероновых рецепторов. Замечено, что активность ПР-А в раковых клетках выше, в то время как функция ПР-В подавлена. Например, высокая пропорция ПР-А/ПР-В — это плохой прогностический признак в ведении и лечении рака молочной железы, потому что реакция на гормональное лечение у таких больных слабая. Какую роль может играть определение количества прогестероновых рецепторов в тканях-мишенях? Учитывая, что такой метод обследования является дорогим, он не может применяться в практической медицине повсеместно. Тем не менее, важно определение не так количества прогестероновых рецепторов, как их пропорцию, так как она лучше отражает реакцию тканей-мишеней на гормональные изменения в организме. Зная также, что количество рецепторов может регулироваться введением экзогенных гормонов, можно подобрать индивидуальное лечение для женщин, страдающих рядом гинекологических заболеваний, а также бесплодием. Например, изучение различий в количестве и пропорциональном отношении прогестероновых рецепторов в нормальном эндометрии и эктопическом при эндометриозе позволило определить наличие устойчивости к прогестерону очагов эндометриоидной ткани. В этом направлении необходимо проведение клинических исследований. Изучение пропорции прогестероновых рецепторов используется также для прогноза гормонального лечения у женщин, страдающих раком молочной железы. Новая отрасль лекарственной терапии — это эпигенетическая терапия, действие которой основано на воздействии определенных генов, контролирующих активность гормональных рецепторов. Эпигенетика изучает изменения генов и проявление этих изменений на уровне функционирования клетки. При этом структура ДНК не меняется. Эти эпигенетические изменения могут сохраняться при делении клеток и передаваться наследственно. Например, нарушенное метилирование гена Hох А10 (одна из разновидностей эпигенетических изменений), найденного у женщин, страдающих эндометриозом, нарушает действие прогестероновых рецепторов (подавляет активность ПР-В). Ученые испытывают ряд лекарственных препаратов, которые могут воздействовать на эти рецепторы через подавление экспрессии измененных генов.5.2.3. Мембранные прогестероновые рецепторы
Помимо ядерных рецепторов существует целая группа мембранных прогестероновых рецепторов (МПР), которые размещены на поверхности клеточных оболочек, в первую очередь, репродуктивных органов (гранулезные клетки, ооциты и другие). Эти рецепторы играют важную роль как инициаторы полового деления ооцитов (мейоза), что является последним этапом созревания половых клеток. Мембранные ПР имеются и у сперматозоидов, где они играют важную роль в индукции акросомной реакции (читайте главу «Прогестерон и сперматозоиды»). Существует три формы таких рецепторов — альфа, бета и гамма. Интересно, что мембранные рецепторы также находят в нейронах, кишечнике и почках. Среди мембранных ПР имеются семь-трансмембранные рецепторы, а также прогестероновый рецепторный мембранный компонент 1 (Progesterone Receptor Membrane Component — PGRMC1). Эти виды рецепторов чаще находят в репродуктивной системе, а также в почечной и мозговой тканях. Оказалось, что в плаценте имеется большое количество трансмембранных рецепторов, но их значение в возникновении родов, в том числе преждевременных, до сих пор не изучено. Считается, что основное влияние прогестерона на разные виды клеток определяется наличием PGRMC1, который является посредником во взаимоотношениях гормона с клетками человеческого организма. Доказано, что раковые клетки ряда опухолей яичников, легких, молочных желез, лишенные такого клеточного компонента, растут медленнее, чем те, у которых он сохранен. Прогестерон влияет на скорость деления клеток. Деление клеток (митоз) имеет несколько фаз: G1, S (синтеза), G2 (интерфаза) и M (непосредственно митоз). Прогестерон регулирует деление на последней фазе — М-фазе, позволяя одним клеткам завершить деление, а другим нет. В этом направлении ведется объемный научный поиск, потому что изучение роли прогестерона в росте и делении раковых клеток поможет разработать новые противораковые лекарства.5.2.4. Другие прогестероновые рецепторы
Митохондриальные прогестероновые рецепторы (ПР-М) размещены на поверхности мембран митохондрий. Большое количество таких рецепторов находят в миометрии беременной женщины, что связывают не только с повышенным энергетическим обменом в тканях матки (митохондрии часто называют электростанциями клеток), но и большей чувствительностью беременной матки к прогестерону и расслабляющему эффекту этого гормона на миометрий. Однако попытки воздействовать на эти виды рецепторов препаратами прогестерона, в том числе его синтетических форм, оказались безуспешными. Прогестерон может связываться и усваиваться клетками через GABAA рецепторы (рецепторы гамма-аминобутировой кислоты). Наибольшее количество этих рецепторов имеется в клетках нервной системы и мозга. Эти рецепторы содержат семь белковых субъединиц (α, β, γ, δ, ε, π и θ), взаимосвязанных между собой и образующих ионный канал в оболочке нейрона, который позволяет ионам хлора (Cl-) войти вовнутрь нейрона для участия в передаче сигнала. Эти виды рецепторов являются основными в подавляющем воздействии на центральную нервную систему. Субъединицы α и β присутствуют в GABAA рецепторах постоянно, в то время как комбинация других может быть разной. Также существуют изоформы субъединиц, что меняет угнетающую функцию рецепторов и их способность связываться с разными веществами. Прогестерон может соединяться с другими рецепторами, в частности рецепторами минералокортикоидов и глюкокортикоидов, и андрогенов. Прогестерон влияет на никотиновые ацетилхолиновые рецепторы и сигма рецепторы — плазменные и мембранные рецепторы нейронов, функция которых сейчас интенсивно изучается.5.3. Альтернативный транспорт прогестерона и его усвоение клетками
Традиционный механизм транспорта и усвоения прогестерона предполагает связь гормона с белками крови, а потом его освобождение и формирование гормонально-рецепторного комплекса. Оказалось также, что надпочечники и яичники могут аккумулировать гормоны экзогенного происхождения и лекарственные препараты, имеющие стероидное строение, в большей степени, чем ткани-мишени. Другими словами, когда в организм женщины вводятся препараты эстрогенов, прогестерона, глюкокортикоидов и минералокортикоидов, а также стероидные лекарства, эти вещества воздействуют в первую очередь на эндокринные железы, а не на ткани-мишени. Такое воздействие предполагает существование особого вида транспорта стероидных гормонов, который не зависит от наличия рецепторов (частично через эритроциты крови). Считается, что усвоение свободных (нейтральных) молекул гормонов происходит за счет специфического транспортного механизма, в который вовлечены ионы натрия крови. Причем, разные стероидные гормоны используют один и тот же механизм транспорта. Таким образом, в организме человека имеется две интегрально взаимодействующие системы усвоения стероидных гормонов — пассивная и активная, то есть с вовлечением рецепторов и энзимов и без их вовлечения. При экзогенном введении стероидных препаратов их высокая концентрация в крови приводит к тому, что первыми органами, которые реагируют на эти препараты, являются не органы-мишени, а яичники и надпочечники. Этот факт важно учитывать в назначении этих препаратов, так как аккумуляция экзогенных стероидов может кардинально нарушать функцию эндокринных желез, искажая лечебный эффект и приводя к серьезным побочным эффектам. Действие прогестерона без образования гормонально-рецепторно-генного комплекса наблюдается также в обмене кальция кишечной стенки и мышц матки, что влияет на их сократительную способность.5.4. Прогестерон и жировая ткань
Усвоение стероидных гормонов, в том числе половых гормонов, тесно связано с жировой, или адипозной, тканью. Длительный период времени роль жировых клеток была непонятна ни ученым, ни врачам, однако было замечено, что у женщин с низким весом тела и нехваткой жировой ткани часто наблюдаются нерегулярные менструальные циклы, в основном из-за отсутствия овуляции. Репродукция как у животных в периоды голодания и недоедания, так и у худых людей заглушается, что связано с энергетическим голоданием и нехваткой питательных веществ в целом. Жировая ткань — это депо энергии. Одновременно жиры участвуют в усвоении многих гормонов, в том числе прогестерона. Также нерегулярные менструальные циклы наблюдаются у женщин, страдающих ожирением, что связано с накоплением мужских половых гормонов в жировых клетках. Фактически адипозная ткань является своеобразным складом (депо) для многих жирорастворимых веществ. Известно, что распределение жировой ткани у женщин отличается от такового у мужчин. Многим женщинам не нравятся «жировые запасы» на животе и бедрах. Даже у самых худых женщин часть живота между пупком и лобком чаще всего «плоской» не бывает и содержит небольшое количество жира. Чаще всего ни голодание, ни интенсивные занятия спортом не помогают избавиться от этой жировой прослойки. Поэтому многих людей интересовал и интересует до сих пор вопрос взаимосвязи между женскими половыми гормонами и жировыми «запасами». Оказалось, что в жировых тканях находят высокий уровень фермента, вовлеченного в усвоение прогестерона — 20α-гидроксистероидной дегидрогеназы (20α-ГСД, AKR1C1). У женщин, страдающих ожирением, уровень этого фермента, как и ряда других, нарушен. Данный вид фермента относится к классу альдо-кето редуктаз (АКР) и вовлечен в процесс превращения прогестерона в неактивный метаболит — 20α-гидроксипрогестерон. Этот вид энзима есть не только в жировой ткани, но и в яичниках, яичках, надпочечниках, печени, вилочковой железе, лимфатических узлах и лимфоидной ткани, почках, легких, матке и плаценте. Но кроме этого фермента в клетках жировых тканей имеются и другие. В зависимости от стадии роста и созревания в жировых клетках есть разные виды метаболитов прогестерона, к тому же в разной пропорции. И только зрелые жировые клетки, адипоциты, содержат 20α-гидроксипрогестерон. Таким образом, жировая ткань является определенным балансом в обмене прогестерона. Но она также может накапливать его. Хотя прогестерон в жировой ткани хранится в виде биологически неактивной формы, не исключено, что эти запасы прогестерона позволяют женщинам сохранять репродуктивную функцию определенный период времени при нехватке питательных веществ и невыраженной степени голодания. Жировая ткань также накапливает большое количество мужских половых гормонов. С одной стороны, это защитная функция от излишков тестостерона и его метаболитов. С другой стороны, адипозная ткань при ожирении становится дополнительным источников андрогенов. Не исключено, что усвоение прогестерона жировой тканью имеет связь с выработкой и обменом андрогенов, которые являются производными прогестерона. Факт накопления жировой тканью прогестерона и половых гормонов вызывает немало споров среди врачей, которые являются сторонниками или противниками применения заместительной гормональной терапии, в частности препаратов, содержащих прогестерон, у женщин в предклимактерическом и климактерическом периодах. Данные ряда исследований показывают, что такой накопительный эффект может проявиться непредвиденными длительными побочными явлениями в результате применения прогестерона даже в течение непродолжительного периода времени.5.5. Распад прогестерона
Природный, или натуральный, прогестерон распадается очень быстро, что значительно ограничило применение полусинтетического (который часто называют натуральным) прогестерона в гинекологии и акушерстве. Под периодом полураспада понимают период уменьшения концентрации вещества на 50 %. Полураспад гормона в сыворотке крови составляет 5 минут, но в тканях распад прогестерона может задерживаться. Уровень очищения от гормона составляет 60–70 л/сутки/кг, что медленнее, чем у многих животных моделей, за исключением крыс. В публикациях можно найти противоречивую информацию о полураспаде прогестерона. Это связано с тем, что довольно часто эти источники информации не учитывают вид прогестерона, который использовался в экспериментах для изучения его обмена. Нередко синтетическую форму прогестерона (медроксипрогестерона ацетат) называют просто прогестероном, хотя действие у натурального прогестерона и синтетического разное, как и процесс обмена. Практически, все гормоны человеческого организма быстро метаболизируются, поэтому действие гормонов напоминает «удары хлыста», иногда мягкие, иногда сильные — зависит от их количества (дозы), и именно из-за этого выработка большинства гормонов человека имеет пульсирующий характер, в том числе и в случае прогестерона. В предыдущих главах уже упоминалось, что в обмене прогестерона, то есть его распаде, усвоении клетками, выведении из организма участвуют специальные белковые образования — ферменты, или энзимы. Названия некоторых энзимов тоже упоминается во многих главах. Существует четыре большие группы энзимов, которые включают 5αR, 5β-редуктазы (5βR), 3α-, 3β-, 20α- и 20β-гидроксистероидные редуктазы, 6α (β) —, 11β-, 16-, 17- и 21-гидроксилазы, и С17–20 лиазы. Вид и количество энзимов зависит от вида тканей, использующих прогестерон. Кроме того, обмен прогестерона может идти разными путями в зависимости от дня менструального цикла и влияния на этот обмен извне применением гормональных препаратов, в частности стероидных. У разных видов животных, особенно млекопитающих, имеются разные наборы энзимов, расщепляющих прогестерон. И так же, как у человека, разные органы содержат разные виды ферментов. Активность ряда ферментов повышается при беременности (например, 5α-редуктазы), и, наоборот, после родов и в процессе старения организмов активность понижается. Только сейчас, благодаря улучшению технического оснащения лабораторий, ученые начали тщательно изучать состав и функцию энзимов у человека и животных и их возможное практическое применение в медицине.5.6. Метаболиты прогестерона
Все вещества, в которые превращается прогестерон или его метаболиты, можно разделить на следующие 6 групп: • 5α-прегнаны (5α-дигидропрогестерон, или 5α-П, и др.) • 5β-прегнаны (5β-П) • 4-прегнены (3α-дигидропрогестерон, или 3α-ГП, и др.) • кортикостероиды (кортизол и др.) — гормоны надпочечников • андрогены (тестостерон и др.) — мужские половые гормоны • эстрогены (эстрадиол и др.) — женские половые гормоны Эти особенности обмена прогестерона зависят во многом от вида клеток и тканей, вырабатывающих или использующих прогестерон, уровня прогестерона в крови и тканях и наличия определенных ферментов, регулирующих превращение прогестерона в другие активные стероидные гормоны и их метаболиты. В получении разных видов метаболитов принимает также участие цитохром Р-450. Основным метаболитом прогестерона является прегнандиол (6–27 %), но в зависимости от места использования этого гормона могут образовываться и другие вещества. В крови человека также постоянно циркулируют 17α-гидроксипрогестерон, 11-дезоксикортикостерон и 20-дигидропрогестерон. Эти вещества соединяются с глюкуроновой кислотой и выводятся из организма почками с мочой. Печень метаболизирует две трети прогестерона, особенно попавшего в организм оральным путем. В моче можно обнаружить два продукта обмена прогестерона — прегнандиол и прегненолон, и ряд других веществ. Эти производные прогестерона являются важным звеном в выработке и обмене других стероидных гормонов. От 15 до 60 % гормона (точнее, продуктов его обмена) выводится с мочой, до 30 % — с калом. Усвоение и распад прогестерона и прогестинов, вводимых экзогенно, зависит от вида препарата, дозы, путей введения. Практически обмен синтетических вариантов прогестерона детально не изучен. Также не изучена зависимость образования разных видов метаболитов от дозы и вида прогестина, в том числе в комбинации с синтетическими эстрогенами и другими стероидными гормонами.5.7. Значение 5α-редуктазы в обмене прогестерона
5α-редуктаза является очень важным ферментом, участвующим в синтезе стероидных гормонов и их обмене. Изучением функции этого энзима заняты сейчас очень многие ученые как в области репродукции человека, так и в области раковых заболеваний. Он участвует в выработке желчных солей, андрогенов и эстрогенов, а также в развитии рака простаты и молочной железы. Существует три изоформы этого фермента, в зависимости от вида тканей, в которых они используются. Наиболее насыщены 5α-редуктазой ткани репродуктивных органов. Помимо того, что этот фермент участвует в распаде тестостерона, он также понижает превращение прогестерона в дигидропрогестерон и диоксикортикостерона в дигидродиоксикортикостерон — важные гормональные метаболиты, участвующие в обмене стероидных гормонов. Прогестерон является натуральным ингибитором 5α-редуктазы, то есть он подавляет ее действие и предотвращает превращение тестостерона в его более активные и опасные метаболиты, которые могут привести к возникновению гиперандрогении и других нарушений обмена мужских половых гормонов. Ингибиторы 5α-редуктазы используются в лечении облысения, доброкачественной гиперплазии простаты и раке простаты.5.8. 17–оксипрогестерон
Очень часто женщины обеспокоены тем, что как только в их моче повышается уровень 17-оксипрогестерона, им без всякого дополнительного обследования ставят диагноз гиперплазии коры надпочечников или гиперандрогении и назначают гормональное лечение. 17-оксипрогестерон, или 17-гидроксипрогестерон (17-ОП, 17-ОНР), является важным гормональным веществом, промежуточным звеном в синтезе других стероидных гормонов из прогестерона, а также продуктом распада прогестерона и стероидных гормонов. Так как уровень прогестерона и других гормонов при беременности повышается, неудивительно, что повышается и уровень 17-оксипрогестерона. В период беременности 17-OHP вырабатывается желтым телом беременности и плацентой, особенно в третьем триместре беременности. Он может взаимодействовать с рецепторами прогестерона. Необоснованные назначения препаратов в «борьбе» с этим веществом являются не только небезопасными для плода, но могут нанести вред беременности.5.9. Питание и прогестерон
В предыдущих главах уже упоминалось о синтезе прогестерона из холестерина, который частично поступает с пищей, а частично вырабатывается из жиров в организме человека. На выработку гормонов, особенно половых гормонов и прогестерона, влияет питание женщины, так как все стероидные гормоны для своей выработки требуют поступления достаточного количества холестерина с пищей, а также нормального уровня жиров в плазме крови и тканях для усвоения и обмена половых гормонов. Баланс необходимых питательных веществ в пище — это залог здоровья любой женщины (как и мужчины тоже). Немало женщин ограничивают себя в питании, гоняясь за модной «фото- модельной» фигурой, поэтому нередко «садятся» на жесткие диеты, принимают много химических и натуральных добавок для похудения, нагружают тело экстремальными физическими нагрузками, увлекаются «странными» диетами, ограничивая себя в важных питательных веществах. И результат всегда одинаковый: нарушение менструального цикла. Это нарушение многие врачи называют «гормональным дисбалансом» и лечат гормональными контрацептивами, не вникая в причину такого нарушения и не объясняя женщине, что она должна поменять не только свое питание, перейдя к здоровому образу жизни, но и мышление тоже, понимая, что она становится врагом собственного тела. Диетическое питание и потеря веса кардинально влияют на уровень прогестерона. Ряд исследований показал, что потеря веса в результате физических нагрузок (занятия спортом) значительно понижает уровень прогестерона. Прогестерон является жирорастворимым гормоном, поэтому прием с жирами или жирорастворимыми витаминами (Е, а, Д) повышает его усвоение. И наоборот, нехватка жиров понижает усвоение прогестерона как из внутренних источников прогестерона, так и из внешних. Пища, богатая жирами, повышает усвоение прогестерона, в том числе экзогенного. Известно, что после принятия цельного молока, которое содержит определенный процент жиров, уровень прогестерона в сыворотке крови повышается. Использование обезжиренной или с низким количеством жиров диеты приводит к понижению прогестерона более чем на 50 % по сравнению с женщинами, питающимися нормально. Занятия спортом и обезжиренная диета сообща могут значительно понижать не только уровень прогестерона, но и эстрогенов, и кардинально нарушать овуляторную функцию яичников. Также известно, что женщины, страдающие недоеданием, особенно в зимний период из-за нехватки пищи, чаще имеют ановуляторные циклы. Интересными оказались результаты ряда экспериментов, которые показали, что диета, бедная калием, увеличивает концентрацию прогестерона у грызунов, а также у мужчин (на женщинах такие эксперименты не проводились).5.9.1. Прием клетчатки и усвоение прогестерона
Увлечение диетами, разного рода схемами «очищения» кишечника, желчного пузыря, лимфатической системы являются грубым вмешательством в работу человеческого организма. В большинстве случаев это приводит к негативным последствиям, а не к улучшению здоровья. Одним из таких увлечений стало применение большого количества клетчатки, или растительных волокон.5.9.1.1. Виды клетчатки
Клетчатка относится к углеводам, но в отличие от простых углеводов (сахаров) в организме человека практически не распадается и поэтому не усваивается. В растительном мире клетчатка играет роль каркаса, и в зависимости от химического строения волокна могут быть разной толщины и длины, например, целлюлоза, из которой получают бумагу (существует также искусственная целлюлоза — район), хлопок. Клетчатку дерева используют в разных отраслях производства. Волокна животного происхождения — это волосы и мех, шерсть, шелк. Известный всем асбест относится к минеральным волокнам. Существует целая группа минеральных волокон. Помимо натуральных волокон в промышленности и хозяйстве используют большое количество искусственных волокон. Таким образом, клетчатка и волокна присутствуют в повседневной жизни человека с момента появления человечества.5.9.1.2. Роль клетчатки в питании человека
Волокна растительного происхождения, в основном производные овощей, злаковых, фруктов, поступают в организм человека с пищей. Несмотря на то что полисахариды практически не усваиваются, они очень важны для нормального, здорового функционирования кишечника, так как помогают организму избавляться от шлаков. Клетчатка не только является своеобразной сеткой, улавливающей непереваренные остатки пищи, токсины, продукты обмена питательных веществ, но она стимулирует моторику кишечника, позволяя пище продвигаться по желудочно-кишечному тракту. От количества клетчатки зависит работа прямой кишки и ее своевременное освобождение от каловых масс — шлаков. Нормальное, здоровое очищение организма, в том числе кишечника, во многом зависит от количества растительных волокон, содержащихся в пище. Поэтому неудивительно, что многие диетологи, нутрициологи, врачи рекомендуют прием клетчатки всем людям. Часто при запорах и нарушениях работы кишечника назначаются препараты клетчатки, которые могут быть в разной форме — от порошков, таблеток, брикетов до определенных видов пищевых продуктов (плитки с зернами и орехами, овсяные и злаковые смеси, напитки и т. д.). Проблема современных людей в том, что они стали зависимыми от «аптечных препаратов», то есть от тех форм «натуральных» продуктов, которые переработаны механически и химически и продаются в виде таблеток, капсул, порошков. Вместо того чтобы научить человека сбалансированному питанию, среди людей, вовлеченных в индустрию здоровья, доминирует прерогатива назначения (продажи) разных добавок. Людей не учат употреблять свежие овощи и фрукты, но зато всюду рекламируют препараты растительной клетчатки и других важных питательных веществ в «таблетированной» или «порошковой» форме. Доказано, что клетчатка полезна для людей, страдающих сердечно-сосудистыми заболеваниями, заболеваниями кишечника, диабетом. Употребление клетчатки значительно понижает риск развития рака толстого кишечника и даже рака молочной железы. Поэтому неудивительно, что употреблению клетчатки начали отдавать предпочтение люди старшего возраста, которые страдают не только разными заболеваниями, но и малоподвижностью, вредными привычками, накопленными с годами, лишним весом, перееданием. Но также оказалось, что чрезмерное употребление клетчатки имеет свои негативные последствия, в том числе оказывает негативное влияние на гормональный фон женщины.5.9.1.3. Клетчатка и усвоение половых гормонов
Как показали исследования, употребление большого количества клетчатки ассоциируется с низкими уровнями половых гормонов и прогестерона, увеличивает частоту ановуляторных циклов, особенно у молодой группы женщин. Другими словами, чрезмерное увлечение клетчаткой приводит к нарушению овуляции. К сожалению, женщины и врачи все еще не принимают во внимание этот факт. Уровень эстрогена понижается при избыточном приеме клетчатки также и у женщин зрелого и предклимактерического возраста. Считается, что диеты, богатые волокнами, приводят к понижению активности β-глюкоронидазы в толстом кишечнике при формировании каловых масс, что вызывает нарушение всасывания эстрогена в кишечнике. Клетчатка тоже может понижать усвоение жиров и холестерина, в том числе и из-за более частых опорожнений кишечника. У женщин, злоупотребляющих клетчаткой, наблюдаются низкие уровни фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), которые влияют на фолликулогенез. У женщин с нормальной функцией яичников такие изменения уровней гормонов могут компенсироваться в течение определенного периода времени, поэтому случаи ановуляции могут быть редкими. Но у женщин, у которых уже имеются нарушения в менструальном цикле, прием большого количества клетчатки усугубит проблему еще больше. Дополнительными негативными факторами у таких женщин являются низкий вес тела (как и низкий индекс массы тела), интенсивные физические нагрузки и ограничение в питании и приеме ряда продуктов питания.5.10. Алкоголь и прогестерон
Влияние приема алкоголя и алкогольных напитков на организм женщин разного возраста было описано в многочисленных исследованиях за последние полстолетия или даже раньше. Такие исследования проводились часто для определения минимальных безопасных доз алкоголя под эгидой различных программ государственного уровня во многих странах мира, так как прием и использование алкогольных напитков является частью традиционных национальных кухонь народов мира. Изучение влияния алкоголя на репродуктивную функцию женщины тоже проводилось, как и влияние на уровни половых гормонов и прогестерона, плодовитость, возникновение менопаузы.5.10.1. Алкоголь и зачатие ребенка
Исследования показали, что умеренное употребление алкоголя (100 мл в неделю) незначительно понижает уровень успешного зачатия ребенка, а также повышает риск возникновения эндометриоза. При наблюдении здоровых семейных пар, пробовавших зачать первого ребенка в течение шести месяцев, получены следующие результаты: прием 100 г алкоголя в неделю понижает уровень успешного зачатия в два раза по сравнению с приемом 10–50 г алкоголя. Сравнительный анализ влияния курения, алкоголя и комбинации курения и приема алкоголя тоже привел к получению интересных данных. Уровень зачатий у женщин, не применявших алкоголь и не курящих, составлял чуть больше 24 % в месяц, у курящих, но не принимавших алкоголь — почти 22 %. Прием алкоголя, независимо от курения, является серьезным фактором, значительно понижающим фертильность женщины. Исследования показали, что уровень зачатий в исследуемой группе женщин, у которых были овуляторные циклы, при приеме более 90 г алкоголя в неделю составлял около 11 % в месяц. Прием алкоголя в этом исследовании был кратковременным — с 14 по 21 день цикла, когда вероятность зачатия и имплантации самая высокая. Но влияние алкоголя было очевидным. Другие исследователи изучали эффект приема алкоголя за более длительный период времени (до 10 лет). Постоянный прием алкоголя, особенно в умеренных количествах, усугубляет проблемы с бесплодием, повышая частоту ановуляторных циклов. Недостатком всех проводимых исследований являлось то, что количество алкоголя выражалось в разных единицах (граммы, миллилитры), напитки тоже были разными, как и продолжительность приема алкоголя. В ряде стран, где алкогольные напитки входят в состав традиционного питания (Италия, Испания, Франция) зависимость между периодическим или умеренным приемом алкоголя и уровнем фертильности не наблюдалась.5.10.2. Алкоголь и половые гормоны
Определение влияния алкоголя на уровни эстрогенов, андрогенов, гонадотропинов проводилось как у менструирующих женщин, так и у женщин в постменопаузе, с учетом принятой дозы алкоголя — острое опьянение или хронический алкоголизм. Прием большого количества алкоголя приводит к значительному повышению уровня эстрадиола в плазме, что объясняется воздействием алкоголя на опиоидные рецепторы гипоталамуса, стимулирующие выработку гипофизом ЛГ, ФСГ и пролактина. Наибольшее влияние алкоголя отмечается в предовуляционный период (конец первой фазы менструального цикла) и период ранней имплантации (вторая половина второй фазы). Такое влияние объясняется тем, что алкоголь нарушает пропорцию ферментов печени, необходимых для метаболизма эстрадиола в эстрон, так как для нейтрализации алкоголя тоже необходимы ферменты (энзимы) печени. Таким образом, в плазме остается большее количество эстрадиола, не прошедшего процесс распада в печени. В разные фазы (дни цикла) при регулярном приеме алкоголя наблюдается повышение разных женских половых гормонов (эстрадиола, эстрона, эстриола) как в плазме, так и в моче женщин. Очевидным является то, что повышение биологически активных форм эстрадиола наблюдается перед овуляцией у всех женщин, употребляющих алкоголь регулярно и в умеренных количествах. При меньших дозах алкоголя у многих женщин, наоборот, отмечалось понижение уровня эстрадиола. У женщин в постменопаузе алкоголь повышает уровень эстрогенов даже больше, чем у женщин репродуктивного возраста. Употребление алкоголя увеличивает не только уровень эстрогена в крови женщины, но и уровень ряда мужских половых гормонов. Несмотря на то, что объяснение таким колебаниям гормонов имеется (и связано с работой печени и влиянием алкоголя на гипоталамо-гипофизарную систему), однако практических врачей больше интересует вопрос взаимодействия алкоголя с гормональными препаратами, в частности, проблемы заместительной гормональной терапии и гормональных контрацептивов. Алкоголь значительно повышает уровень эстрогенов при использовании гормональных контрацептивов и заместительной гормональной терапии, однако даже при высоких уровнях женских половых гормонов экзогенного происхождения их усвоение может быть нарушено, так же, как и скорость выведения из организма, что может усилить побочные явления такой относительной «гиперэстрогении».5.10.3. Влияние алкоголя на уровни прогестерона
Ряд исследований показал, что прием алкоголя не влияет на уровень прогестерона в фолликулярной фазе и в середине лютеиновой фазы, хотя теоретически предполагалось, что при нарушении пропорции ферментов, участвующих в синтезе и распаде прогестерона, процесс превращения прегненолона в прогестерон тоже должен быть нарушен. Влияние алкоголя на уровень прогестерона на начальных стадиях беременности с участием беременных женщин не проводился (и было бы неэтично проводить такие эксперименты на беременных женщинах, зная тератогенное действие алкоголя). Однако у небеременных женщин создавалось состояние ложной беременности, в том числе с введением хорионического гонадотропина (ХГЧ) в определенные дни, когда при нормальной беременности этот гормон тоже появляется в крови женщин. Оказалось, что алкоголь понижает уровень прогестерона у таких женщин. Поэтому существует предположение, что алкоголь может препятствовать нормальной имплантации плодного яйца. Другие исследования на женщинах, принимающих оральные контрацептивы и заместительную гормональную терапию, подтвердили факт, что уровень прогестерона в крови этих женщин при принятии алкоголя понижается, к тому же значительно. Проводились также эксперименты в лабораторных условиях по изучению влияния алкоголя на клетки плаценты и ее способность синтезировать прогестерон. Оказалось, что алкоголь препятствует вхождению молекул холестерина, из которого потом образуется прогестерон, в клетки плаценты. Количество алкоголя, вызывающего такие изменения, было эквивалентно 0.10–0.20 % алкоголя в крови (1.5–3 стакана вина или 110–230 мл водки).5.11. Курение и прогестерон
О вреде курения для здоровья человека и развитии ряда заболеваний, в том числе рака легких, известно давно. У курящих женщин уровень фертильности ниже, качество яйцеклеток хуже, что также понижает уровень успешного ЭКО и требует большего количества эмбрионов (практически в два раза больше) для возникновения беременности. Такое явление можно объяснить прямым токсическим влиянием никотина и других вредных ингредиентов табака на половые клетки. У курящих женщин выше уровень внематочной беременности, чаще бывают многоплодные беременности и выше уровень преждевременных родов. Необходимо заметить, что у молодых курящих женщин до того, как начнется процесс старения яичников (до 25–27 лет), наоборот, отмечается слегка повышенная плодовитость. Было обнаружено, что у курящих женщин повышена активность рецепторов прогестерона в эндометрии, что повышает его чувствительность к прогестерону. Возможно, именно поэтому у молодых курящих женщин уровень имплантации выше. Удивительно, но у курящих женщин уровень рака эндометрия и эндометриоза тоже ниже по сравнению с некурящей популяцией женщин. Как можно объяснить такое явление? Оказалось, что у курящих женщин, особенно у женщин старшего возраста, в целом понижен уровень эстрогена, что уменьшает пролиферацию эндометрия. И эндометриоз, и рак эндометрия в большей степени являются эстроген-зависимыми заболеваниями. Другие исследования показали, что при длительном курении уровни эстрогенов, прогестерона и белка, связывающего половые гормоны, почти не меняется. Одновременно у ряда женщин наблюдаетсянезначительное понижение уровня прогестерона и повышение уровня эстрадиола во вторую фазу цикла. Насколько полученные данные достоверны, сказать трудно. Несомненно, требуется проведение большего количества исследований в этом направлении. Другая теория объясняет понижение уровня эндометриоза и рака эндометрия у курящих женщин влиянием никотина и других веществ на яичники, что приводит к их старению, понижению запаса яйцеклеток, а поэтому уменьшению выработки эстрогенов. Прогестерон, пропорция которого увеличивается, также подавляет рост эндометрия. У женщин, страдающих эндометриозом, количество ПР-В уменьшено, как и их активность, причем как в матке, так и внематочных эндометриоидных очагах. К тому же, у таких женщин наблюдается повышенная устойчивость (резистентность) к прогестерону (более подробно читайте в главе «Прогестерон и эндометриоз»). У курящих женщин из-за повышенной активности прогестероновых рецепторов уровень эндометриоза ниже. Но ошибочным будет мнение, что курение полезно в профилактике рака эндометрия и эндометриоза, потому что этот защитный эффект чрезвычайно слабый по сравнению с вредом курения для всего организма, в том числе для яичников. Сигаретный дым содержит более 4000 ингредиентов, только один из которых может воздействовать на прогестероновые рецепторы и стимулировать гены, влияющие на рост и дифференциацию эндометрия. Поэтому следует заниматься не поощрением курения, а поиском веществ, которые могут оказать лечебное воздействие на эндометрий. Но даже у женщин с низким уровнем эстрогена, что наблюдается при ановуляторных циклах и аменорее, уровень рака эндометрия тоже выше. Это связано с тем, что у таких женщин также наблюдается низкий уровень прогестерона, так как нет овуляции и поэтому нет желтого тела. Гиперплазия эндометрия, которая возникает при ановуляторных циклах, является результатом диспропорции гормонов — эстрогенов и прогестерона, несмотря на их низкие уровни. Маловероятно, что незначительное понижение уровня эстрогена предохранит курящих женщин от гиперплазии. У женщин в предклимактерическом периоде, когда наблюдаются скачки эстрогенов, не компенсированные ростом уровня прогестерона из-за отсутствия овуляции или редкой овуляции, тоже может наблюдаться гиперплазия эндометрия.6. ЭНДОГЕННЫЙ И ЭКЗОГЕННЫЙ ПРОГЕСТЕРОН
Прогестерон, который вырабатывается в организме женщины, называется эндогенным прогестероном. Хотя у каждой женщины, а также у многих животных, особенно млекопитающих, вырабатывается один и тот же вид прогестерона, любой источник гормона вне организма конкретной женщины не будет считаться эндогенным. Таким образом, введение прогестерона, по химической структуре идентичного тому, который вырабатывается в женском организме, будет экзогенным источником. Прогестерон, полученный синтетическим и полусинтетическим путем, является экзогенным гормоном. То же самое можно сказать о прогестинах, которые часто называют синтетическими формами прогестерона. До сих пор неизвестно как взаимодействует эндогенный прогестерон, вырабатываемый яичниками женщины, с экзогенным прогестероном и прогестинами, вводимыми в организм разными путями, хотя в этом направлении проведено и проводится много исследований. Несмотря на то что прогестерон и прогестины используются в медицине уже полстолетия, многие аспекты побочных эффектов гормональных препаратов, особенно после длительного их приема или же через длительный промежуток времени после окончания их приема, глубоко не изучены. Это связано с тем, что на рынке имеется большое количество прогестинов, к тому же в разных формах и комбинациях.6.1. Половые гормоны в растительном и животном мире
Стероиды, близкие по строению к половым гормонам и прогестерону, найдены у 60–80 % видов растений, которые были исследованы учеными за последние несколько десятилетий. Прогестерон также найден в грецком орехе (Juglans regia). Интерес к биохимическому строению растений возник почти столетие тому назад с развитием органической химии. Но изучение растительных веществ достигло апогея после второй мировой войны, в 50–60х годах, когда проводились поиски противораковых препаратов и были изучены как сотни тысяч веществ растительного и животного происхождения, так и синтетические вещества. Иногда эти вещества обозначались номерами, а не названиями, так как открытия делались очень часто, почти каждый день. И только со временем появились названия многих органических веществ, в основном тех, которые успешно начали применяться в альтернативной и официнальной медицине. Изучение стероидов растений продолжается и в наше время. Открытие новых стероидных веществ показывает, что между растительным и животным миром существует тесная связь, что предполагалось и раньше. Некоторые стероиды можно найти только в растительном мире, но их изучение позволяет ученым создавать новые лекарственные препараты. Животный мир тоже богат стероидными веществами, в том числе половыми гормонами и их метаболитами. Прогестерон вырабатывается у всех видов млекопитающих. Интересно, что роль прогестерона, как и его использование у животных, особенно тех, которые выращиваются в сельском хозяйстве для разных целей, изучена намного детальнее, чем у людей.6.2. Желтое тело яичника
В организме женщины существует несколько источников выработки прогестерона. У небеременной женщины основную роль производителя гормона берут на себя яичники, в первую очередь желтое тело яичников, а также дополнительно этот гормон вырабатывается в надпочечниках, реже в других тканях, о чем упоминалось выше. Что такое желтое тело? Во время овуляции фолликул разрывается (лопается), яйцеклетка выходит за пределы яичника в брюшную полость в месте отверстия маточной трубы, а объем лопнувшего фолликула быстро заполняется кровью — возникает геморрагическое тело (corpus hаemorrhagicum), что на УЗИ может выглядеть как кровотечение в яичнике и что нередко ошибочно принимается за кровоизлияние в яичник или патологическую апоплексию яичника, и женщину направляют на операцию (о геморрагическом теле упоминается в другой главе этой книги).
Пока яйцеклетка путешествует по маточной трубе, в лопнувшем фолликуле происходит так называемый процесс лютенизации, когда фолликул становится желтым телом — сorpus luteum. Желтое тело имеет три вида клеток: зернисто-лютеиновые, тека-лютеиновые и К-клетки. Первые два вида клеток иногда называют большими и малыми гранулезными (зернистыми) клетками — именно они являются производителями гормонов. Большие лютеиновые клетки вырабатывают эстроген, не исключено, что под контролем ФСГ. Маленькие лютеиновые клетки являются источниками прогестерона и андрогенов. Corpus luteum также имеет то же кровоснабжение, что и доминантный фолликул. Благодаря росту уровня прогестерона эндометрий матки становится «сочным», «рыхлым», наполненным большим количеством веществ, важных для имплантации плодного яйца. За счет такого строения и функции желтого тела между фолликулами яичника и желтым телом существует тесная связь, выражающаяся обменом сигналов, и желтое тело необходимо рассматривать как закономерный этап развития фолликула во взаимосвязи с другими фолликулами: гранулезные клетки фолликула трансформируются в гранулёзное-лютеиновые клетки, тека-клетки фолликула становятся тека-лютеиновыми клетками. Если беременность не наступила, желтое тело после 21-го дня цикла начинает регрессировать, выработка прогестерона понижается, а на месте лопнувшего фолликула возникает рубец — желтое тело становится белым телом. Если беременность наступила, с началом имплантации в крови женщины повышается уровень хорионического гонадотропина, который стимулирует активность желтого тела (традиционное мнение), которое становится желтым телом беременности. В 7–8 недель беременности желтое тело теряет приоритет в выработке прогестерона, отдавая первенство развивающейся плаценте, и понижение ХГЧ после 8–10 недель отражает этот процесс. Классическое описание регуляции работы желтого тела гласит, что она происходит на гипоталамо-гипофизарном уровне выработкой лютеотропного гормона (ЛГ). Но это один уровень регуляции, а существует еще и второй — автономный, на уровне самого желтого тела. Этот второй уровень регуляции может поддерживать желтое тело в течение короткого периода в случае нехватки сигналов из гипоталамуса и гипофиза, а также при кратковременном дефиците ЛГ. Важно понимать, что желтое тело не является каким-то отдельным специфичным образованием, которое кардинально отличается от фолликулов. Наоборот, по своему строению и функции в отношении продукции гормонов желтое тело очень напоминает зрелый фолликул яичника.
6.3. Лютеиновый прогестерон
Желтое (лютеиновое) тело вырабатывает наибольшее количество прогестерона у небеременной женщины, поэтому этот вид прогестерона нередко называют лютеиновым прогестероном. Несмотря на то что пик выработки гормона наблюдаются на 7-й день после овуляции, когда фактически начинается имплантация плодного яйца, оказалось, что нормы уровней гормона не одинаковы у женщин репродуктивного возраста, как это считалось раньше. Среди ряда этнических групп уровни прогестерона очень низкие, до 70 % ниже по сравнению с другими группами, тем не менее, уровень бесплодия у таких женщин не отличается от средних показателей, о чем рассказывается в других главах этой книги (читайте главу об уровнях прогестерона). После овуляции лютеиновый прогестерон выполняет следующие функции: • Стимулирует собственную продукцию яичником • Подавляет рост (пролиферацию) эндометрия • Стимулирует пролиферацию молочных желез (максимум — 24-й день цикла) • Подавляет воспалительные процессы в яичниках и матке • Включает программу дифференциации эндометрия • Стимулирует рост спиральных артерий миометрия • Активирует железы эндометрия и усиливает их секрецию (выработку особой жидкости) • Вызывает приток к матке ряда клеток иммунной системы, участвующих в создании здоровой взаимосвязи между плодным яйцом и маткой • Создает «окно имплантации» формированием пиноподиев эндометрия • Регулирует выработку гормонов гипофизом и гипоталамусом • Участвует в сексуальном поведении женщины (подавляет сексуальное влечение) • Влияет на психоэмоциональное состояние женщины (подавляет настроение) • Понижает моторику кишечника и желчного пузыря • После зачатия лютеиновый прогестерон выполняет следующие функции: • Понижает сократительную деятельность матки с началом имплантации • Стимулирует формирование децидуальной ткани (важного участка эндометрия в месте прикрепления плодного яйца) У лютеинового прогестерона есть и другие функции, так как рецепторы прогестерона имеются во многих органах человеческого тела. Молодая здоровая женщина в течение одного менструального цикла в 28 дней вырабатывает около 210 мг прогестерона, что составляет около 2500 мг в год.6.4. Плацентарный прогестерон
С 7–8 недель беременности формирующаяся и растущая плацента начинает выработку прогестерона, который называют плацентарным прогестероном. Его количество достигает очень больших уровней. Хотя этот вид прогестерона легко проникает через плацентарный барьер в кровоток матери, все же большая часть прогестерона находится в плацентарной ткани, околоплодных водах и организме плода. C началом продукции прогестерона плацентой выработка прогестерона в яичниках значительно понижается. Уровень прогестерона в крови матери постепенно повышается и достигает максимума перед родами — все это происходит за счет гормона, вырабатываемого плацентой. Высокий уровень прогестерона влияет на женский организм и работу ее органов, однако этот прогестерон женским организмом практически не усваивается, потому что выраженного повышения других стероидных гормонов, производных прогестерона и продуктов обмена прогестерона в крови и моче женщины не наблюдается. Плацентарный прогестерон имеет свою уникальную автономность (независимость) не только от организма женщины, но и от организма плода, и эта автономность является загадкой для ученых и врачей. К концу беременности плацента вырабатывает максимальное количество прогестерона, и общий уровень продукции гормона достигает 300 мг/сутки — во много раз больше, чем вырабатывают яичники.
Какова роль плацентарного прогестерона для женщины? Традиционно считается, что он выполняет следующие функции: • Подавляет воспалительную реакцию миометрия на плаценту • Готовит молочные железы к лактации • Создает баланс между сокращениями и релаксацией мышц матки • Подавляет выработку простагландинов в матке • Стимулирует сокращения матки при доношенной беременности. Другими словами, та часть плацентарного прогестерона, которая попадает в кровяное русло матери, воздействует в основном на матку и на молочные железы. Плацентарный прогестерон намного важнее для плода, чем для матери. До сих пор нет четкого представления о том, какую роль играет прогестерон в жизни плода, потому что до сих пор не найдена зависимость между показателями уровня прогестерона в артериях и венах пуповины и плода. Прогестерон плаценты превращается в прегнандиол в печени плода, а затем используется для синтеза стероидных гормонов. Прогестерон участвует в синтезе кортизола надпочечниками, но чем больше кортизола вырабатывается, тем в большем стрессе находится плод. Так же при дистрессе плода уровень прогестерона в вене пуповины тоже повышается. Повышенный уровень прогестерона в пуповине обнаружен в случаях тазового предлежания и после кесаревых сечений, хотя ряд исследователей опровергают такие данные. Если процесс регуляции выработки и обмена лютеинового прогестерона у женщин изучен хорошо, механизм выработки прогестерона плацентой неизвестен. До сих пор не найдена связь между плодом и плацентой в отношении регуляции выработки и потребления этого гормона плодом — между ними нет ни прямой, ни обратной связи. Механизм сигнализации со стороны плода плаценте о необходимости в прогестероне не изучен. Другими словами, что вынуждает плаценту вырабатывать прогестерон и в каком количестве — неизвестно. Уровень ретроплацентарного прогестерона не имеет взаимосвязи ни с уровнями прогестерона в крови матери, ни в пуповине плода. Отсутствие этой связи подтверждено рядом клинических исследований. И такой феномен удивляет своей уникальностью и неординарностью, потому что плацента выполняет свою программу по выработке прогестерона автономно, а плод — свою программу по его использованию в том количестве, которое необходимо ему, тоже независимо. Основное количество прогестерона находится в плацентарной ткани, и эти уровни растут с прогрессом беременности. Его концентрация в ретроплацентарной крови (между плацентой и эндометрием) составляет от 380 до 4650 нмоль/л, в то время как в плазме женщины находят от 100 до 620 нмоль/л. Это почти в 15 раз больше, чем до беременности. В сосудах пуповины, то есть крови плода, уровни прогестерона составляют от 90 до 1800 нмоль/л. Таким образом, около 30 % прогестерона, вырабатываемого плацентой, используется плодом для продукции многих веществ. Часть прогестерона попадает в кровяное русло матери, но большая часть все же остается в плаценте. Уровень прогестерона в ретроплацентарном пространстве приблизительно в два раза больше уровня в пупочной вене у новорожденных после кесарева сечения. Но уровень прогестерона в плаценте также возрастает перед родами. Не найдена зависимость между полом плода и уровнем прогестерона в пуповине. Исследования показали, что введение дополнительного прогестерона в кровь матери не влияет на уровень прогестерона в плаценте и в крови плода. И этим подтверждается существование этой уникальной автономности плацентарного прогестерона.
6.5. Уровни прогестерона в организме женщины
Вопрос об определении уровня прогестерона в организме женщины возникает в разных ситуациях: для постановки диагноза, при выборе вида гормона с целью лечения, при контроле эффективности лечения. И когда такой вопрос возникает, врача интересует оптимальный метод определения уровня прогестерона с получением наиболее достоверных результатов. После получения результатов возникает еще один вопрос: насколько они «вписываются» в норму. Кажется, что в такой последовательности определения уровня гормонов погрешностей не должно быть, однако большинство врачебных ошибок в постановке диагнозов и назначении лечения возникает не только из-за неправильного определения уровней гормонов, но и из-за неправильной интерпретации полученных результатов анализов. В этой книге уже не раз упоминалось, что в крови прогестерон может находиться в свободном или связанном с белками состоянии. Прогестерон может также быть связан с эритроцитами. Поэтому уровни прогестерона в крови, сыворотке и плазме будут разными. Предполагается, что для подавления роста (пролиферации) эндометрия уровень прогестерона в сыворотке крови должен быть не меньше 5 нг/мл. Однако многие исследования показали, что применение прогестерона в разных формах часто лишь немного повышает уровень гормона. Несмотря на это, лечебный эффект все же может наблюдаться. Как его объяснить в таких случаях? Тем, что уровень прогестерона в крови не отражает его уровень в тканях и клетках, использующих прогестерон, которые также могут содержать метаболиты прогестерона. Некоторые органы очень быстро «втягивают» прогестерон: эндометрий, слюнные железы, легкие, мозг, почки, печень, кожа (через кровь) и жировые прокладки. Совершенно неинформативным и устарелым является определение «гормонального зеркала» по цитологическим мазкам или кольпоскопии, что до сих пор делают многие врачи в постсоветских странах, особенно во время беременности. Абсурдно ставить прогестероновую недостаточность и прогнозировать исход беременности по таким «гормональным зеркалам». В разных лабораториях единицы измерения уровней прогестерона тоже могут быть разными: нг/мл, мкг/л, нмоль/л. Если сравнивать только цифры, без единиц измерения, можно сделать ложные выводы. Каждая лаборатория имеет свои референтные значения, то есть минимальные и максимальные показатели, которые приняты за норму, однако эти рамки показателей могут быть характерными только для метода, которым определяли уровни гормонов, но не отражать реальную характеристику уровней гормонов для определенной популяции женщин. Если, например, реактивы были куплены в другой стране, то референтные значения могут отражать нормы для той страны или региона, где эти реактивы производятся. Референтные значения уровней прогестерона часто не учитывают состояние женщины — беременна она или нет, этническую группу и национальность, возраст, — что влияет на правильную интерпретацию результатов обследования.6.5.1. Особенности уровней прогестерона в женском организме
Помимо того, что в разных жидкостях и фракциях крови уровни прогестерона и его метаболитов могут быть разными, важно помнить, что прогестерон быстро распадается, поэтому его уровни колеблются в организме женщины не только в течение менструального цикла, но и в течение суток. Под влиянием пульсирующей выработки гонадотропинов, выработка прогестерона тоже имеет пульсирующий характер. Поэтому один показатель одного измерения прогестерона не отражает реальную ситуацию гормонального фона женщины. У женщин с нормальной репродуктивной функцией бывают циклы как с низким уровнем прогестерона, так и, наоборот, с высоким. Большинство врачей не учитывают важный факт — все женщины индивидуальны, а идеальные 28-дневные месячные циклы встречаются чаще в текстах учебников по гинекологии, чем в реальной жизни. Определение уровня прогестерона на 21-й день менструального цикла — это проявление отсталости и малограмотности, а не рациональный подход к оценке ситуации и проблем женщины. Более детальное описание того, когда и как следует определять уровни прогестерона, дано в главе «Прогестерон и менструальный цикл». Никогда постановка диагноза не должна проводиться только по одному показателю уровня прогестерона. В зависимости от приема пищи, алкоголя, курения, занятий спорта, образа жизни уровень прогестерона тоже может меняться как в считанные часы, так и на протяжении всего цикла. Прием лекарственных препаратов, в том числе других стероидных гормонов, которые могут назначаться терапевтами, семейными врачами, хирургами и другими специалистами, влияет на уровень прогестерона у женщин. Данных о том, насколько отличаются уровни прогестерона у женщин разных народов и этнических групп во всем мире, очень мало, но довольно часто в лабораториях используются стандартные референтные значения показателей уровней гормонов, которые абсолютно не учитывают этнические особенности женщин, живущих в определенной местности. То, что у одной женщины может быть лабораторным отклонением от нормы, на самом деле будет ее физиологической нормой. Состояние беременности уникально тем, что уровень лютеинового прогестерона после 5 недель понижается, в то время как уровень плацентарного прогестерона растет, однако этот вид прогестерона попадает в кровяное русло женщины в незначительном количестве. Уровень прогестерона на ранних сроках при первой беременности выше, чем при последующих беременностях. Пол ребенка на уровень прогестерона не влияет, так же, как и вес и возраст матери. Еще одной особенностью является то, что у беременных женщин увеличивается в крови уровень свободного прогестерона, причем быстрее, чем уровень общего прогестерона. С 24 недель до 40 недель количество свободного прогестерона увеличивается с 6 % до 13 % от общего прогестерона. Интересно, что буквально через два часа после родов уровень связанного и свободного прогестерона резко понижается, однако пропорция свободного прогестерона увеличивается до 19 % от общего и может продержаться на таком уровне продолжительный период времени. В лабораториях уровень свободного прогестерона при беременности не определяется, поэтому могут быть сделаны ложные выводы о «нехватке гормона беременности». Введение экзогенного прогестерона повышает уровень свободного прогестерона в крови, но обычно на непродолжительный период времени, так как прогестерон быстро распадается. Кроме того, уровни свободного и связанного прогестерона будут зависеть от дозы вводимого препарата и путей введения, а также от других факторов. Существует много других особенностей выработки, усвоения и распада прогестерона, о которых упомянуто в других главах этой книги. Все эти особенности должны учитываться врачами, прежде всего для правильной постановки диагноза.6.5.2. Мифы о минимальном уровне прогестерона, питании и условиях жизни
Очень часто женщин интересует вопрос, какой минимальный уровень лютеинового прогестерона является допустимым для зачатия и нормального развития беременности. Многие врачи также ищут связь между уровнями прогестерона до беременности и уровнями успешной имплантации и прогресса беременности. В разных странах мира проводились исследования на эту тему, и мнения ученых расходятся. Одни считают, что уровень прогестерона в 5 нг/мл (16 нмоль/л) является достаточным для успешного развития беременности на ранних сроках. Многие репродуктивные клиники за минимальный уровень приняли показатели лютеинового прогестерона в 10–13 нг/мл (32–41 нмоль/л). У большинства женщин уровни лютеинового прогестерона составляют 7–57 нмоль/л. Однако референтные значения многих лабораторий разные, как и единицы измерения прогестерона, что вносит немало путаницы в правильную интерпретацию результатов анализов. Кроме того, даже при низком уровне прогестерона у женщины есть потенциальный шанс выносить ребенка. Все эти многочисленные противоречия породили большое количество слухов, страхов и мифов о том, какими должны быть минимальные уровни прогестерона. Известно, что самые низкие уровни рождаемости наблюдаются сейчас у белой расы, особенно у жителей развитых стран. Количество бездетных семейных пар увеличивается, в большинстве семей имеется только один ребенок, реже двое-трое детей. В медицинской литературе можно найти информацию о том, что питание играет роль в уровне зачатий и плодовитости. Но если рассмотреть уровни беременностей и родов у народов развивающихся стран, то они самые высокие. Женщины беременеют и рожают в условиях низкого социально-экономического уровня, военных действий, нехватки пищи и воды. Несмотря на многие лишения, женщины развивающегося мира беременеют до 12 раз в течение своей жизни и имеют по 7–8 детей в среднем. Многие дети умирают из-за голода и опасных инфекций, тем не менее, скорости прироста населения во многих странах большие. Фертильность очень мало зависит от питания, хотя регулярность менструальных циклов и наличие овуляции зависят от индекса массы тела и количества жировой ткани в организме женщины. Исследования американских врачей показали, что овуляторная функция яичников зависит от энергетического обмена и может быть нарушена при низком или высоком уровнях этого обмена. Самой частой причиной нарушения овуляции у женщин развитого мира является состояние стресса, в том числе энергетический стресс. Фактически любой стресс — физический, эмоциональный или пищевой (питательные вещества — это тоже энергия) может привести к нарушению овуляции. Вопрос, почему у женщин «упитанного общества», в котором имеется достаточно пищи, реакция на стресс выражается нарушением функции яичников, вызывает много споров среди специалистов разных направлений, и до сих пор не имеет четкого объяснения. Одна из гипотез предполагала, что такие проблемы связаны с нехваткой прогестерона, который влияет на зачатие и протекание беременности. Но уровень прогестерона вплоть до овуляции очень низкий. Также известно, что нехватка прогестерона сопровождается чаще бесплодием, а не невынашиванием беременности, и обычно понижен уровень зачатия. Изучение уровня прогестерона американских женщин сельской (неиндустриальной) местности показало, что уровни гормона у них ниже, чем у городских жительниц, хотя уровень зачатий и беременности выше. Если в целом все американские женщины питаются почти одинаково, говорить о нехватке питательных веществ, за исключением редких случаев, не приходится. Ученые решили провести международное исследование и проверить уровень прогестерона у женщин Боливии из племени Аймара, проживающих в высокогорной местности. Это племя было выбрано потому, что его поселения находятся в очень отдаленной от городов части страны, высоко в горах, женщинам этого племени приходится заниматься тяжелым физическим трудом, часто недоедать. Кроме того, контрацепция среди мужчин и женщин в этом регионе планеты полностью отсутствовала. Ряд предыдущих исследований показали, что уровень прогестерона у женщин высокогорных племен ниже уровня прогестерона у женщин городов и индустриальных зон. Самые высокие уровни прогестерона обычно наблюдались у беременных и кормящих женщин. Чтобы избежать погрешностей в получении достоверных данных, участницы в группах американских и боливийских женщин были почти одинаковыми по возрасту. Средний возраст женщин, забеременевших впервые, в Чикаго — 31 год (в Канаде — 30 лет, в странах Европы — 27–29 лет, в США — 29 лет). Хотя известно, что уровень прогестерона у зрелых женщин не зависит от возраста вплоть до климактерического периода, возраст боливийских женщины был подобран в соответствии с возрастом американок из Чикаго, и в среднем составлял 27–28 лет, однако большинство из них между 20 и 30 годами жизни уже прошло минимум через 4 родов. После каждых родов они кормили своих детей минимум 1–2 года, и продолжительность послеродовой аменореи (отсутствие менструаций) составляла минимум один год. Оказалось, что уровень прогестерона у боливийских женщин был значительно ниже и составлял в фолликулярную фазу 77 % уровня прогестерона американских женщин, 67 % в лютеиновую фазу, и на пике лютеиновой фазы — 71 %. Эти показатели определялись в циклах, когда происходило зачатие. Если отличия уровней прогестерона у американок среднего класса и боливийских женщин из высокогорного села в фолликулярную фазу не считались важными для выводов (статистически значимыми), различия в уровнях были значительными после овуляции и во время месячных. Рост уровня прогестерона после овуляции был быстрее и выше у американских женщин, особенно ближе к пику прогестерона. В период имплантации (8–10 день после овуляции) уровень гормона у боливийских женщин был в два раза меньше его уровня у американских женщин. Независимо от того, произошло зачатие или нет, уровень прогестерона был понижен во всех циклах боливийских женщин по сравнению с американскими. Это привело исследователей к выводу, что низкие уровни прогестерона не являются показателями бесплодия и могут быть индивидуальными физиологическими особенностями многих здоровых женщин. Низкие уровни прогестерона могут быть также особенностью не только жительниц сельских местностей, но и ряда этнических групп, живущих в разных регионах мира. Например, известно, что за нормальные минимальные уровни прогестерона у японских женщин приняты те, которые ниже показателей у американских и европейских женщин. Низкие уровни прогестерона обнаружены у сельских женщин Польши, Непала, Конго. Эти уровни почти одинаковы с уровнями боливийских женщин, проживающих на высоте 4000 м над уровнем моря. Это означает, что географические особенности местности не играют роли в колебаниях уровней гормонов. Также было замечено, что уровни прогестерона у женщин всех этих популяций понижаются в периоды уменьшения количества пищевых продуктов (часто в зимне-весенний период). Таким образом, уровни прогестерона в крови женщин могут зависеть от тех факторов, на которые врачи обычно не обращают внимание. Всегда в случаях низкого уровня прогестерона необходимо учитывать жалобы и признаки прогестероновой недостаточности, что обсуждается в главе, посвященной вопросам лютеиновой недостаточности.6.5.3. Определение уровня прогестерона в слюне
То, что уровень прогестерона в сыворотке крови не показывает реальную насыщенность организма этим гормоном, подтверждает ряд других исследований. В частности, уровень прогестерона в слюне после применения крема прогестерона резко повышается, в отличие от уровня прогестерона в сыворотке крови, который практически не меняется. Поэтому в медицине был период, когда определение уровня прогестерона предлагалось проводить в слюне. До сих пор некоторые врачи пользуются этим методом, но чаще всего его применяют в коммерческих целях. Забор крови через венепункцию (прокол вены), или даже прокол пальца, часто требует лицензирования и сертификации медперсонала, выполняющего такие процедуры, а также наличия условий для забора, хранения и транспортировки биологических жидкостей. Взятие же слюны может быть проведено и в домашних условиях. Каким должен быть уровень прогестерона в слюне женщины, до сих пор неизвестно, хотя существует немало спекуляций на эту тему. Считается, что у беременных женщин уровень прогестерона в слюне составляет приблизительно 1 % от уровня прогестерона в сыворотке крови и 0.5–1 % — в плазме крови. Количество свободного прогестерона в слюне чуть выше такового в крови и составляет в среднем 2.5 %. По количественному содержанию, не процентному, в крови женщины приблизительно в 100 раз больше общего прогестерона и в 20 раз больше свободного по сравнению со слюной. Ряд оральных косметических средств и тех, которые используются для ухода за ротовой полостью, могут понижать уровень прогестерона в слюне, и поэтому искажать реальные уровни концентрации гормона. Особенности обмена прогестерона в ротовой полости описаны в других главах этой книги. Тем не менее, практического значения определение концентрации прогестерона в слюне не имеет.6.6. Понятие о натуральном и биоидентичном прогестероне
В популярной, медицинской и научной литературе понятие «прогестерон» часто употребляют для обозначения прогестерона, его синтетических форм и производных (метаболитов), которые могут иметь действие, сходное с человеческим прогестероном. Даже во многих публикациях по теме исследований разные формы прогестинов могут называться одним словом «прогестерон», вводя в заблуждение читателей, в том числе врачей. Но наибольшая путаница существует сейчас в понятиях «натуральный» и «биоидентичный» прогестерон. Современные женщины и специалисты, назначающие и применяющие препараты прогестерона, чаще всего не догадываются, что именно входит в состав препарата под названием «натуральный прогестерон» и из какого сырья он получен. Такая неразбериха связана не только с отсутствием серьезного контроля производства «натуральных продуктов», но и их качества, эффективности и безопасности. Под натуральным понимают вещество, которое можно найти в человеческом теле, или вещество, которое можно найти в природе, но не в человеческом теле. Такое определение «натуральности» условное и может ввести в заблуждение многих людей. В отношении прогестерона понятие «натуральный» мы можем использовать только через призму выработки этого гормона человеческим организмом. В современных гинекологии и репродуктивной медицине используют три класса препаратов, которые могут иметь прогестероновое действие или влиять на его выработку и действие: биоидентичный прогестерон, прогестины, анти-прогестероны (в частности, селективные модуляторы прогестероновых рецепторов). Все полусинтетические и синтетические прогестероны, имеющиеся на рынке, могут по-разному реагировать на рецепторы прогестерона, а также связываться с разными рецепторами, вызывая специфическую реакцию в других тканях человеческого организма. Данных, говорящих в пользу большей безопасности или эффективности прогестерона по сравнению с прогестинами, не существует. Однако в отношении развития ряда осложнений или побочных эффектов прогестерон и прогестины могут иметь разное действие.6.6.1. Понятие «биоидентичного гормона»
Что собой представляет «биоидентичный гормон»? К сожалению, стандартного определения этого понятия не существует, что порождает много путаницы среди врачей и тех, кто принимает такие гормоны. Многие женщины имеют ложное представление о биоидентичности, считая, что она гарантирует натуральность, а поэтому полную безопасность по сравнению с синтетическими формами гормонов. Будучи под влиянием таких ложных убеждений, немало женщин требуют назначения «натуральных» гормонов. Такое же ложное убеждение преобладает и среди постсоветских врачей в отношении назначения всем подряд беременным женщинам «натурального» прогестерона (многие врачи, а тем более женщины, не знают, что «любимый всеми» дюфастон является синтетическим прогестином, а не «натуральным прогестероном»). Понятие «биоидентичный» может быть приемлемо для характеристики как натуральных (не созданных искусственно, даже путем полусинтеза) веществ, так и искусственных, если их строение и действие совпадает с веществами, вырабатываемыми организмом. Поэтому большинство профессиональных медицинских обществ считает, что биоидентичным гормоном можно назвать гормон, который по молекулярному строению и химическому воздействию идентичен гормону, вырабатываемому человеческим телом. Важно понимать, что такое определение не указывает источник и механизм получения вещества, и в современной медицине имеется много лекарственных препаратов, которые являются биоидентичными, хотя созданы искусственно. Независимо от того, утверждено или лицензировано такое вещество определенными инстанциями (например, FDA в США), если оно идентично по строению и действию натуральному веществу, его называют биоидентичным, а не натуральным. Современная медицина до сих пор не имеет в своем арсенале натурального прогестерона. Все гормоны, которые применяются в современной гинекологии, могут быть как биоидентичными, так и небиоидентичными, то есть такими веществами, которые в природе (организме человека) не встречаются. К ним относятся следующие: • Эстрогены: синтетические конъюгированные эстрогены, натуральные животные (не человеческие) конъюгированные эстрогены, биоидентичные эстрогены растительного происхождения • Прогестероны: синтетические прогестины, биоидентичный прогестерон • Комбинированные препараты эстрогенов и прогестеронов: комбинация синтетических конъюгированных эстрогенов, животных конъюгированных эстрогенов и прогестинов. Все без исключения комбинированные формы эстрогенов и прогестеронов не являются биоидентичными гормонами, хотя некоторые виды эстрогенов получают из мочи беременных животных, чаще всего лошадей. Все биоидентичные препараты эстрогенов по химической структуре являются 17-β-эстрадиолами, полученными из растительного сырья, и продаются в разных формах (таблетки, капсулы, кремы, гели, пластыри, спреи, влагалищные таблетки). Выработка этих препаратов строго контролируется и соответствует принятым стандартам производства в большинстве развитых стран. Исследования, которые бы сравнили эффективность и безопасность биоидентичных и синтетических эстрогенов, с вовлечением больших групп женщин-участников не проводились, потому что существует большое количество препаратов эстрогенов (несколько десятков), которые сравнить между собой все невозможно, а тем более, если их применяют в разных формах. На современном рынке существует только один вид биоидентичного прогестерона (микронизированный прогестерон), хотя он может продаваться под разными названиями и в разных формах (таблетки, влагалищные таблетки, гермы, гели). В отличие от препаратов эстрогенов, в том числе биоидентичных, и синтетических форм прогестерона, выработка биоидентичного прогестерона не контролируется и не проходит стандартизацию в большинстве стран мира.6.6.2. Комбинированная биоидентичная гормональная терапия
Существует также понятие комбинированной биоидентичной гормональной терапии (КБГТ), которая включает гормоны, идентичные по химическому и молекулярному строению природным человеческим эстрогенам и прогестерону, являющимся производными растений, и подобранным индивидуально для конкретного пациента (кастомизированным). Такой вид терапии чаще используется вне официнальной медицины или отдельными врачами и может включать 17-β-эстрадиол, эстрон, эстриол и микронизированный прогестерон, а также иногда тестостерон и его метаболиты. Данный вид комбинации препаратов обычно изготавливается по индивидуальному заказу в аптеках, однако преимущество в эффективности и безопасности КБГТ не доказано, потому что этот вопрос никогда не изучался.6.6.3. Микронизация прогестерона
Микронизация — это процесс уменьшения средних размеров частиц путем их дробления до размеров в микроны. Слово «микрон» в переводе с греческого означает «маленький». Когда говорят о размерах, то 1 микрон равен 0.001 мм. Микронизированный прогестерон получают методом ряда химических реакций, то есть путем все того же синтеза, поэтому такой вид прогестерона нельзя считать натуральным прогестероном. Кроме того, такой прогестерон содержится в жировом растворе. Микронизация прогестерона позволяет ему лучше усваиваться и проявлять свое действие, а также он более устойчив к распаду. Большинство форм прогестерона, продаваемых в аптеке, не являются микронизированными. Чтобы знать, какой прогестерон микронизирован, а какой нет, важно читать этикетки и знать содержимое препарата. Производитель обязан указать, если прогестерон прошел микронизацию, то есть в препарате имеется микронизированный прогестерон. Биоидентичный прогестерон не означает, что он был микронизирован. Микронизированные формы прогестерона растворены в растительных маслах, чаще всего арахисовом, поэтому не могут назначаться женщинам, у которых есть аллергия на арахис.6.6.4. USP прогестерон
Многие люди заказывают и покупают заграничные лекарственные препараты, несмотря на некоторые ограничения на продажу и пересылку лекарств в разных странах. Не все виды препаратов, в том числе прогестерона, прошли регистрацию и лицензирование как лекарства. Нередко женщины заказывают заграничные препараты через знакомых, родственников, друзей, поэтому все чаще постсоветские женщины используют USP прогестерон. Что собой представляет этот вид прогестерона? USP означает United States Pharmacopeia (Фармакопея Соединенных Штатов). Это общественная, негосударственная организация, создающая официальные общественные стандарты для назначения лекарственных препаратов по рецепту и без рецептов через аптечную сеть США. Она также проводит стандартизацию многих пищевых и диетических добавок (БАДов). Эти стандарты включают качество, чистоту, силу воздействия и соответствие этих критериев описанию препаратов, и они приняты в более чем 130 странах мира. Таким образом, многие европейские препараты могут иметь метку «USP». USP прогестерон — это прогестерон, который соответствует определенным принятым стандартам по качеству, чистоте, потенции (силе воздействия) и консистенции. Это не означает, что такой вид прогестерона (или другого препарата) прошел регуляторный процесс через соответствующие инстанции, например, FDA в США. Тем не менее, такой вид препарата является стандартизованным, тоесть все же прошел соответствующий контроль. USP-стандартизация не отвечает за эффективность и безопасность препарата, как и рациональность рекомендованных лечебных и суточных доз, и не учитывает результаты клинических исследований.6.6.5. Стандартизация прогестерона
В ряде стран выпуск и продажа прогестерона в любом его виде строго контролируется. Например, в Австралии прогестерон назначают только по рецепту. Крем «натурального прогестерона» запрещен к продаже и распространению в этой стране. Стандартизация препаратов прогестерона требует от производителя не только определенного качества препарата, но и немалых денег на ее проведение. Поэтому далеко не все формы прогестерона, в том числе «натурального», прошли проверку и стандартизацию, тем не менее, продаются во многих странах без всякого контроля не только в аптеках, но и в ряде магазинов «натуральных продуктов». Прогестерон — это единственный гормон, продажа и распространение которого не контролируются во многих государствах. Рекламы и аннотации, связанные с продажей «натурального прогестерона», часто содержат ложную информацию: например, «диосгенин дикого ямса превращается в прогестерон в человеческом теле», что совершенно невозможно в силу того, что в организме человека отсутствует специальный фермент, который используют в лаборатории для производства прогестерона из диосгенина (о диосгенине читайте дальше). То же самое можно сказать и о других сапонинах, из которых вырабатывают прогестерон — в человеческом организме они не превращаются в прогестерон, как, впрочем, и в другие гормоны. И таких ферментов, которые бы превращали сапонины в прогестерон, нет не только у человека, но и у всех млекопитающих. Только у мышей было обнаружено, что диосгенин может проявляться слабым эстрогенным эффектом, но не прогестероновым. Др. Джон Ли создал своими публикациями о прогестероне слишком много неразберихи среди женщин, а также ряда врачей, предоставив ложную, неточную информацию, далекую от клинических исследований. Например, он утверждал, что экстракт дикого ямса, который можно купить в «магазинах здоровья», всегда содержит очищенный стандартизированный прогестерон. Стандартизацию не проходят многие препараты, а тем более растительного и животного происхождения (фитотерапевтические, гомеопатические и др.), продающиеся вне аптечной сети. Ряд врачей также распространяют ложную информацию о том, что лучше принимать «натуральные предшественники» прогестерона, потому что они химически не обработаны, поэтому более безопасны, чем прогестерон, полученный из диосгенина. Но, опять же, эти врачи не знают, что диосгенин и предшественники прогестерона не усваиваются человеческим телом. Также понятие «экстракт» означает определенную химическую реакцию, которая проводится для получения диосгенина из растительного сырья, то есть это продукт химической переработки сырья. То же самое можно сказать и о получении диосгенина из соевых растений. В 2001 году FDA провела анализ 29 образцов гормональных продуктов, антибиотиков и стероидов, производимых 12 разными фармакологическими компаниями. Выбор продуктов был случайным. Оказалось, что качество 10 продуктов (34 %) не соответствовало американским стандартам качества, и 9 из них не прошли тестирование по силе воздействия, то есть оказались пустышками. Эта случайная выборка фармакологической продукции, которая также включала «натуральные продукты» и разного рода БАДы, показала, что огромная часть всего, что продается в американских аптеках, не соответствует принятым стандартам и вообще не прошла стандартизацию. Ситуация в других странах не лучше, а в некоторых намного хуже из-за отсутствия строгого контроля в регистрации, стандартизации и лицензировании аптечной продукции.6.7. Прогестерон в классификации фармакологических веществ
Между тем, что предоставляется людям в качестве информации при продаже прогестерона, и бизнесменам и профессионалам при закупке прогестерона оптовыми партиями, существует большая разница. Ни один владелец аптеки не приобретет партию товара (лекарства) без надлежащего описания его свойств согласно классификации фармакологических веществ. Прогестерон — не исключение. Но информация, которая предоставляется в сопроводительной документации, отличается от того, что пишут в рекламных аннотациях или инструкции по применению прогестерона. В классификации фармакологических веществ в отношении прогестерона имеются следующие характеристики: • канцерогенный эффект — классифицирован как класс 2 или 2 В (возможен у людей) • мутагенный эффект — неизвестно • тератогенный эффект — возможен у людей • токсичность для развития — репродуктивная система/токсин/женский организм, репродуктивная система/токсин/мужской организм (возможно); вещество, токсическое для органов репродуктивной системы, длительный прием вызывает повреждение органов • совместимость с другими веществами — реагирует с окисляющими агентами • коррозионность — не вызывает коррозию, находясь в стеклянном контейнере • специальные замечания о воздействии — может разлагаться под воздействием лучей света. Может вызывать побочные эффекты при воздействии на репродуктивную систему и пороки развития (тератогенный). Может повреждать генный материал. Может вызывать рак. • Специальные замечания о токсических эффектах на людей: кожа — может вызывать раздражение кожи, глаза — пыль прогестерона может вызвать раздражение глаз, ингаляция — может вызвать раздражение дыхательных путей, прием внутрь — может вызвать раздражение ЖКТ, в том числе диарею и тошноту. Может влиять на поведение человека, функцию печени и обменные процессы. В ряде штатов США и стран Европы на упаковке прогестерона требуется указание, согласно закону, что препарат вызывает повреждение репродуктивной системы, пороки развития и рак. Если бы такое описание прогестерона и его других форм сопровождало каждую упаковку, продающуюся в аптеках или «магазинах здоровья», и, если бы пользователи, как, впрочем, и врачи, получали правдивую информацию, наверняка сторонников у бесконтрольного приема прогестерона было бы намного меньше.6.8. Понятие о фитостеролах
Практически, все без исключения растения содержат органические вещества — стеролы, которые часто называют фитостеролами. Грибки содержат эргостерол. Животные содержат только один вид стерола — зоостерол, или холестерол (холестерин). Все эти стеролы являются неотъемлемой частью жизнедеятельности растений и животных, участвуют во многих химических реакциях, являются фундаментальными структурами для выработки многих других веществ, в том числе гормонов живыми организмами. Фитостеролы, то есть растительные стеролы, которые используют для синтеза прогестерона, имеют различия в своей структуре по сравнению со структурой молекулы прогестерона, поэтому не могут быть превращены в организме человека в прогестерон. Процесс превращения фитостеролов в прогестерон всегда является лабораторным процессом и никогда не происходит в живой природе, потому что сама молекула стерола должна быть изменена по паттерну человеческого холестерина. Например, стигмастерол проходит через 11 химических реакций при получении прогестерона. Конечно, холестерин является предшественником прогестерона и, казалось бы, получение гормона из этого вещества было бы оптимальным вариантом. Однако процесс превращения холестерина в прогестерон в лабораторных условиях является чрезвычайно дорогостоящим, экономически невыгодным. Поэтому во всем мире прогестерон получают из растительного сырья — соевых бобов (Glycine max), некоторых видов ямса (Dioscorea composita, floribunda, mexicana, villosa, deltoidea, nipponica), агавы, пажитника, калабарских бобов (Physostigma venenosum), некоторых видов лилий, юкки, паслена и его сородичей, кукурузы. Из фитостеролов для получения прогестерона чаще всего используют стигмастерол, диосгенин, бета-ситостерол, кампестерол, гекогенин, сарсасапогенин и соласодин. Стигмастерол впервые был получен из калабарских бобов (физостигмы ядовитой), растущей в тропиках Африки. Физостигмин — лекарство, которое получают из этого же растения, применяют для лечения глаукомы и других заболеваний. Но получение этого фитостерола из физостигмы оказалось дорогостоящим, поэтому в коммерческом производстве прогестерона используют соевые бобы. Экономически выгодным оказалось получение стигмастерола из семян рапса (Brassica napus), который легко культивировать, особенно в странах, где сою выращивать трудно. Его получают также из офиопогона японского (Ophiopogon japonicas), американского женьшеня (panax quinquefolius), некоторых видов легуминов (стручковых), ряда овощей, орехов, семян и даже цельного молока. Корень имбиря Крепа (Costus speciosus) тоже начал использоваться в производстве прогестерона, и теперь это растение культивируется в Индии и странах Южно-Азиатского региона. Растительные масла содержат больше фитостеролов, чем листья и стебли.6.9. Мифы о прогестероне из дикого ямса
В многочисленных источниках, в том числе рекламных аннотациях, продаваемых прогестероновых препаратов, часто звучит, что это «натуральный прогестерон, полученный из ямса» или же «натуральный прогестерон, полученный из диосгенина дикого ямса». Но является ли современный «диосгениновый» прогестерон натуральным или синтетическим производным ямса? Дикий ямс считается лекарственным растением в ряде стран мира. Известно также, что его широко использовали древние жители Южной и Северной Америк, в частности для лечения диабета, желудочно-кишечных расстройств, артритов, ряда опухолей. То, что мексиканский дикий ямс содержит диосгенин, было известно ученым еще в 30-х годах прошлого столетия. В 1940 году Рассел Маркер, американский химик, запатентовал синтез прогестерона из диосгенина дикого ямса (dioscorea spp), и в честь ученого такой процесс получения прогестерона назвали «деградацией (распадом) Маркера». Из того же диосгенина получали и другие стероидные гормоны. Прогестерон, полученный из ямса, не был натуральным прогестероном (и им не является), а его считают полусинтетическим продуктом, а также биоидентичным прогестероном. Почти 40 лет во всем мире использовали именно такой способ синтеза прогестерона и других стероидов, пока в 1971 году другой американский химик, Уильям Саммер Джонсон, не синтезировал прогестерон из комбинации органических и неорганических веществ, то есть создал гормон искусственно. Открытие Маркера привело к поиску источников сырья, а также изучению разных видов ямса для получения большего количества прогестерона. Во многих странах ямс выращивают как пищевой продукт. «Белый ямс» — Dioscorea rotundata, и «желтый ямс» — Dioscore cayenensis (более 200 подвидов), являются самыми распространенными и выращиваются в Африке. «Фиолетовый, или водяной, ямс», Dioscorea alata, распространен в Южной Азии и ряде регионов Африки. Японский горный ямс, или китайский ямс, D. opposite, в Европе называют сладким картофелем. Он очень популярен в китайской и японской кухне. Существуют и другие съедобные виды ямса. В отличие от дикого ямса съедобный ямс, который культивируется во многих странах Латинской Америки и других странах, не содержит диосгенин. Население восточной Мексики, где был обнаружен дикий ямс, не хотело заниматься его выращиванием, а получение сырья оказалось непростой задачей. Чтобы понять, почему культивирование дикого ямса, Dioscorea villosa, стало серьезной проблемой для получения дешевого сырья, необходимо ознакомиться с некоторыми особенностями выращивания ямса. Для получения прогестерона используют корни и реже сухую часть побегов-лиан. Концентрация диосгенина в сухих корнях растения составляет 3–4 %, хотя во многих публикациях эти показатели завышены. Наземная часть состоит из стеблей-лозы, длина которых достигает 30 метров, и обычно они обвивают стволы деревьев как лианы. Глубоко растущее мясистое корневище должно быть удалено из почвы глубиной до 1 метра. Количество диосгенина во многом зависит от наличия воды в местности. Сухие и мелкие корневища обычно к использованию непригодны. Но районов с хорошим водоснабжением для получения корневищ, удовлетворительных для сбора урожая, чрезвычайно мало.
В 50-х годах с большим трудом собиралось около 5 500 тонн сухого сырья для производства стероидных гормонов, что не могло удовлетворить рыночную потребность в гормонах. Поэтому цена прогестерона для его производителей не была дешевой — в 1940 году 200 долларов за 1 грамм. Улучшение технологии полусинтеза прогестерона позволило понизить стоимость 1 грамма до 30 центов в 1956 году. Мексика стала мировым лидером-монополистом производства диосгенина и продержалась на этом посту более 20 лет. Однако после открытия полусинтеза прогестерона, добывать дикий ямс с каждым годом становилось все труднее — расстояние между джунглями, где росло растение, и центрами переработки сырья значительно увеличивалось, что значительно повышало стоимость перевозки переработанного сырья в другие страны. Одновременно правительство Мексики подняло вопрос защиты джунглей от уничтожения и начало строго контролировать количество дикого ямса, разрешаемое для использования в фармацевтической индустрии. Также были получены другие стеролы (фитостеролы) из соевых масел — стигмастерол и ситостерол, и гекогенин из отходов агавы, из которых могли вырабатывать и прогестерон. Поэтому во всем мире начался поиск поставщиков ямса, идентичного мексиканскому. В Гватемале обнаружили ямс D. floribunda, близкий к мексиканскому, но другого вида, в Африке пробовали использовать съедобный ямс, в Коста-Рике и Пуэрто Рике были попытки выращивания «лекарственного» ямса. Но выращивание из-за неблагоприятных условий (плохая почва и особенности климата) оказалось чрезвычайно дорогостоящим процессом. Проект по выращиванию ямса в Гватемале длился почти 20 лет, с 1962 по 1980 год, и поначалу казался успешным. Это была эпоха многочисленных ботанических экспериментов, но она была также наполнена интригами, ложными отчетами, финансовыми махинациями, и в итоге оказалось, что выращивание ямса в Гватемале потерпело фиаско и стало экономически невыгодным.
6.10. Диосгенин из другого растительного сырья
На современном этапе основным поставщиком диосгенина является Китай, где это вещество получают из соевых масел. С появлением соевого диосгенина в 1980 году добыча этого вещества из ямса сведена к минимуму и практически не проводится. Использование сои позволило значительно снизить цену прогестерона. Большинство фармакологических компаний, вырабатывающих прогестерон, перешло на использование соевых бобов в течение последних 10 лет. Диосгенин также находят в семенах пажитника сенного или пажитника греческого (Trigonella foenum-graecum), который использовали еще во времена Древнего Египта для стимуляции родов. Об этом растении упоминал Гиппократ, а в Европе его часто применяли для лечения гинекологических заболеваний. По строению диосгенин имеет сходство с холестерином и другими стероидами, что позволило использовать его для получения ряда стероидных гормонов. К другим популярным сапонинам, используемым в фармацевтической индустрии, относят гекогенин, тигогенин и другие. Прогестерон, который получают путем полусинтеза из диосгенина и ряда других сапонинов, является идентичным по строению человеческому прогестерону, вырабатываемому яичниками. Поэтому он может быть усвоен клетками и тканями организма с минимальным препятствием — тело принимает его легче. Также, поступив в организм человека, такой вид прогестерона может использоваться им и для синтеза других гормонов, то есть не всегда использоваться как прогестерон в чистом виде клетками-мишенями. Этого не наблюдается при использовании синтетических прогестеронов. Чаще всего на прилавках можно найти препараты «натурального прогестерона», на этикетках которых указано, что он создан из диосгенина или содержит диосгенин. И многие женщины ошибочно считают, что это один и тот же «высококачественный прогестерон». Но проблемы усугубляются тем, что немало врачей рекомендуют женщинам препараты экстракта дикого ямса, содержащего диосгенин, как якобы натуральный, гомеопатический препарат — альтернативное лечение гинекологических и акушерских проблем. Диосгенин, наносимый на кожу в виде крема, не всасывается, поэтому не оказывает действия на ткани, чувствительные к эстрогену и прогестерону. Ни одно исследование не доказало, что диосгенин может превращаться в прогестерон в организме человека. Это вещество не является биоидентичным для человека. Если рассматривать производство лекарственных препаратов, то 75 % лекарств для лечения инфекционных процессов и 60 % противораковых лекарств, которые имеются на рынке с 1980-х годов, созданы из природного, натурального сырья. Другие группы лекарственных препаратов тоже имеют большое количество медикаментов растительного и животного происхождения. Тем не менее, никто не называет эти препараты «натуральными». Если в состав препарата под названием «натурального прогестерона» входит экстракт соевых бобов или масел ямса, агавы и других растений, такой препарат не содержит прогестерон.6.11. Мифы о биоидентичной гормональной терапии
Так как интерес к заместительной гормональной терапии (ЗГТ) значительно понизился после публикации в начале 2000-х годов данных о серьезных побочных эффектах такой терапии, возник вакуум в сфере медицинского обслуживания климактерических заболеваний из-за отсутствия эффективной и одновременно безопасной альтернативы в лечении. Этот вакуум начал заполняться всевозможными слухами и мифами, а также ложной информацией, которая приносила не меньше вреда, чем гормональная терапия. Так возник миф о безопасности и пользе биоидентичной гормональной терапии, то есть слово «заместительная» было заменено словом «биоидентичная», что многие люди воспринимали как «натуральная». В результате такой словесной игры появилась биоидентичная гормональная терапия (БГТ). Рекламу и поддержку такой терапии начали проводить многие люди, в том числе врачи, а также популярные «элитные звезды». Сьюзан Сомерс, американская актриса, певица, очень деловая женщина, стала активным пропагандистом все той же заместительной гормональной терапии, но уже под названием БГТ. В 2006 году она опубликовала книгу «Без возраста: чистая правда о биоидентичных гормонах» (Ageless: The Naked Truth Аbout Bioidentical Hormones), в которой с уверенностью утверждала, что применение биоидентичных гормонов позволит сохранить изящную фигуру, блестящие волосы, здоровую кожу без морщин, хорошую работу мозга, что оно дает сильную защиту от рака, сердечных приступов и других заболеваний. Автор, не имея медицинского образования, перепутала многие важные аспекты в классификации гормонов, не привела данных ни одного клинического исследования, которые могли бы подтвердить ее высказывания. Книга Сомерс, благодаря связям автора со средствами массовой информации, в том числе телевидением, была искусственно поднята на уровень сенсации, и миллионы американских женщин приобрели ее в надежде получить достоверную информацию о гормональной терапии, тем более что сам автор использовал гормоны годами. В 2009 году Опра Уинфри, известная телеведущая, пригласила Сомерс на шоу, на котором автор рекомендовала применение такой терапии, игнорируя предупреждений врачей о том, что биоидентичные гормоны небезопасны и не являются альтернативой заместительной гормональной терапии. Интересно, что у Сомерс был обнаружен рак молочной железы в 2001 году, а в 2008 году ей удалили матку из-за предраковых изменений эндометрия, а возможно, и рака. Врачи предупреждали Сьюзан, что ее проблемы могут быть связаны с многолетним употреблением гормональной терапии. Согласно одному из интервью, Сомерс каждый день в течение нескольких лет получала инъекции гормонов роста, витамина В, суппозитории эстрогенов, аппликации эстрогенов, 60 таблеток различных БАДов — все это она считала основой молодости и профилактикой старения. Хуже всего, что у Сомерс было немало последователей, среди которых, как было обнаружено позже, начал повышаться уровень заболеваемости раком молочной железы и эндометрия. Но даже из проблемы собственного здоровья Сомерс создала в 2008 году новую «сенсацию» — книгу об альтернативных методах лечения рака, критикуя официнальную медицину. Непонятно, однако, почему в таком случае автор этих книг воспользовался помощью врачей по спасению себя от рака до того, как начал критиковать их. Сьюзан Сомерс — это лишь один пример опасного (в виду отсутствия знаний современной медицины) влияния знаменитости, представителя средств массовой информации на общественность. В мире имеется немало звезд эстрады, кино, спорта, которые пользуются своим положением и начинают давать советы на тему здоровья и медицины. Многие из них поддерживаются финансово рядом компаний, которые заинтересованы в больших продажах своей продукции, в том числе лекарственных препаратов и разного рода БАДов, хотя, как раз информация о финансировании знаменитостей чаще всего скрывается.6.12. Даешь прогестеронизацию женщин всего мира!
На веб-сайтах многих фармакологических компаний, особенно в аннотациях о гормонах, много ложной информации о пользе тех или других гормональных препаратов, которые предлагаются женщинам с целью заместительной гормональной терапии. Но помимо гормональных препаратов, многие компании начали предлагать анализ слюны по определению уровня гормонов, чтобы обосновать необходимость приема «натуральных гормонов». Такие тесты являются коммерческими и стоят от 500 до 700 долларов. Панель тестирования включает определение в слюне уровней эстрона, 17-β-эстрадиола, эстриола, прогестерона, тестостерона, кортизола, дегидроэпиандростерона (ДГЭА), мелатонина, дигидротестостерона и дополнительно дезоксипиридинолина в моче. Кроме того, фармакологи предлагают проводить такое тестирование каждые 2–3 месяца для изучения эффективности дозы применяемых гормонов. Таким образом, реклама и продвижение таких тестов является коммерчески выгодной для фармакологических компаний и тех, кто втянут в продажу «альтернативных» гормональных препаратов. Однако, как показывают результаты исследований, определение уровня гормонов в слюне является очень неточным методом диагностики и эти уровни не соответствуют уровням гормонов в сыворотке крови. Например, в одном из исследований, уровни прогестерона в слюне женщин, применявших чрескожные пластыри с прогестероном, были разными, колебались в широком диапазоне и не соответствовали уровню прогестерона в крови по сравнению с теми, кто не принимал прогестерон. На уровень прогестерона в слюне большое влияние оказывают также определенные виды пищи, травяных добавок и лекарств, приправ. Но что самое интересное, в медицине не существует рекомендаций, как корректировать дозу заместительной гормональной терапии (в том числе биоидентичной гормональной терапии) по уровню гормонов не только в слюне, но даже в сыворотке крови, чтобы заменить недостаточное количество гормонов определенной дозой «натуральных» или синтетических гормонов. Современные рекомендации назначения ЗГТ основаны на наличии симптомов и интенсивности их проявления, а не на одних лабораторных показателях уровней гормонов, в отличие от гормональной терапии заболеваний щитовидной железы, когда доза гормонов корректируется с уровнем тиреотропного гормона и гормонов щитовидной железы. Утверждение, что индивидуально подобранные комбинации эстрогенов и прогестерона имеют преимущества перед стандартными комбинациями гормонов в отношении эффективности и безопасности, является неточным, так как не существует клинически подтвержденных данных в пользу такого утверждения. Начальное определение уровней гормонов при обращении женщины к врачу имеет смысл в большинстве случаев, потому что поможет выявить, какие гормоны могут быть замещены, а какие нет. Но повторные обследования гормонального фона каждые 2–3 месяца, как это рекламируют компании, производящие гормональные препараты, а тем более на фоне приема гормонов, себя абсолютно не оправдывают, потому что суть терапии в избавлении женщины от симптомов или же понижении интенсивности проявления симптомов. И если результат очевиден, значит, лечение является эффективным, и это понятно без всяких определений уровней гормонов. И, наоборот, если эффект не выражен или отсутствует, значит такое лечение женщине, скорее всего, не подходит. Хуже всего, когда заместительная (биоидентичная) гормональная терапия рекомендуется фармацевтическими компаниями всем женщинам после 35 лет якобы для предохранения их от старости.6.13. Различия в названиях прогестерона и его синтетических форм
В публикациях за последнее столетие можно найти несколько разных названий прогестерона и его «заменителей» или веществ с прогестероновым и другими свойствами. В 1930 году немецкий врач-гинеколог Карл Клауберг, профессор университета в Кенигсберге (Калининград), создал классификацию синтетических заменителей прогестерона, введя понятия «прогестины», «прогестагены», «гестагены», и определенную шкалу их биологической активности, изучая изменения в эндометрии кроликов. Позже, во время войны, вплоть до весны 1945 года, пока не был пойман и арестован советскими войсками, этот врач проводил жестокие эксперименты на женщинах — узницах концлагерей, проводя их стерилизацию разными методами, испытывая на них прогестерон, прогестины и другие стероидные препараты. Группу гормонов, которая включает прогестерон и другие гормоны, имеющие свойства прогестерона, называют прогестагенами. Нередко в сокращенном варианте их называют гестагенами. Слово «гестаген» означает «прогестационный агент», то есть связанный с беременностью (гестацией). Эта группа включает натуральный прогестерон, биоидентичные формы прогестерона и синтетические формы прогестерона, хотя в ряде источников прогестагенами называют только синтетические формы прогестерона, что неправильно. Прогестероном называют только тот вид гормона, который вырабатывается яичниками женщин и животных, то есть это физиологический гормон. Тема натурального и биоидентичного прогестерона обсуждена в предыдущих главах. Понятие «прогестин» означает синтетическую форму гормональных препаратов, которые могут быть производными прогестерона, тестостерона и других стероидных веществ. Название «прогестерон» никогда не должно использоваться для характеристики прогестинов.6.14. Понятие «прогестеронового действия»
Очень часто в литературе говорится о «прогестероновом свойстве», «прогестероновом действии» или «прогестероновой активности», когда характеризуются свойства прогестерона и прогестинов. Что это за свойства и как они были определены? Все без исключения прогестагены имеют только одно общее свойство или прогестероновый (прогестагенный) эффект — все они могут воздействовать на эстрогенно-подготовленный эндометрий кролика, блокируя его рост (пролиферацию) и вызывая в нем секреторные изменения. Именно воздействие прогестерона и прогестинов на эндометрий самки кролика было принято за эталон «прогестагенности». Но помимо прогестагенного свойства прогестерон и прогестины обладают разными другими биологическими свойствами при воздействии на клетки и ткани не только у животных, но и у женщин. Так как прогестерон участвует в синтезе всех стероидных гормонов, возникает вопрос: а какими свойствами обладает этот гормон? Наделяет ли такое родство прогестерона с другими гормонами свойствами этих стероидов? Оказывается, прогестерон может иметь как сходные свойства с андрогенами, эстрогенами, глюкокортикоидами и минералокортикоидами, так и противоположное действие. Это зависит от того, с какими рецепторами взаимодействует прогестерон, в каких тканях, в какие метаболиты превращается, а также в какой концентрации находится в крови и тканях. По своему строению прогестерон ближе всего к мужским половым гормонам, поэтому чаще всего он может иметь андрогенное действие. Большинство прогестинов, используемых в медицине, тоже имеют андрогенное действие. Такой эффект наблюдается при высоких дозах прогестерона. Низкие дозы гормона, наоборот, имеют антиандрогенный эффект. В зависимости от дозы прогестерон может также иметь антиэстрогенное, антиглюкокортикоидное и антиминералокортикоидное свойство. Кроме «колоритности» в биологическом воздействии, эффект прогестагенов зависит от пути введения препаратов. Помимо прогестагенов в организме человека имеется немало веществ с действием, похожим на прогестероновое. Эти вещества вырабатываются яичниками, надпочечниками, плацентой и рядом других органов.6.15. Синтетические формы прогестерона
На современном рынке существует большое количество разных форм прогестинов. Часто их классификация представлена в виде классов поколений. Существует четыре поколения прогестинов, но такая классификация не имеет популярности в повседневной практике врачей. Первое поколение прогестинов включает норэтистерон, второе — норгестрел, левоноргестрел, третье — дезогестрел, гестоден, норгестимат и четвертое — дроспиренон. Каждое поколение обладает определенными свойствами, например, третье поколение имеет меньшее влияние на уровень жиров в плазме крови по сравнению с другими классами, также имеет меньшее андрогенное свойство. Четвертое поколение прогестинов характеризуется минералокортикоидным эффектом, похожим на действие спиронолактона (диуретик и конкурент гормонов надпочечников, влияет на водно-солевой обмен). Самым первым прогестином, который был синтезирован до второй мировой войны, был норэтинодрел, производное тестостерона. Это был первый синтетический контрацептив, благодаря которому были созданы оральные (таблетированные) контрацептивы в комбинации с синтетическим эстрогеном — эновид в 1957 году. До 1973 года выработка прогестерона в США контролировалась правительством и составляла всего лишь чуть более 60 кг в год. Но уже с 1975 года на рынке США появилось 13 видов гормональных препаратов, содержащих эстрогены и прогестины, в том числе прогестерон, выработка которого достигла в 1979 году почти 12 тонн в год. Синтетические заменители прогестерона были созданы одновременно с открытием натурального прогестерона, и за эти почти сто лет «эры прогестерона» были синтезированы сотни производных прогестерона и других стероидных гормонов. Далеко не все они нашли применение в практической медицине. Прогестины отличаются по своему строению от прогестерона, и их действие может быть разным. Чаще всего воздействие прогестинов на ткани намного сильнее, чем прогестерона. Современные прогестины являются производными прогестерона и тестостерона, а также других стероидов. Все синтетические прогестероны по строению относятся к стероидным гормонам с 19 или 21 атомами углерода (С). Отличия в строении определяют разное воздействие синтетических прогестеронов на организм женщины. Классификация прогестинов представлена ниже.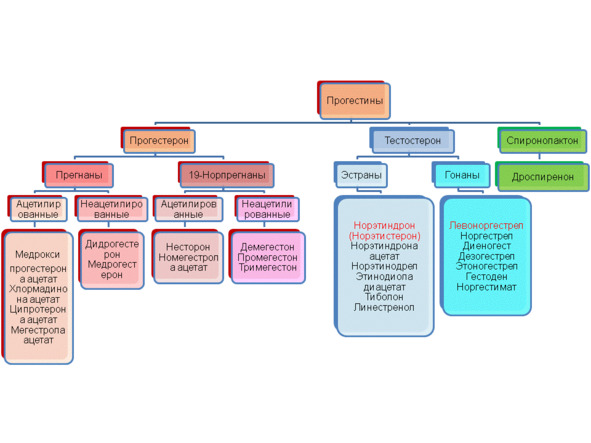
Воздействие прогестинов на клетки и ткани человека происходит за счет их связывания с рецепторами прогестерона, но особенность их в том, что они могут связываться с другими стероидными рецепторами быстрее или больше, поэтому активность и воздействие препаратов будет разными. Итак, одни прогестины могут связываться с прогестероновыми рецепторами, другие — с андрогенными рецепторами, а третьи — с эстрогенными. Помимо этих рецепторов прогестины могут связываться с минералокортикоидными и глюкокортикоидными рецепторами. И в зависимости от вида связи свойства прогестинов могут быть прогестероновыми, эстрогенными, противоэстрогенными, андрогенными, противоандргенными, глюкокортикоидными и антиминералокортикоидными. Также, прогестины могут действовать на гипофиз и подавлять выработку гонадотропинов — оказывать антигонадотропное действие. Такие разные свойства гормонов важно учитывать при выборе прогестина для назначения с лечебной или контрацептивной целью, то есть подбор гормональных препаратов, в том числе гормональных контрацептивов, должен быть всегда индивидуальным.
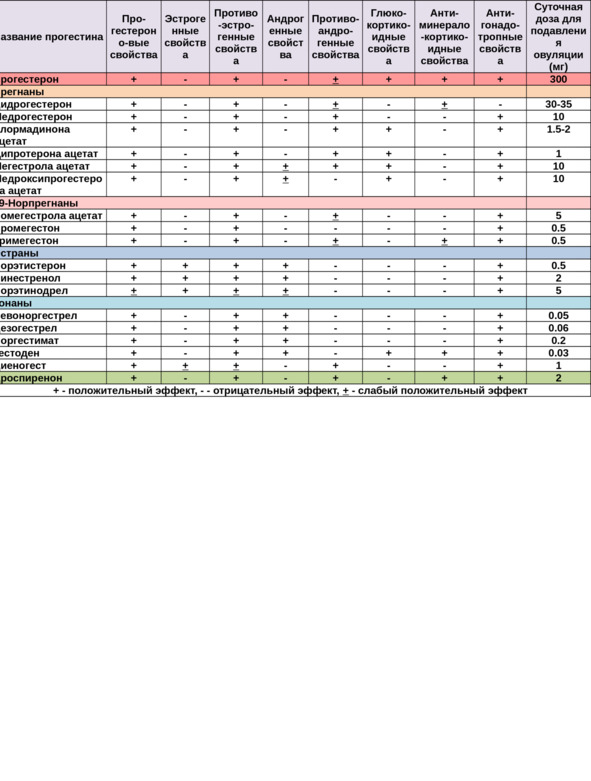
Разные биологические свойства прогестинов могут быть слабыми, выраженными (положительными) или же такие свойства будут отсутствовать (отрицательные). Величина воздействия и проявления эффекта зависит от активности прогестинов по отношению к разным рецепторам. Воздействие прогестерона на прогестероновые рецепторы принято за 100 %, а уже сравнительный анализ воздействия разных прогестинов выражается в цифрах, которые показывают насколько действие других прогестинов сильнее действия прогестерона на эти рецепторы. Например, левоноргестрел в 150 раз сильнее прогестерона по воздействию на прогестероновые рецепторы, 3-кето-дезогестрел — тоже в 150 раз, номегестрол — в 125 раз, промегестон — в 100 раз, гестоден — в 90 раз и т. д. Важно понимать, что эти показатели сравнительной характеристики биологического воздействия прогестерона на рецепторы относительные, потому что определить в лабораторных условиях или непосредственно в организме животных и человека степень воздействия гормонов чрезвычайно сложно. Тем не менее, учитывая эти показатели, можно понять, почему так отличаются дозы гестагенов, используемых с лечебной и контрацептивной целью. Например, если для подавления овуляции суточная доза прогестерона должна быть 300 мг, то суточная доза разных прогестинов, подавляющая овуляцию, будет выражаться в чрезвычайно маленьких количествах препаратов — от 0.03 (в 10 000 раз меньше дозы прогестерона!) до 30–35 мг. Поэтому злоупотребление прогестинами (а иногда врачи ошибочно комбинируют разные прогестагены) может привести к серьезным негативным последствиям. То же самое можно сказать и в отношении воздействия прогестинов на другие стероидные рецепторы. Сила воздействия синтетических гормонов на разные рецепторы определена для многих прогестинов теми же методами — сравнением с воздействием ряда стероидных гормонов — тестостерона, эстрадиола, кортизола и др. От этого воздействия будут также зависеть побочные эффекты гормонов на разные органы и системы органов. Очень мало известно о том, на какие именно рецепторы прогестерона (нуклеарные, мембранные, GAMA и др.) и в какой степени воздействуют прогестины. Одни из современных прогестинов были созданы для селективного воздействия на внутриклеточные рецепторы, несколько других — на мембранные прогестероновые рецепторы. Прогестины никогда не копируют и не заменяют действие прогестерона — у них свое собственное воздействие на женский организм. Практически ничего не известно о том, как воздействуют метаболиты прогестинов на клетки и ткани человека, особенно вне репродуктивной системы. Обычно при испытаниях новых прогестинов учитывается только ограниченное количество кратковременных побочных эффектов, но без детального изучения влияния гормонов на органы вне матки и яичников.
6.16. Прогестерон в косметических продуктах
Казалось бы, прогестерон и прогестины являются гормонами, а поэтому принадлежат к группе лекарственных препаратов, однако у женщин и мужчин, и даже у детей есть потенциальная возможность быть подвергнутыми влиянию этого гормона и его метаболитов через многочисленные «бытовые» источники, а не только лекарственные препараты. В наше время через интернет и в ряде «магазинов здоровья» продается большое количество косметических, гигиенических продуктов, товаров по «омоложению» или «предотвращению старения», всевозможных БАДов и пищевых добавок, которые содержат микронизированный прогестерон. Обычно в рекламе таких товаров убедительно звучат фразы об улучшении сексуального влечения, потенции, подавлении «эстрогенного доминирования», поддержки простаты, улучшения и омоложения кожи. Процентное содержание прогестерона в этих товарах не указывается, как нередко и количественное содержание тоже, поскольку контроля их производства нет в большинстве стран мира. И даже если в одной стране продажа таких товаров может быть запрещена, покупка через интернет «для личного пользования» позволяет их пересылать в любую точку мира.6.17. Содержание прогестерона в пище
Помимо косметической продукции и разных добавок, существует еще один источник стероидных гормонов — пища. Во многих странах мира эстрогены в комбинации с прогестероном или прогестинами добавляются в корм многих сельскохозяйственных животных для быстрого наращивания их веса. Также, используются подкожные гормональные имплантаты при скоростном выращивании сельскохозяйственных животных.В США, в ряде европейских стран существует строгий контроль допустимых уровней стероидных гормонов в продуктах животноводства. Например, для наращивания мяса у коров и быков животным имплантируются 20 мг эстрадиола и 200 мг прогестерона или тестостерона за 61 день до использования их на мясо в виде пищевого продукта. Таким образом, подсчеты показывают, что 157 г говядины (средняя порция, употребляемая одним американцем в день) будут содержать 3.4 нг эстрогена и 19.5 нг прогестерона или 16 нг тестостерона. По другим данным, в мясе животных, при выращивании которых использовались имплантаты прогестерона, концентрация гормона составляет 0.33 мг/ кг.
Прогестерон также может содержаться и в молочнокислых продуктах. Например, в молоке небеременной коровы содержится 9.5–30 нг/мл, в сливках 73 нг/мл, в масле — 133–300 нг/мл и больше гормона. Уровни эстрогенов в пищевых продуктах тоже не ниже. Вспомним, что в сыворотке женщины перед овуляцией концентрация прогестерона составляет меньше 1–2 нг/мл, в середине лютеиновой фазы — от 5 до 20 нг/мл, а у мужчин — меньше 1 нг/мл.
Сторонники «гормонизации» животных утверждают, что такое количество гормонов в продуктах питания по сравнению с количеством гормонов, вырабатываемым человеческим организмом, чрезвычайно ничтожно и эффекта на человека не оказывает. Однако достаточно вспомнить тенденцию роста уровня ожирения среди детей, что часто «списывают» на переедание и малоподвижность, с чем можно согласиться, но частично. Согласиться со сторонниками использования гормонов в сельском хозяйстве все же невозможно, потому что известен факт, что даже у девочек с нормальным ростом тела наблюдается раннее телархе, наступление менархе раньше ровесниц недалекого прошлого, а также ускоренный рост молочных желез и их размеры намного больше, чем у женщин 30–40 лет тому назад. Также за последние 20–30 лет увеличилось количество случаев хирургического уменьшения размеров (редукции) груди у молодых женщин и девушек во многих развитых странах. Известно, что основным гормоном, вызывающим значительный рост молочных желез, является прогестерон. Почему-то при контроле содержания гормонов в продуктах особое внимание уделяют эстрогенам, так как традиционно эти гормоны считаются вреднее прогестерона и тестостерона. На деле же прогестерон ничем не «лучше» эстрогенов и тестостеронов, потому что он является матрицей-гормоном, из которого могут образоваться и первые, и вторые.
6.18. Прогестерон в окружающей среде
Использование стероидов в промышленности, а не только сельском хозяйстве и медицине, привело к тому, что в окружающей среде все чаще находят следы прогестерона: вместе с мочой и калом большого и малого рогатого скота, птицы, выращиваемых по скоростным технологиям, в почву попадает немало гормонов и продуктов их распада. Прогестерон также был найден в одной из рек Флориды, куда выпускались сточные воды бумажного комбината. Эти выбросы гормона оказывают влияние на дикую природу. Более 20 лет тому назад было замечено, что гамбузии, самки небольшой рыбы, питающиеся москитами (а поэтому в 30–40-х годах их широко и весьма успешно использовали в борьбе с малярией в республиках Средней Азии, Кавказа и на юге России и Украины), были маскулизированы (то есть имели определенные мужские признаки). Через несколько лет такие изменения у гамбузий были обнаружены во всех реках Флориды, принимающих отходы целлюлозно-бумажных заводов, а чуть позже и в ряде рек Европы, куда сливались сточные воды предприятий целлюлозно-бумажной промышленности. Анализ речной воды обнаружил высокие уровни прогестерона и андростендиона, а в ряде мест шести других стероидов. Оказалось также, что уровни гормонов и их обмена были повышены больше всего в мозговой ткани и яичниках рыб по сравнению с контрольными группами. Таким образом, связь повышенных уровней прогестерона и андрогенов в речной воде с их негативным влиянием на гамбузии была доказана. Но возник вопрос, откуда берутся эти гормоны, если в производстве бумаги они не используются? После детального изучения многочисленных образцов почвы, в том числе ила, ученые пришли к выводу, что прогестерон образуется из фитостеролов сосны (β-ситостерола, стигмастерола и кампестерола) благодаря активности бактерий почвы — Mycobacterium smegmatis. Эти фитостеролы могут распадаться до андростендиона и других тестостеронов также благодаря участию таких известных почвенных бактерий, как Arthrobacter, Bacillus, Mycobacterium и Nocardia. Но самое интересное, что кишечная палочка Esсherihia coli, живущая в норме в кишечнике человека и выделяющаяся в большом количестве с фекалиями, может превращать холестерин в андростендион и другие стероидные метаболиты. А почему на повышенный уровень прогестерона среагировали гамбузии, а не другие представители флоры флоридских рек? Оказалось, что гамбузии имеют андрогенные рецепторы, которые по строению на 70 % и более идентичны рецепторам человека,а также речной форели и вьюна. Исследования по изучению маскулинизации рыб показали, что биоактивность адростендиона и прогестерона была выше, если они попадали в организм рыб через воду, а не через пищу. Таким образом, жизнь современных людей протекает в условиях гормонального загрязнения внешней среды, в которой они живут, пищи, которую они принимают, и других продуктов, которыми они пользуются каждый день. Все эти дополнительные источники прогестерона, называемые супрафизиологическими дозами, должны учитываться при назначении экзогенного прогестерона, так как суммарный эффект воздействия прогестерона на женщину, и особенно на плод, может быть больше и хуже предполагаемого.7. ПРИМЕНЕНИЕ ЭКЗОГЕННОГО ПРОГЕСТЕРОНА И ПРОГЕСТИНОВ
Когда речь идет о назначении лекарственного препарата, всегда возникает вопрос, какому пути (методу) отдать предпочтение, чтобы усвоение и воздействие гормона было наилучшим. Выбор пути назначения обычно основан на учете анатомических, физиологических и фармакологических факторов. Предпочтение пациента играет незначительную роль, как и практические аспекты назначения препарата. Но очень часто врачи упускают очень важные факторы, которые учитываются фармакологами при изучении степени эффективности лекарства: (1) форма лекарственного препарата (таблетки, капсулы, суппозитории, инъекции, гели, кремы, пластыри и т. д.), (2) уровень растворимости и усвояемости препарата тканями, (3) уровень кровоснабжения, скорость кровотока в ткани (органе). Если первые два пункта понятны, то, казалось бы, какое отношение имеет к лечению состояние кровоснабжения и скорость кровотока? Обычно «входные ворота» лекарственного препарата находятся далеко от органа, на который рассчитано их воздействие (например, ротовая полость при приеме таблеток и матка). Чтобы содержимое таблетки достигло «мишени», оно должно раствориться в слюне и желудочно-кишечных жидкостях, всосаться и быть доставлено через кровь по кровеносным сосудам в измененном или неизмененном виде к тканям, на которые оно имеет воздействие. Чем лучше кровоснабжение, тем большая порция препарата будет доставлена. Чем быстрее обмен крови в тканях, тем быстрее лекарство окажется в зоне воздействия.7.1. Для чего используют прогестерон и прогестины
Во многих предыдущих главах этой книги уже упоминалось о воздействии прогестерона и прогестинов на разные клетки и ткани, свойства этих гормонов, их применение в гинекологии и акушерстве, и в последующих главах имеется более детальное описание использования прогестерона и прогестинов при разных заболеваниях женской репродуктивной системы и других органов. В гинекологии прогестерон и его заменители используются в следующих целях: • контроль роста эндометрия • подавление фертильности (контрацепция) • стимуляция фертильности • профилактика гиперплазии эндометрия при применении эстрогенов • для создания аменореи (искусственной менопаузы) • для создания регулярных кровотечений (искусственных менструаций) • как часть заместительной гормональной терапииВ акушерстве прогестерон не нашел широкого применения. Его используют в репродуктивных технологиях, особенно после ЭКО, как часть поддержки второй фазы цикла, но далеко не во всех случаях. Применение прогестерона для предупреждения преждевременных родов до сих пор является спорным и не поддерживается всеми врачами. Прогестерон и прогестины также начали использовать для лечения ряда заболеваний других органов и систем органов, появление и обострение которых имеют связь с менструальным циклом.
7.2. Способы применения прогестерона
Существуют следующие способы, или пути, назначения и применения (введения) прогестерона: • Оральный, в том числе под язык (сублингвальный) • Чрескожный — в виде кремов, гелей, пластырей • Инъекционный — внутримышечный • Ректальный — в прямую кишку • Влагалищный — в виде суппозиториев • Трансназальный — в носовую полость • Внутриматочный (гормональные системы)Все эти способы имеют свои преимущества и недостатки, однако существует также индивидуальный фактор переносимости препарата и его усвоения женским организмом. Один и тот же вид препарата, назначенный в одинаковой форме, может оказать разный эффект и вызвать разные побочные явления у разных женщин. Первичные пути попадания прогестерона в организм человека — это прием внутрь (оральный), инъекции (парентеральный), в виде имплантатов, кожный контакт и ингаляции. В каждой стране мира в продаже имеются разные виды и формы прогестерона, и на одни виды препаратов могут быть ограничения, другие же могут продаваться без всякого контроля. Большинство прогестинов зарегистрировано как лекарственные вещества, поэтому их продажа и назначение строго контролируется. Например, в США разрешено применение 26 продуктов, содержащих прогестерон как активное вещество.
7.2.1. Оральный прием прогестерона
Таблетированные препараты синтетического прогестерона известны с момента синтеза первых прогестинов, то есть более 80 лет, однако применение они нашли лишь после второй мировой войны с появлением гормональных контрацептивов. Так как прогестинов много, их растворимость и усвояемость в желудочно-кишечном тракте будет зависеть от многих факторов — как от химической формулы препарата, так и от индивидуальных особенностей ЖКТ женщины. В отличие от прогестинов прогестерон в ЖКТ практически не усваивается, что ограничило прием прогестерона оральным путем, в том числе в виде жировых растворов. У прогестерона время полураспада короткое, он выводится из организма женщины очень быстро, не успевая произвести необходимый эффект. Всасывание прогестерона зависит от наполненности желудка и кишечника, от вида пищи, которую женщина принимает до или после приема прогестерона. Все эти нюансы должны учитываться при назначении таблетированных форм прогестерона и его синтетических заменителей. Всасывание экзогенного прогестерона очень быстрое через любые слизистые. Но низкие дозы прогестерона, принятые через рот, моментально разрушаются в ЖКТ и печени практически без воздействия на ткани-мишени. Попав в общее кровяное русло, экзогенный прогестерон теоретически проходит те же пути распада и обмена, что и эндогенный прогестерон. Однако важно понимать, что пропорции метаболитов, их концентрация, а поэтому и воздействие на разные ткани и весь организм могут быть не такими, как при обмене эндогенного прогестерона, который вырабатывается в теле человека. Физиологические процессы в ротовой полости тесно связаны с функцией стероидных гормонов, в том числе половых. Слизистые этой полости и ткани десен могут реагировать на стероидные гормоны через кровяное русло, а также при непосредственном контакте с гормонами, попадающими в рот, где содержатся рецепторы стероидных гормонов (в основном андрогенные рецепторы). Исследования показали, что в слизистом эпителии ротовой полости, особенно слюнных желез, может происходить метаболизм прогестерона, так как слюна содержит ферменты, которые расщепляют стероидные гормоны. В прошлом слюна использовалась для определения уровня прогестерона в лютеиновой фазе, однако такой метод определения гормонального фона женщины оказался неэффективным. Соотношение уровня прогестерона в слюне и свободного прогестерона в сыворотке крови меняется в течение менструального цикла, однако практического применения определение пропорций этих уровней не нашло. Содержимое ротовой полости уникальное и сложное, что создает определенную экосистему, в которой может обитать более 300 видов бактерий. Один миллилитр слюны может содержать около 110 микроорганизмов. Некоторые из этих микроорганизмов, в основном из кишечной группы бактерий, вырабатывают ферменты, участвующие в обмене стероидных гормонов. Как упоминалось выше о роли кишечной палочки в метаболизме прогестерона, в ротовой полости тоже обитают бактерии, способные метаболизировать этот гормон. Исследования показали, что два вида бактерий ротовой полости — Streptococcus mutans (штамм Ingbritt) и Bacillus cereus (штамм Socransky 67) содержат стероидные гидроксилазы — ферменты, расщепляющие стероидные гормоны, в том числе прогестерон. Прогестерон не усваивается в желудке, а процесс всасывания его начинается в тонком кишечнике, где по сосудам портальной венозной сети он попадает в печень. Здесь происходят обменные процессы — метаболизм, и прогестерон очень быстро превращается в другие производные-метаболиты. Фактически печень выполняет барьерную функцию, нейтрализуя действие прогестерона и превращая его в другие вещества. После орального приема 100 мг прогестерона его уровень в плазме крови, как и продуктов распада, повышается в течение первого часа после приема, но затем идет быстрый распад прогестерона и через 4 часа в плазме доминируют продукты метаболизма этого гормона, уровень которых тоже начинает понижаться. Концентрация одних метаболитов держится на высоком уровне в течение 7–11 дней, в то время как других — значительно понижается в считанные часы. Среди всех метаболитов прогестерона уровни диоксикортикостерона, прегнанолона, эстрона и эстрадиола повышаются в крови очень быстро, что может быть причиной появления побочных эффектов. 20-α-Дигидропрогестерон, в отличие от других продуктов распада прогестерона, может быть биологически активным в течение длительного периода времени, так как он образуется чаще всего в органах-мишенях (эндометрии). Но обычно концентрация этого метаболита в тканях повышается не сразу. И это важно принимать во внимание, потому что высокие дозы прогестерона могут иметь негативные последствия после приема через определенный период времени, а не в первые дни приема. Проблема наличия высоких концентраций метаболитов прогестерона состоит в том, что они могут связываться с рецепторами прогестерона и блокировать их, что может не только нарушить процесс воздействия прогестерона на ткани-мишени (в том числе собственного), но и сделать эти ткани нечувствительными к прогестерону на определенный период времени. В целом, это может нарушить менструальный цикл и протекание беременности. Метаболиты также могут связываться с GAMA-рецепторами, контролирующими сокращение мышц, в том числе матки, что может привести к нарушению беременности и ее потере, если доза прогестерона строго не контролируется. Мнение, что чем больше прогестерона принимает женщина для «сохранения беременности», тем лучше, является ошибочным и даже опасным, потому что можно получить противоположный эффект. К счастью, далеко не все метаболиты прогестерона являются гормонально активными, поэтому не все могут оказывать негативное действие на организм женщины. У женщин в климактерическом периоде уровень прогестерона после его приема орально повышается больше и достигает уровня пика лютеиновой фазы обычно через 6 часов после приема. Этот уровень у таких женщин может продержаться до 4 суток. Похожая реакция наблюдается при приеме влагалищных и ректальных форм прогестерона, а также у мужчин, принимавших прогестерон орально. Концентрация 17-ОПК после приема прогестерона повышается незначительно и обычно возвращается в норму в течение суток. Кратковременный прием прогестерона не влияет на концентрацию эстрадиола в крови. 100 мг прогестерона — распространенная минимальная доза, которая часто назначается врачами, приблизительно в 4 раза больше количества прогестерона, вырабатываемого яичниками в середине лютеиновой фазы (в пик выработки прогестерона). Но так как прогестерон очень плохо всасывается из кишечника, изменения уровня этого гормона в плазме у большинства женщин не наблюдается, если доза принятого прогестерона не превышает 250 мг. Лечение при оральном применении гормона требует приема высоких доз и в частом режиме, что приводит к появлению побочных эффектов — головокружению, тошноте, усталости, сонливости. Таблетированные препараты выпускаются чаще всего в дозе 100–200 мг микронизиронованного прогестерона, который создан с целью повышения усвояемости гормона. Комбинация с маслами позволяет лекарственному препарату пройти кислотный барьер желудка быстрее, поэтому доза прогестерона, которая пройдет через кишечную стенку и попадет в кровяное русло, выше. Однако даже в таком виде прогестерон усваивается через кишечник очень плохо. Для повышения всасывания микронизированный прогестерон лучше всего принимать с пищей. С учетом всех факторов, которые могут повысить усвояемость прогестерона, только около 10 % прогестерона усваивается через кишечник. Оральный прогестерон часто применяют после ЭКО для поддержки лютеиновой фазы, особенно у женщин, страдающих ановуляцией. Но как показали исследования, уровень имплантации эмбрионов у женщин, принимавших оральный прогестерон, ниже по сравнению с теми, кому гормон вводился внутримышечно. Интересно, что уровень прогестерона в плазме крови был одинаковым у обеих групп женщин. Оральный прогестерон эффективнее у женщин с синдромом поликистозных яичников для создания кровотечения отмены и подготовки женщины к обследованию (читайте главу «Прогестерон и СПКЯ») Назначение прогестерона под язык (сублингвально) наблюдалось около 20 лет тому назад, в период популярности книг Др. Джона Ли, когда препараты прогестерона рекомендовались всем женщинам с разными диагнозами и когда начала развиваться репродуктивная медицина. Считалось, что всасывание прогестерона через ротовую полость поможет миновать его разрушение в ЖКТ. Но оказалось, что для поддержки соответствующего уровня прогестерона в плазме препараты необходимо принимать несколько раз в день и в высоких дозах. Большинство врачей-репродуктологов отдавало предпочтение внутримышечным инъекциям гормона. Вскоре о сублингвальном применении прогестерона забыли, хотя единичные врачи рекомендуют такой метод применения до сих пор.7.2.2. Чрескожный прием прогестерона
Рекламирование и продвижение прогестерона в виде кремов и гелей началось около 20 лет тому назад и достигло апогея после публикации данных о серьезных побочных эффектах заместительной гормональной терапии в 2002 году, когда миллионы женщин и врачей бросились на поиски альтернативных методов лечения климактерических симптомов, под которыми подразумевались кремы «натурального» прогестерона. То, что многие кремы не содержали прогестерон, это другой вопрос. Казалось бы, нанесение крема или геля является одним из самых удобных методов лечения прогестероном по сравнению с другими. Однако прогестерон очень плохо всасывается через кожу (в отличие от некоторых видов прогестинов, что успешно используется для контрацепции). Уровень всасывания прогестерона разный на разных участках кожи. Самый высокий уровень всасывания наблюдается, если прогестероновый крем накладывать на молочные железы — через 30–120 минут после наложения отмечается рост гормона в крови. В области живота и бедер уровень всасывания невысокий. Даже учитывая то, что прогестерон является жирорастворимым веществом, использование жировых растворов для нанесения на кожу не позволяет достичь повышения уровня прогестерона в крови и поддержании этого уровня. Исследования показали, что для усвоения 25 мг прогестерона (столько прогестерона в среднем вырабатывается яичниками в течение суток), кремом необходимо смазывать половину всех кожных покровов тела женщины. Особенность всасывания прогестерона через кожу в том, что он может накапливаться в коже и оказывать неблагоприятный эффект позже — со временем. Казалось бы, плохое усвоение прогестерона через кожу является если не эффективным для лечения и профилактики ряда состояний и заболеваний, то, по крайней мере, безопасным, а значит, вреда не принесет. Но так ли это? Кожные кремы содержат большое количество разных жирорастворимых веществ, а не чистый прогестерон. Эти вещества, попадая на кожу, тоже всасываются ее разными слоями. Прогестерон, проникая в микрососуды кожи, попадает в общий кровоток и лимфоток. Но большая часть прогестерона может «оседать» в жировых клетках кожи в виде депо. В исследованиях, когда 40 мг прогестеронового крема использовалось женщинами в климактерическом периоде, в возрасте от 40 до 65 лет, уровень прогестерона определяли через разные промежутки времени. Оказалось, что чрезвычайно незначительное количество прогестерона метаболизировалось и потом выделялось с мочой после нанесения крема. Именно на этом были основаны выводы о неэффективности применения прогестеронового крема. Наибольшее количество гормона накапливалось в жировых клетках кожи. Выведение накопившегося прогестерона занимает продолжительный период времени, и уровень метаболитов прогестерона, как показали исследования, намного выше на 127-й день после использования гормона, чем в день его приема. Накопление метаболитов прогестерона может привести к потере волос, мышечной боли, депрессии, что необходимо учитывать при назначении прогестероновых препаратов. Др. Джозеф Меркола, ставший чрезвычайно популярным благодаря информативному веб-сайту, также является сторонником натуральной медицины. В своей практике он использовал крем прогестерона, но, наблюдая за пациентами, он пришел к выводам, что у женщин, применявших крем прогестерона в течение продолжительного времени, возникают осложнения в виде гормонального дисбаланса. Он сравнил свои наблюдения с рекомендациями Др. Джона Ли, который пропагандировал применение крема прогестерона. Др. Ли использовал очень маленькие дозы крема, меньше терапевтических, ¼ чайной ложки 3 %-ного крема. Др. Меркола решил использовать 1/16 чайной ложки 10 %-ного раствора прогестерона и все равно получил побочные эффекты, поэтому в своих публикациях этот врач предупреждает всех о том, что препараты прогестерона, в том числе крем, должны применяться с большой осторожностью. Др. Меркола утверждает, что основное направление в помощи женщинам — это устранение стресса, из-за которого нарушается функция надпочечников. При нормализации работы надпочечников уровень прогестерона нормализуется через 3–6 месяцев без всякого гормонального вмешательства. И залогом этого является создание баланса биоритмов здоровым образом жизни, сбалансированное питание и достаточное количество сна. Эмоциональный стресс, по мнению врача, является основным компонентом, нарушающим гормональный баланс (и давно известно, что стресс — это враг номер один для овуляции). Проверка гормональных уровней должна проводиться несколько раз только после устранения факторов, связанных с образом жизни и мышлением, и результаты сначала должны быть проанализированы для принятия решения о назначении гормональной терапии. В большинстве случаев такая терапия не нужна. Трудно не согласиться с таким рациональным подходом в определении гормонального фона женщин. Здесь необходимо вспомнить о том, что прогестерон, попадая в кровяное русло, связывается с белками. Но многие врачи и ученые считают, что определение уровня прогестерона в крови является не точным методом, отражающим реальную ситуацию усвоения и воздействия гормона на организм женщины. Американские исследователи, изучая в течение двух лет применение крема «натурального» прогестерона женщинами в климактерическом периоде в 24 больницах и крупных лечебных центрах Нью-Йорка, пришли к выводу, что в большинстве опубликованных результатов исследований изменение уровня прогестерона проводилось в сыворотке крови. Для получения сыворотки удаляют клетки крови. Однако прогестерон в крови прикреплен к мембранам клеток, и если эти клетки отделить, то результаты не будут отражать истинный уровень прогестерона. Поэтому для получения точных результатов уровень прогестерона необходимо измерять в цельной крови. Результаты исследований показали, что при использовании крема прогестерона уровень этого гормона в цельной крови был в 5 раз больше терапевтической дозы орального микронизированного прогестерона. Многие врачи считают, что употребление такого крема без контроля врача повышает риск развития сердечно-сосудистых заболеваний, кровоизлияния, тромбоза и рака молочной железы. Такой риск можно объяснить накоплением прогестерона и его метаболитов жировыми клетками, а также переносом экзогенного прогестерона эритроцитами, несмотря на то, что после чрескожного введения прогестерона в сыворотке крови уровень прогестерона повышался незначительно. Хотя приведенные данные могут вызвать противоречивые выводы, применение препаратов прогестерона в виде крема и гелей должно быть строго ограничено.7.2.3. Внутримышечное назначение прогестерона
Несмотря на то, что многие женщины отдали бы предпочтение таблетированным формам прогестерона, внутримышечные инъекции используются в гинекологии чаще всего, так как сокращается время доставки препарата к необходимым органам и свободный (активный) гормон доставляется в большем количестве. Но даже в использовании инъекций есть свои ограничения. Исследования показали, что место инъекции играет важную роль и в скорости полураспада прогестерона, и в количестве, которое попадает в кровь и будет усвоено организмом. Для усвоения прогестерона необходим жир — адипозные клетки. Наибольшее их количество находится в мышцах ягодиц, поэтому внутриягодичные инъекции, или, как их теперь называют, интраглютеальные, являются самыми оптимальными. Некоторые постсоветские врачи назначают инъекции прогестерона в переднюю стенку живота, объясняя такое назначение как раз лучшей усвояемостью прогестерона из-за большого количества жировой ткани на передней стенке живота, особенно над лобком. Живот — это очень опасная зона для введения лекарственных препаратов, потому что ее легко повредить проколом иглы, что может привести к серьезным последствиям (например, перитониту). Кроме того, инъекции в стенку живота очень болезненные. Поэтому такой вид администрации прогестерона (как и большинства других лекарств) не должен практиковаться в медицине. После введения масляного раствора прогестерона внутримышечно (10 мг) максимальная концентрация гормона в крови наблюдается через 8 часов, и медленное его понижение наблюдается в течение 24 часов. При введении больших доз прогестерона концентрация гормона в крови тоже понижается пропорционально. Внутримышечное введение лекарства позволяет прогестерону поступать в кровь постоянно благодаря накопительному эффекту жировой ткани. Хотя оно сопровождается болью, иногда образованием синяков и стерильных абсцессов (без присутствия инфекции), такому методу лечения прогестероном отдают предпочтение, если уровень гормона в крови необходимо поднять быстро и, если курс лечения кратковременный (часто после ЭКО).7.2.4. Ректальное назначение прогестерона
Первоначально обоснование введения прогестерона через прямую кишку объяснялось тем, что она богата кровеносными и лимфатическими сосудами, поэтому всасывание прогестерона лучше, чем в других отделах кишечника. Если лекарственное вещество введено в нижний отдел прямой кишки, оно быстрее попадает к другим органам малого таза, минуя нейтрализацию и метаболизм в печени. И, наоборот, те вещества, которые для усвоения требуют определенных изменений в печени, могут быть доставлены туда быстрее, если введены в верхние отделы прямой кишки. Доказано, что через слизистую оболочку ректальной части кишечника лучше усваиваются неионные и жировые формы лекарственных препаратов. А так как эта область богата венозной сосудистой сеткой (геморроидальные вены), они быстрее попадают к органам репродуктивной системы. Однако всасываемость и усвояемость прогестерона через прямую кишку не была изучена, поэтому назначение прогестерона ректально основывается на гипотезах, а не на подтвержденных фактах. Чаще всего такой способ назначали врачи Европы женщинам в менопаузе как часть заместительной гормональной терапии в комбинации с препаратами эстрогенов. Исследования также показали, что уровень всасывания и усвоения прогестерона при таком пути введения значительно колеблется у разных женщин. Кроме того, повышение концентрации прогестерона в крови происходит медленно, что осложняет подбор терапевтической дозы для лечения симптомов менопаузы или других гинекологических состояний.7.2.5. Влагалищный путь назначения прогестерона
В странах Восточной Европы введение прогестерона в виде влагалищных суппозиториев стало популярным и распространенным среди врачей и женщин. Объяснение целесообразности введения гормона таким путем такое же, как и при ректальном способе: прогестерон в неизмененном виде быстрее попадает в органы-мишени, то есть в матку. Это безболезненный путь приема лекарства, кроме того меньшее количество препарата попадает в печень, где проходит его метаболизм. Но даже у такого метода есть свои недостатки. Во-первых, действие гормона чаще всего проявляется на уровне эндометрия, а не на других уровнях, что не позволяет применять такой метод для лечения многих гинекологических и акушерских проблем, однако может быть эффективным при назначении заместительной гормональной терапии для контроля роста эндометрия. Во-вторых, достичь повышения уровня прогестерона в плазме при влагалищном применении прогестерона невозможно, поэтому влагалищный прогестерон совершенно неэффективен для поддержки лютеиновой фазы, когда важна концентрация гормона в крови, а поэтому его воздействие на яичники, а не только эндометрий. Исследования показали, что уровень успешной имплантации и возникновение беременности значительно ниже у женщин после ЭКО, применявших влагалищный прогестерон, по сравнению с теми, кого поддерживали внутримышечным прогестероном. Мнение о том, что для успешной имплантации необходим только качественный секреторный эндометрий, что можно получить введением прогестерона через влагалище, является ошибочным. Процесс имплантации и прогресса беременности требует синхронного ответа на повышение уровня прогестерона многих других органов и частей матки. Такого синхронного ответа не наблюдается при назначении прогестерона через влагалище. Доказано, что прогестерон, в зависимости от концентрации, может стимулировать имплантацию плодного яйца и, наоборот, может блокировать прикрепление плодного яйца. Природный гормональный баланс на разных уровнях — это ключ к успешному развитию беременности, а вмешательство врачей якобы под видом «сохранения беременности» может закончиться гибелью эмбриона и регрессом беременности. В-третьих, всасывание и усвоения прогестерона таким путем непредсказуемо, нерегулярно, что осложняет подбор и корректировку лечебной дозы. В-четвертых, суппозитории и кремы, которые применяются вагинально, могут вызвать раздражение слизистой влагалища, выделения, дискомфорт.7.2.6. Трансназальный метод назначения прогестерона
Известно, что слизистая носовой полости снабжена большим количеством кровеносных сосудов, поэтому уровень всасываемости ряда лекарственных препаратов в этой части человеческого тела большой. Попытки применения прогестерона в виде назальных спреев были предприняты в конце 90-х годов прошлого столетия. Результаты оказались противоречивыми. Достичь терапевтического уровня прогестерона в крови таким путем применения гормона невозможно. Этот метод введения препарата использовался женщинами в климактерическом периоде. Ингаляции прогестерона происходят часто при его производстве на фармацевтических заводах и фабриках. Исследования показали, что у работников таких заводов наблюдается состояние гиперэстрогении, как у мужчин, так и у женщин.7.2.7. Внутриматочный путь назначения прогестерона
С логической точки зрения, если вводить прогестерон непосредственно в матку, то его влияние на эндометрий может быть самым эффективным. Однако это влияние будет производить контрацептивный эффект, а не наоборот. И как раз прогестерон использовали как контрацептивный гормональный «наполнитель» внутриматочных систем (спиралей). Биоидентичный прогестерон оказался непригодным для этой цели из-за быстрого полураспада, поэтому был заменен синтетическим аналогом. Внутриматочная гормональная система «Мирена» — это комбинация внутриматочного средства и синтетического прогестерона (левоноргестрела). Применение прогестерона внутриматочно строго не рекомендуется женщинам, планирующим беременность, и беременным. Также, такой путь применения прогестерона не улучшает уровня концентрации гормона в плазме крови.7.3. Противопоказания к применению прогестерона
Прогестерон — это гормон, а значит, лекарственное средство. И как лекарство имеет свои показания и противопоказания, а также побочные эффекты. Беременные женщины, планирующие беременность, и те, которые применяют прогестерон и прогестины с разными целями, должны знать, что эти гормоны противопоказаны при ряде заболеваний и состояний: • Сердечно-сосудистые заболевания (гипертония, атеросклероз, заболевания сосудов, связанные с их сужением и закупоркой) • Нарушения свертываемости крови с тенденцией к тромбообразованию (тромбоз вен нижних конечностей, тромбоз легочной артерии, в том числе в прошлом) • Метаболические нарушения (диабет, повышенное содержание жиров в крови, порфирия, ожирение, нарушения водного обмена и др.) • Маточные кровотечения, не связанные с менструальной функцией • Неполный аборт и аборт в ходу • Рак яичников, рак молочной железы • Заболевания печени • Заболевания почек • Психические заболевания (депрессия, повреждение мозга, расстройства психики при ряде заболеваний мозга) • Судороги, в том числе эпилепсия. Церебральная апоплексия • Заболевания глаз (миопия высокой степени, двойное зрение, отек оптического диска) • Системные заболевания (волчанка) • Мигрень • Повышенная чувствительность к прогестерону Важно, чтобы каждая женщина внимательно читала инструкцию по применению прогестерона при принятии решения воспользоваться этим гормоном.7.4. Проблемы с дозировкой прогестерона и подбором прогестинов
До сих пор не существует сравнительных данных в отношении силы воздействия всех существующих прогестинов по сравнению с прогестероном, а также в комбинации с синтетическими эстрогенами, и по отношению к другим стероидным гормонам, хотя сравнительная характеристика ряда прогестинов была приведена в таблице в разделе «Синтетические формы прогестерона». Трудность состоит не только в том, что таких веществ много, но в их разном влиянии на организм женщины. Также не существует стандартных критериев оценки воздействия прогестерона и прогестинов. «Прогестероновое свойство» — это пока что единственный стандарт, по которому определяется принадлежность лекарственного препарата или вещества к группе прогестагенов, даже если это свойство выражено в разной степени. Определение уровня гормонов и их метаболитов в крови или тканях после назначения лечения не оправдывает себя в силу индивидуальной усвояемости этих веществ женщинами. Тем не менее, доза, продолжительность и путь введения гормонов являются самыми важными критериями в подборе лечения. Оценка влияния прогестерона на ткани-мишени у женщин чаще основана на теоретических предположениях, чем на реальных результатах исследований. Это относится и к влиянию прогестинов. Ведь о воздействии гормонов можно говорить только после изучения гистологического строения эндометрия и его изменений. В практике постоянный забор эндометрия себя не зарекомендовал, так как может сопровождаться рядом серьезных осложнений (это инвазивная процедура). Прогестагены назначаются чаще всего для понижения действия эстрогенов, то есть как антиэстрогенное средство. Однако прогестерон является предшественником эстрогенов, поэтому излишки применяемого прогестерона могут производить противоположный эффект — превращаться в эстрадиол, что крайне нежелательно. И хотя небольшие дозы прогестерона не влияют на обмен эстрогенов и их уровни в крови, но в реальности контролировать дозу прогестерона непросто из-за его индивидуальной усвояемости.7.5. Побочные эффекты прогестерона
Побочные эффекты прогестерона — распространенное явление среди женщин, принимающих гормон. Многие постсоветские врачи назначают слишком большие дозы прогестерона своим пациентам, в том числе комбинацию прогестероновых препаратов, выпускаемых под разными названиями. Так как прогестины входят в состав гормональных контрацептивов, побочное действие может определяться комбинацией прогестинов с эстрогенами. Все негативные стороны приема гормональной контрацепции, в том числе прогестерона, зависят от вида, формы, дозы, режима приема препарата и путей введения. Самыми частыми осложнениями приема прогестерона являются кровотечения прорыва, кровянистая мазня, изменения в количестве менструальной крови, аменорея, отеки, изменения в весе женщины, напряжение и болезненность молочных желез, выделения из молочных желез (галакторея), кожная чувствительность и раздражительность в виде зуда, анафилактическая реакция, депрессия, повышение температуры тела, бессонница, тошнота, сонливость. В комбинации с эстрогенами повышается уровень легочной эмболизации и тромбоза сосудов мозга, возникновение тромбоза сетчатки и неврита оптического нерва. Также наблюдается повышение кровяного давления, предменструальный синдром, изменения в либидо, в аппетите, синдром ложного цистита, головная боль, раздражительность, нервозность, слабость, боль в пояснице и спине, гирсутизм, выпадение волос, мультиформная эритема, узловатая эритема, подкожные кровоизлияния, зуд кожи, головокружения. Прогестерон и, в частности, прогестины, особенно в составе гормональных контрацептивов, влияют на усвоение глюкозы и могут привести к состоянию, близкому к диабету. Интересно, что ряд клинических исследований опровергли зависимость между приемом комбинированных гормональных контрацептивов и увеличением веса тела (незначительный повышение все же наблюдается при длительном использовании КОК). Но не так редко можно услышать от женщин, что после приема гормональных контрацептивов наблюдается увеличение веса тела, что можно объяснить нарушением обмена веществ. Назначение прогестинов и прогестерона должно быть серьезно обосновано у женщин с диабетом, гиперлипидемией, гипертонией. Прогестерон может вызвать задержку воды в организме и привести к отечности тканей, поэтому с осторожностью назначается при эпилепсии, мигрени, астме, сердечной и почечной дисфункции. У ряда женщин, страдающих депрессией, назначение прогестерона может серьезно ухудшить состояние. Бессонница — это тоже частый побочный эффект приема прогестерона. Высокие дозы прогестерона могут вызывать боль в связках, суставах, позвоночнике. При беременности под действием прогестерона связки становятся более растяжимыми, позвоночник гибким, суставы подвижнее, что является своеобразной подготовкой женского тела к родам, когда важно формирование родовых путей и расширение таза для прохождения плода. Но у женщин, принимающих прогестерон, могут возникать также боли в суставах, позвоночнике, связочные боли, которые будут ошибочно приняты за другие заболевания. При слишком длительном приеме прогестерона, изменения растяжимости связок, в том числе других соединительно-тканных образований, могут привести к пролапсу митрального клапана в сердце. Назначение прогестерона у женщин в предклимактерическом периоде может маскировать наступление климакса. Важно понимать, что прогестерон является начальным звеном синтеза всех других стероидных гормонов, поэтому его дополнительное введение может кардинально менять обмен андрогенов, эстрогенов, глюкокортикоидов и минералокортикоидов. Прогестерон конкурирует со многими гормонами, понижая усвоение эстрогенов и вызывая состояние гипоэстрогении. Прогестерон конкурирует и с кортизолом. В нормальных пропорциях он подавляет действие кортизола, но при его излишках (что бывает при употреблении прогестерона без показаний) он соединяется с белками, связывающими глюкокортикоиды, и повышает уровень свободного кортизола. Это, в свою очередь, может сопровождаться повышением кровяного давления, повышением уровня глюкозы в крови, нарушением функции щитовидной железы (при беременности функция щитовидной железы часто подавляется), расстройствами со стороны желудочно-кишечного тракта, бессонницей, тревожностью, нарушением защитных сил. При приеме прогестерона и эстроген-прогестиновых препаратов результаты следующих анализов могут отклоняться от нормы: — печеночные функциональные пробы — коагулограмма (повышение протромбиновых факторов VII, VIII, IX и X) — метирапоновый тест (диагностика синдрома Кушинга и недостаточность надпочечников) — функция щитовидной железы (уменьшается трийодтиронин, увеличивается связывание йода с белками) — прегнандиол и метаболиты Вопрос передозировки прогестерона обычно не обсуждается открыто. В прошлом врачами нацистской Германии и милитаристской Японии были проведены тысячи экспериментов над узницами концлагерей по изучению влияния половых гормонов, прогестерона и известных в то время синтетических прогестинов на женский организм и плод. Данные о результатах таких экспериментов остаются недоступными для изучения не только общественностью, но и профессиональными медицинскими кругами до сих пор. Какая безопасная максимальная доза прогестерона? На этот вопрос нет четких ответов. Неизвестно также, может ли передозировка прогестерона привести к смертельному исходу. На эту тему существует немало спекуляций. Эксперименты на животных показали, что смертельная доза прогестерона все же существует. В отношении людей данные противоречивы. В отношении прогестинов картина иная. У многих из них сила воздействия на органы-мишени и женский организм в целом намного больше, чем у прогестерона. Серьезные побочные эффекты зарегистрированы и описаны во многих источниках информации. Смертельные случаи, связанные с применением гормональных контрацептивов, в том числе из-за прогестинового компонента, тоже известны в медицине. Например, врачи серьезно забили тревогу по поводу дроспиренона, который входит в Анжелик, Ясмин (Yasmin, Ярина) и Яз (Yaz), Yasminelle, Beyaz, Ocella, Zarah, так как в Канаде зарегистрировано 24 смертельных случая, в Финляндии — 4 случая. Также имеется ряд смертельных исходов в других странах, не говоря уже о серьезных осложнениях (в основном, тромбоэмболии) после применения этих препаратов. Дроспиренон (прогестин) сам по себе повышает риск тромбообразования на 74 %, а в комбинации с эстрогенами этот риск увеличивается еще больше. Многие схемы лечения рекомендуют применение прогестерона в течение 10–14 дней, другие в течение 21 дня (это фактически контрацептивные схемы), а некоторые все 28 дней в течение продолжительного периода (от 3 до 40 месяцев). Прогестероновый крем часто назначают женщинам в постменопаузе на 3–5 лет. Даже если женщина прекратит его применение, жировая ткань кожи и живота становится своеобразным депо гормона, поэтому продолжает выделять гормон после прекращения его приема. Повышенный уровень прогестерона можно наблюдать в крови таких женщин в течение нескольких месяцев и даже лет. Хотя печень нейтрализует прогестерон постоянно, метаболизируя его до прегнандиола глюкуронида (основной метаболит этого гормона), который выделяется с мочой, однако она может переработать только определенный объем прогестерона в день. Это ограничивает процесс быстрой нейтрализации и удаления прогестерона из организма.7.6. Аутоиммунный прогестероновый дерматит
Аллергическая реакция на прогестерон бывает очень редко. Чаще она бывает на те дополнительные ингредиенты, которые используются вместе с прогестероном (арахисовое, кунжутное, кокосовое масла). Обычно аллергическая реакция проявляется сыпью и зудом кожи. Анафилактический шок из-за аллергической реакции на прогестерон тоже известен в медицине, но встречается не часто. Аутоиммунный прогестероновый дерматит (АПД) является редким заболеванием, которое характеризуется возникновением циклической кожной сыпи во вторую фазу менструального цикла, исчезающей с наступлением месячных. Форма и количество кожных высыпаний могут быть разными — от покраснения, выступающих пятен и бляшек, до мелкой сыпи по типу крапивницы, а также в виде экземы, изъязвлений, пузырьков. Считается, что назначение экзогенного прогестерона может быть начальным звеном (триггером) в возникновении повышенной чувствительности и аллергии к эндогенному (вырабатываемому телом) прогестерону. Аллергическая реакция может также возникать на метаболиты прогестерона. Положительный кожный тест обычно подтверждает наличие повышенной чувствительности к этому гормону. В крови таких женщин находят повышенный уровень антител к прогестерону, что подтверждает аутоиммунную природу заболевания. Лечение аутоиммунного прогестеронового дерматита заключается в назначении тамоксифена и кортикостероидов. Но такое лечение создает кратковременный эффект, поэтому основная цель профилактики и лечения этого вида дерматита — это подавление овуляции и нередко — создание искусственной гормональной менопаузы. В очень редких случаях удаляют яичники.8. ПРОГЕСТЕРОН И ЯИЧНИКИ
Если прогестерон является предшественником половых и других стероидных гормонов, почему же тогда наблюдается такое различие не только в его уровнях, но и в путях использования в мужском и женском организмах?8.2. Половая дифференциация человека
Половая дифференциация и формирование половых признаков у человека, как и у всех млекопитающих, является поэтапным процессом и во многом зависит от успешного завершения каждого из этапов (стадий) при генетическом контроле этого процесса. Половая принадлежность включает в себя хромосомный пол, который определяется набором половых хромосом, гонадный пол, который связан с развитием половых эндокринных органов (гонад — яичек и яичников), содержащих половые клетки (гаметы), и фенотипический пол, который характеризуется развитием внешних и внутренних мужских и женских половых признаков (первичных и вторичных половых признаков). Любая поломка на любом уровне половой дифференциации может закончиться нарушением полового развития, что проявится признаками, частично или полностью не соответствующими хромосомному половому набору человека.8.2.1. Развитие гонад
В развитие первичных гонад, которые являются бипотенциальными (из них могут развиваться как мужские, так и женские половые органы), вовлечены четыре вида клеток — первичные половые и три вида соматических клеток: предшественники клеток Сертоли (эти клетки важны в развитии яичек у мужчин) и зернистых клеток (из них развиваются яичники у женщин), предшественники клеток, вырабатывающих половые гормоны (эти клетки дают начало клеткам Лейдига, вырабатывающим тестостерон, и тека-клеткам яичников, которые тоже вырабатывают тестостерон с его трансформацией в эстроген), и клетки соединительной ткани, из которых образуется каркас внутренних половых органов. У ХХ эмбрионов развитие яичников происходит чуть позже, чем развитие яичек у ХУ эмбрионов, после определенного «выжидательного» периода, очевидно, связанного с отсутствием сигналов от гена SRY (Sex-determining Region Y), которого у женщин нет, как предполагает классическая теория половой дифференциации. Согласно этой теории, развитие яичников происходит как результат автоматического перехода половой дифференциации с мужского типа на женский при отсутствии влияния генов, отвечающих за мужскую половую дифференциацию. Поэтому нередко женскую половую дифференциацию называют пассивным путем дифференциации. Последние данные исследований показывают, что, действительно, развитие яичников всегда сопряжено с моментами «борьбы» за свою дифференциацию из-за подавления её рядом «мужских» генетических факторов: сначала мужское, потом женское. Сторонники «независимости» женской половой дифференциации утверждают, что картина половой дифференциации может быть противоположной: ряд генов «женской» регуляции развития яичников подавляют развитие яичек у ХУ эмбрионов. Строгого научного подтверждения такая гипотеза не имеет.8.2.2. Первичные половые клетки
Первичные половые клетки (гаметы) играют важную роль в половой дифференциации человека. Интересно, что с началом развития эмбриона они возникают за пределами эмбриона (у обоих полов), а потом возвращаются в уже «подготовленные для них места» — в гонады (яички и яичники), пройдя на своем пути определенные этапы деления, и у мужчин снова выводятся наружу. В начале своего развития и простого деления (митотического деления) все первичные половые клетки у мужчин и женщин являются бипотенциальными в отношении пола, то есть могут дать начало и мужским, и женским половым клеткам. Этот процесс (формирования, миграции и входа в эмбрион) не контролируется «мужскими» или «женскими» генами, в том числе генами половых хромосом. А чем же тогда он контролируется? На этот вопрос до сих пор нет ответа. На 12.5-й день после зачатия мальчика (приблизительно 4-я неделя акушерской беременности) в мужских половых клетках включается программа сперматогенеза. В женских половых клетках программа оогенеза (созревание яйцеклеток) включается ровно на один день позже, и эти клетки проходят первый этап полового деления (мейоза). Опять же, исследуя процесс деления и созревания половых клеток, можно заметить доминирование мужского начала в половой дифференциации человека. Важно понимать, что все запасы яйцеклеток, мизерная часть которых пройдет процесс созревания через овуляцию, женщина получает в момент закладки гонад, то есть внутренних половых органов. С момента закладки наблюдается постоянная гибель этих первичных половых клеток, о чем упоминается в другой главе.8.2.3. Появление половых гормонов
Роль половых стероидных гормонов изучена на многочисленных моделях животных, в том числе их роль в развитии половых гонад. Андрогены и эстрогены, введенные в зародыши большинства животных, могут определять развитие яичек и яичников независимо от комбинации половых хромосом. У многих представителей фауны возможно изменение пола на ранних этапах дифференциации клеток под влиянием половых гормонов. Гипотеза о том, что половая детерминация основана на определенной пропорции уровней половых гормонов (андрогенов и эстрогенов) была выдвинута в 1987 году Богартом. Хотя существуют данные о генах (CYP19), которые регулируют появление половых гормонов перед активацией гена SRY и других «мужских» генов, однако их значение для развития яичников не изучено до конца. Также очевидно, что пропорция уровней половых гормонов имеет весьма узкие рамки колебаний и даже незначительный сдвиг уровня одного из гормонов за рамки этих пропорций может кардинально нарушить половую дифференциацию эмбрионов (поэтому применение любых половых и стероидных гормонов на ранних сроках беременности может негативно отразиться на развитии эмбриона).8.2.4. Мужской и женский фенотип
Последним этапом половой детерминации является развитие мужского или женского фенотипа — наружных признаков половой дифференциации. Этот процесс полностью зависит от хромосомной и гонадной половой дифференциации, и поломка на любом из этих уровней приведет к искаженному проявлению фенотипических признаков. Половые гормоны имеют определенное независимое от генов влияние на развитие мужских или женских признаков, потому что дополнительное введение тестостерона или эстрогена позволяет получить эти признаки. Это используется в лечении ряда заболеваний и нарушений развития половой системы у людей, а также в экспериментах на животных при изучении обратимой половой детерминации (sex-reversed determination), когда пол организма можно менять искусственно. Но такое влияние ограничено и может сопровождаться противоположным эффектом при смене пропорции уровней андрогенов и эстрогенов. Наружные и внутренние признаки феминизации (развития женского фенотипа) и маскулинизации (развития мужского фенотипа) контролируются также целой группой генов, размещенных в аутосомных хромосомах. Многие из этих генов участвуют в процессе репродукции человека, поэтому при их поломке или отсутствии женщины и мужчины могут страдать бесплодием. Девочки и мальчики до начала полового созревания внешне отличаются друг от друга лишь наличием разных наружных половых органов. И только в процессе полового созревания, которое активируется в подростковом возрасте, появляются вторичные половые признаки, которые определяют женский и мужской фенотипы. Таким образом, все процессы, происходящие в женском и мужском организме, тесно связаны с половой дифференциацией, которая также определяет пути усвоения стероидных гормонов, в том числе прогестерона, и их воздействия на клетки, ткани и органы, а также на организм в целом.8.3. Прогестерон и женская репродуктивная система
Ошибки в понимании действия прогестерона на репродуктивную систему женщины, а поэтому ошибки в его применении, начались в прошлом веке задолго до его открытия. Вытяжку желтого тела беременных самок животных использовали для создания искусственной менопаузы, что другими словами можно назвать псевдобеременностью. Поэтому сложилось ложное представление, что, если прогестерон вырабатывается беременными самками животных и у людей может создать псевдобеременность, значит это гормон беременности, а поэтому он может «вызвать» и нормальную беременность. Так как прогестерон повышается при беременности значительно, его стали называть гормоном беременности. Однако, как только стало известно, что прогестерон вырабатывается плацентой и что беременная женщина не может повторно забеременеть, на этот гормон начали смотреть как на потенциальный контрацептив. Первые гормональные контрацептивы были синтетическими прогестеронами или прогестинами, к которым позже был добавлен эстроген. Фактически комбинация синтетических эстрогена и прогестерона была известна еще до второй мировой войны (1938 год), но исследования в этом направлении и практическое применение комбинированных гормональных контрацептивов началось только в 60-е годы прошлого столетия. Возник определенный парадокс: как гормон беременности может оказаться отличным контрацептивом? Почему рост прогестерона наблюдается только во второй фазе менструального цикла, что способствует зачатию, и, наоборот, введение дополнительного прогестерона может помешать зачатию? И только в 70–80-х годах с началом развития репродуктивной медицины на прогестерон стали смотреть не просто как на «гормон беременности» или, наоборот, отличный контрацептив, а на вещество, которое имеет уникальные свойства, определяющие его разное воздействие на женский организм. Прогестерон является ключевым гормоном в возникновении овуляции, имплантации и менструации. А значит, его действие проявляется в первую очередь на уровне яичников и эндометрия.8.3.1. Прогестерон и яичники
Яичники имеют уникальное строение и функцию. С одной стороны, яичники являются эндокринными железами (гонадами), вырабатывающими стероидные гормоны, а с другой стороны, это органы репродукции, в которых созревают половые клетки. Оба процесса — выработка гормонов и созревание половых гамет — являются взаимосвязанными и не могут проходить независимо друг от друга. Недостаточность яичников всегда проявляется нарушением выработки гормонов и нарушением созревания яйцеклеток. Основной структурной единицей этих репродуктивных органов женщины является фолликул — пузырек, содержащий половую клетку (ооцит). Нередко после результатов УЗИ женщины расстроены заключением о «фолликулярном строении яичников» и начинают интенсивный поиск лечения для избавления от этой «фолликулярности». Ошибочно некоторые врачи ставят диагноз синдрома поликистозных яичников только на основании наличия многочисленных фолликулов, которые часто называют «кисточками». Фолликулярное строение яичников имеется у всех млекопитающих. Ооциты, окруженные гранулезными (соматическими) клетками находятся в строме яичника. Строма яичника — это своеобразный мягкий каркас, который содержит несколько видов тканей: соединительную ткань, мышечную, а также кровяные сосуды. Сверху яичник покрыт соединительнотканной оболочкой. Фолликул с первичной яйцеклеткой называют также зародышевым пузырьком. Он окружен слоем гранулезных или зернистых клеток, которые играют важную роль в выработке гормонов. Вокруг слоя гранулезных клеток имеется тонкий слой базальной мембраны, а сверху — тека-клетки, появляющиеся только у почти зрелых фолликулов.8.3.2. Два вида клеток — два гонадотропина
Длительный период времени в гинекологии существовала теория «двух клеток, двух гонадотропинов», характеризующая процесс фолликулогенеза и выработки гормонов тека-клетками и гранулезными клетками под влиянием фолликулостимулирующего гормона (ФСГ) и лютеотропного гормона (ЛГ). Эта теория описана в многочисленных публикациях и учебниках по медицине. Согласно этой теории, гранулезные клетки являются основным источником эстрадиола, который образуется путем конверсии андрогенов, вырабатываемых тека-клетками, через процесс ароматизации. Ароматизация зависит от уровня ФСГ, который связывается с рецепторами гранулезных клеток и активирует их. Эта теория поддерживалась также изменениями уровней гормонов — гонадотропинов, эстрадиола и прогестерона в течение цикла. Во многих учебниках эти изменения были описаны неточно, неправильно. Обычно изменения гормонального фона объяснялись (и до сих пор объясняются) так: в первую фазу рост ФСГ стимулирует рост фолликулов и выработку ими эстрогенов, после овуляции рост ЛГ стимулирует выработку желтым телом прогестерона. Таким образом, в фолликулярную фазу доминирует ФСГ и эстроген, в лютеиновую — ЛГ и прогестерон. И почти все врачи направляют женщин на определение ФСГ, ЛГ и эстрогены на 3–8-й день цикла, а на прогестерон и ЛГ (повторно) на 9–21-й день цикла.
Если посмотреть внимательно на графики уровней двух гонадотропинов (ЛГ и ФСГ) и стероидных гормонов (эстрогена и прогестерона) в крови женщины в течение менструального цикла, то видно, что кардинальным моментом во всем цикле является скачок уровней ЛГ и ФСГ перед овуляцией. В графике уровней прогестерона упущен момент кратковременного повышения этого гормона перед овуляцией. Но суть в том, что и уровни ФСГ, и уровни ЛГ едва меняются в течение всего менструального цикла, за исключением предовуляторного периода. Уровни эстрадиола тоже невысокие в начале фолликулярной фазы, а в лютеиновую фазу они даже немного выше показателей первой половины первой фазы. Действительно, для выработки эстрогена необходимо взаимодействие двух видов клеток — тека и гранулезных. Но некоторые ученые обнаружили, что тека-клетки могут вырабатывать не только андрогены, но и эстрогены. Другие ученые утверждают, что тека-клетки чаще всего вырабатывают не эстроген, а прогестерон, из-за нехватки ароматазы — фермента, который принимает участие в превращении андрогенов в эстрогены. При учете стадийности синтеза половых гормонов становится понятным, что теория «двух клеток, двух гонадотропинов» не является точной, потому что в ней прогестерон, вырабатываемый яичниками, представлен как вторичный продукт — гормон, который вырабатывается желтым телом после свершившейся овуляции. В реальности, прогестерон играет куда большую роль и является матричным, то есть первичным, гормоном, «ювелирно вклинивающимся» в функцию всех без исключения клеток яичников и влияющим на эту функцию. В яичниках прогестерон подавляет рост (пролиферацию) гранулезных клеток, что фактически подавляет рост фолликулов, поэтому при беременности на фоне высокого уровня прогестерона рост фолликулов и овуляция не наблюдаются. И это было доказано в экспериментах на животных. Такой эффект наблюдается при микромолярных (10–3 моль/л) и наномолярных (10–6 моль/л) концентрациях прогестерона в крови. Отметим, что наномолярные концентрации стимулируют рост поверхностных эпителиальных клеток яичника, в том числе раковых клеток, в то время как микромолярные концентрации подавляют пролиферацию этих клеток. Таким образом, разные клетки яичника имеют разную чувствительность к прогестерону, как и разную ответную реакцию на его влияние. Удаление яичников приводит к нехватке не только эстрогенов, но и прогестерона, что может повлиять на работу многих органов, в том числе других гормональных желез. Поэтому гормональная заместительная терапия состоит не только из эстрогенов, но и прогестерона. Яичники можно смело назвать царством прогестерона — именно прогестерона, который влияет на функцию всего яичника.
8.4. Прогестерон и менструальный цикл
В древние времена люди не знали устройства яичников, механизмов регуляции овуляции и менструального цикла, но они хорошо понимали цикличность изменений в женском организме по отношению к созданию потомства. Они поклонялись менструальному циклу, воспевая его во многих песнях и посвящая ему ритуалы. Современные аборигены Австралии, Амазонии и ряда других «нецивилизованных» мест планеты до сих пор имеют много ритуальных танцев и песен на «тему менструального цикла», считая его гармонизацией ритма человека с ритмами Космоса и Вселенной. Многие народы поклонялись месяцу, потому что лунный календарь был тесно связан с репродуктивным циклом женщин — чаще всего средняя продолжительность цикла составляет 28 дней. До сих пор срок беременности считают в акушерских месяцах, которые равнозначны лунному месяцу — 28 дням.8.4.1. Менструальный цикл в норме
Современные взгляды на менструальный цикл в норме и его отклонения значительно поменялись благодаря интенсивному развитию репродуктивной медицины. Оказалось, что продолжительность цикла в 28 дней у современных женщин — это скорее миф или отголосок прошлого, чем реальный факт. Нормальными считаются менструальные циклы, продолжительностью в 21–35 дней с колебаниями в 7 дней в обе стороны. Это означает, что менструация может начаться раньше ожидаемого дня или, наоборот, позже. Обычно менструации в 40–42 дня у большинства женщин считаются нормой, если они сопровождаются овуляцией. В течение года нормальным считается наличие не меньше 9 менструальных циклов, за исключением периодов беременности, лактации и применения препаратов, которые могут влиять на овуляцию. Отсчет менструального цикла всегда начинают с первого дня менструации. Менструация — это видимый признак функционирования репродуктивной системы, хотя, как раз в этот период происходит всего лишь отслойка старого, мертвого эндометрия на фоне низких уровней гормонов. Можно с уверенностью сказать, что это самый спокойный в гормональном отношении период жизни женщины репродуктивного возраста, несмотря на то, что в яичниках продолжается рост фолликулов. Но рост фолликулов и овуляцию определить с помощью особых признаков не так просто — это возможно только с помощью УЗИ, а также измеряя уровни гормонов. А кровянистые выделения из влагалища может заметить каждая женщина. Поэтому отсчет дней цикла всегда легче проводить от начала менструального кровотечения. Как определить начало менструального цикла у женщин, имеющих кровянистую мазню перед месячными? Обычно врачи рекомендуют проводить отсчет со дня выраженного менструального кровотечения, не беря во внимание наличие мазни. На помощь может прийти УЗИ, которое позволит проследить за ростом фолликулов и определить день овуляции.8.4.2. Формирование нормального менструального цикла
Нормальный менструальный цикл не возникает на «пустом месте», то есть внезапно, а формируется в течение определенного периода времени. Можно смело сказать, что механизм регуляции менструального цикла имеет видимую сторону — наличие овуляции и менструации, и невидимую сторону — состояние гормональных уровней, даже задолго до появления первой менструации — менархе. Этот механизм начинает формироваться еще в материнской утробе, то есть когда женщина находится в состоянии плода. Именно в этот период наблюдается первая активация гипоталамо-гипофизарно-яичникового комплекса, или системы. Другими словами, девочка-плод чрезвычайно гормонально активна в этот период своей жизни. Но почему-то мало кто из врачей задумывается о том, что введение огромного количества всевозможных препаратов, в том числе гормональных, якобы для «сохранения беременности» или «на всякий случай для профилактики неизвестно чего», может закончиться нарушением формирования этого комплекса, что скажется в будущем на репродуктивной функции женщины. Хотя бы потому, что то, что дается женщине при закладке органов в виде первичных половых клеток, теряется постоянно и не восстанавливается никогда. После рождения девочки активность гипоталамо-гипофизарно-яичниковой системы утихает до новой активации приблизительно в 8–9 лет, за один год до появления телархе — появления уплотнения в области сосков и ареолы и незначительного увеличение молочных желез. В этот период появляются первые пульсации лютеотропного гормона и фолликулостимулирующего гормона. Первая менструация, менархе, возникает обычно через два года после появления телархе — в 12–13 лет. В норме у подростков и молодых женщин продолжительность менструальных циклов составляет 20–45 дней (современные нормы продолжительности менструального цикла), хотя в среднем мы говорим о 21–35 днях. У худых, и особенно высоких женщин, индекс массы тела которых низкий (меньше 19), циклы могут быть овуляторными, но чаще у таких женщин наблюдаются ановуляторные циклы, что является их физиологической нормой, а не нарушением гормонального фона. Если эти циклы регулярные, их общее количество составляет не менее 9 циклов в год, и овуляторных циклов больше, это норма и не требует вмешательства врачей, кроме совета прибавить в весе и достичь идеального (нормального) веса тела. Чем старше женщина (23–30 лет), тем ее циклы регулярнее и продолжительнее, обычно их продолжительность составляет 24–38 дней. В возрасте 30–35 лет наблюдается физиологическое «окно нерегулярности циклов», что может быть связано с тем, что в этот период наблюдаются определенные перестройки организма, и процессы старения незначительно ускоряются. После 37 лет у женщин циклы становятся продолжительнее, могут наблюдаться нерегулярности цикла, так как организм медленно готовится к климактерическому периоду.8.4.3. Менструальные циклы у девочек-подростков
Подростковый период характеризуется выработкой большого количества тестостерона и эстрогенов, нерегулярными менструальными циклами, которые часто ановуляторные, усиленным ростом эндометрия (поэтому гиперплазия эндометрия в подростковом возрасте является нормой), образованием функциональных кист, которые в преимущественном большинстве случаев не требуют лечения. Современные девочки начинают менструировать раньше своих соотечественниц прошлого столетия, что связано с ожирением подростков, и, возможно, загрязненностью окружающей среды, в том числе пищи, стероидными гормонами. И наоборот, девочки с низким весом тела и нехваткой жировой ткани начинают менструировать позже. Жировая ткань очень важна в усвоении половых гормонов, а также в процессах самосохранения индивидуума. Для того чтобы появилась менархе, общий вес жиров в организме должен составлять не меньше 17–19 % (по другим данным — 24 %). Для того чтобы циклы были регулярны, требуется минимум 21–22 % жировой ткани от общего веса. Современное поколение девочек страдает ожирением, поэтому большинство начинает менструировать раньше, чем их матери и бабушки. Индекс массы тела играет очень важную роль в появлении и становлении регулярности месячных циклов. Исследования показали, что менархе начинается у девочек на 6 месяцев раньше, если их вес при рождении был низким, однако прирост веса первые 8 лет жизни был высоким (то есть они набирали вес быстрее). Незрелость гипоталамо-гипофизарно-яичниковой системы регуляции менструального цикла до 21–22 лет в комбинации с низким весом тела (особенно при высоком росте) чаще всего является причиной нерегулярности менструальных циклов. Такое состояние является не «нарушением гормонального фона», а проявлением физиологической реакции женского организма на эти факторы.8.4.4. Фазы менструального цикла
В классическом описании менструального цикла говорится, что существует две фазы менструального цикла: эстрогенная и прогестероновая, которые разделены овуляцией и менструацией.
В современной гинекологии и репродуктивной медицине весь цикл имеет более детальное деление на периоды, когда происходят кардинальные изменения на гормональном и тканевом уровне. Поэтому для понимания процессов, происходящих в женском организме, 28–30-дневный менструальный цикл можно разделить на следующие периоды, или фазы: • ранняя фолликулярная фаза (РФ) — 1–8 дней от начала менструации — в этот период наблюдается постепенный рост уровня эстрогенов, уровень прогестерона остается очень низким, происходит рост фолликулов; • поздняя фолликулярная фаза (ПФ) — 9–13 дни цикла — уровень эстрогенов достигает максимума, что приводит к подъему ФСГ и ЛГ, рост доминирующего фолликула продолжается; • предовуляторный период (ПО) — 14–16 дни цикла — эстроген резко понижается, прогестерон и 17-ОПГ начинают повышаться; • овуляция — быстрый разрыв фолликула и выход зрелой яйцеклетки из яичника; • ранняя лютеиновая фаза (РЛ) — 15–23 дни цикла — быстрое повышение прогестерона и достижение его максимального уровня, незначительное повышение эстрогенов, формирование желтого тела; • поздняя лютеиновая фаза (ПЛ) — 23–30 дни цикла — быстрое понижение уровня прогестерона, понижение уровня эстрогена, повышение уровня 17-ОПГ, угасание функции желтого тела, если не произошло зачатие и имплантация плодного яйца. Прогестерон влияет на протекание предовуляторного периода, ранней лютеиновой фазы и при возникновении беременности участвует в поздней лютеиновой фазе.
8.4.5. Регуляция менструального цикла
Регуляция менструального цикла описана во многих учебниках и публикациях, и основная роль отдается гипоталамо-гипофизарно-яичниковой системе. Но обычно, кода врачи ставят диагноз «нарушение гормонального фона» или, в лучшем случае, более принятый, но такой же туманный диагноз, как «яичниковая дисфункция» (нарушение функции яичников), вся концентрация внимания сосредоточена только на яичниках. О том, насколько важную роль играют в функции яичников части мозга — гипоталамус и гипофиз — часто не упоминается. Почему? Потому что, с одной стороны, подготовка медицинских кадров слабая, а эндокринология женского организма, особенно нейрогуморальная регуляция функции женского организма, вообще едва затрагивается и изучается поверхностно. «Фантастически» звучат обоснования некоторых врачей назначения витаминов Е, С и фолиевой кислоты: для регуляции «взаимоотношений» гипофиза и яичников. С другой стороны, это чрезвычайно сложная комплексная сфера медицины, которая включает симбиоз научных открытий и практической эндокринологии, неврологии и гинекологии. Она требует определенного уровня аналитического мышления, необходимого для того чтобы сопоставить все факты и полученные результаты, увидеть проблему не на уровне яичников, а в комплексе с другими существующими проблемами, в том числе на психологическом уровне. Что собой представляет гипоталамо-гипофизарно-яичниковая система? Это сложный комплекс эндокринных желез мозга и яичников, как эндокринной железы и как репродуктивного органа, во взаимодействие которых вовлечено множество веществ клеточных и тканевых структур. Эта система позволяет понять, что все в женском организме взаимосвязано, поэтому нельзя рассматривать функцию яичников как обособленное явление, а сами яичники как отдельные органы. Нельзя всем подряд женщинам с циклами больше 28–30 дней и планирующим беременность, ставить необоснованные диагнозы «недостаточности лютеиновой фазы» только потому, что уровень прогестерона оказался ниже ожидаемых врачом показателей, а на УЗИ не удалось «поймать» овуляцию. Нельзя ставить диагнозы «нарушения гормонального фона» при идеальных показателях уровней гормонов, но при задержке менструации на 2–3 недели или больше. Нельзя запугивать женщину «запоздалой» овуляцией, если ее физиологические циклы больше 28 дней, и назначать прогестерон для регуляции этой «запоздалости», фактически создавая контрацептивный ановуляторный цикл. Если обращать внимание только на яичники, то как раз важную и уникальную взаимосвязь этих органов со всем другими органами, нервной системой, мозгом, эндокринными железами можно не заметить. Теория регуляции менструального цикла была сформулирована в 1960-х годах, хотя о двуфазности цикла было известно еще задолго до этого. Вся теория была описана очень просто (и такое описание существует во многих учебниках медицины до сих пор): эстрадиол повышается в первую фазу, прогестерон — во вторую, а подъем гонадотропинов — в середине цикла. Подъем гонадотропинов (ФСГ и ЛГ) объяснялся падением уровня эстрадиола и его воздействием на гипофиз через отрицательную обратную связь. Механизм регуляции отношений в гипоталамо-гипофизарно-яичниковой системе основан не только на отрицательной, но и на положительной обратной связи. Отрицательная и положительная обратные связи существуют в регуляции всех гормонов, вырабатываются женским организмом, и между двумя видами связи, как и между гормонами, на выработку которых они влияют, существует определенный баланс.
Отрицательная обратная связь характеризуется действием гормонов на гипофиз и выработку гонадотропинов через взаимодействие с тканями-мишенями. Например, когда яичник вырабатывает эстрадиол, уровень гормона в крови повышается. Одновременно эстроген связывается с рецепторами эндометрия и других органов, оказывая на них таким образом влияние. Когда связь с рецепторами достигает максимума и возникает насыщение тканей гормоном, эти ткани подают сигналы, чтобы подавить лишнее количество гормона. Сигналы поступают в мозг, в частности в гипоталамус и гипофиз, и выработка гонадотропина и ФСГ, стимулирующих выработку эстрадиола, понижается. Одновременно существует положительная обратная реакция. Высокий уровень эстрогена воздействует на гипофиз непосредственно и стимулирует выработку ЛГ, который в свою очередь активирует выработку прогестерона. Таким образом, рост уровня эстрадиола вызывает подавление выработки ФСГ гипофизом (отрицательная обратная связь) и, достигнув определенного уровня, эстрадиол стимулирует выработку ЛГ (положительная обратная связь) и соответственно прогестерона. Воздействие прогестерона на гипофиз и мозговую ткань зависит от образования двух основных его метаболитов — 5-α-дигидропрогестерона и 3-α,5-α-тетрагидропрогестерона (аллопрегнанолон). Они связываются с разными рецепторами, способными улавливать прогестерон.

Эта особенность обмена прогестерона наделяет его уникальными свойствами: прогестерон одновременно может иметь стимулирующее и угнетающее действие, то есть два совершенно противоположных эффекта на ткани-мишени, мозг, эндокринные железы и другие органы, в том числе на гипофиз. Гипоталамо-гипофизарная система вырабатывает гонадотропины, которые в свою очередь регулируются веществами, стимулирующими или подавляющими их выработку. Факторами, которые контролируют выработку гонадотропинов, являются следующие: • Возраст женщины и стадия развития, в том числе полового созревания • Функция яичников и стадия фолликулогенеза • Энергетический баланс и метаболизм (обмен веществ) • Строение тела (вес и рост, их соотношение) • Суточный и годовой (циркадный и циркануальный) ритмы • Стресс и эмоциональная активность • Когнитивная функция (процесс получения, трансформации, анализа и хранения информации из окружения)
Однако в реальности, когда женщина приходит к врачу с жалобами на нерегулярные менструальные циклы и ряд других проблем, все семь групп факторов, кроме функции яичников, во внимание не принимаются, и ставится диагноз «дисфункция». Помимо этих факторов, которые играют роль в регуляции работы репродуктивной системы, важно учитывать и то, что все сигналы из гипоталамуса и гипофиза к яичникам и другим репродуктивным органам и обратно передаются через определенные компоненты нейрогуморальной системы — нейрососудистые клетки, которые участвуют в передаче электрических сигналов и обмене спинномозговой жидкости. При нарушении целостности и функции этих многочисленных путей передачи сигналов нарушается работа яичников и всей репродуктивной системы женщины.
8.5. Прогестерон и созревание половых клеток
Яичники не могут вырабатывать гормоны, по крайней мере, в необходимом для организма женщины количестве, если не происходит созревание половых клеток с ростом фолликулов. С момента зачатия девочки до ее рождения и далее до самого начала полового созревания яичники являются в некоторой степени неактивными органами и в плане выработки гормонов, и в плане созревания половых клеток. Важно понимать, что яйцеклетки не появляются у девочки с началом менструаций. Они не появляются в ходе любого менструального цикла. Яйцеклетки в виде первичных гамет даны женщине еще в ее внутриутробном состоянии, и они никогда не восполняются и не образуются заново. Наоборот, они гибнут, то в ускоренном темпе, то в медленном. Женщина теряет яйцеклетки всю жизнь — с момента внутриутробного развития до глубокой старости. Незнание этих элементарных вещей приводит к необоснованным оперативным вмешательствам при заболеваниях яичников у подростков и молодых женщин с целью удаления фолликулярных и лютеиновых кист, которые в большинстве случаев не требуют такого лечения. Как правило, удаляются не только кисты с частью яичниковой ткани, а нередко и весь яичник. Хуже всего, когда таких вмешательств у одной и той же женщины несколько. Многие женщины не знают, что любое вмешательство в органы репродуктивной системы, особенно яичники и маточные трубы, повышает риск ранней менопаузы или яичниковой недостаточности. Проходит время, такие женщины начинают планировать беременность и первое, с чем они сталкиваются, это нерегулярность менструальных циклов. Традиционный диагноз в таких случаях — «низкий прогестерон», а значит, единственным лечением становится прогестерон (дюфастон, утрожестан) или же «регуляцию» циклов проводят гормональными контрацептивами. А беременности как не было, так и нет. Исследования на животных в 60–70-е годы прошлого столетия обнаружили совершенно новые свойства прогестерона, которые не были известны до этого ни ученым, ни врачам. Если его вводить в начале цикла, то есть задолго до овуляции, он действует как контрацептив и подавляет овуляцию. Если его вводить перед овуляцией, но только в тот период, когда фолликулы достигли определенной зрелости, и в строго дозируемом объёме, он стимулирует овуляцию.8.5.1. Три ключевых периода гибели яйцеклеток
После закладки половых органов на уровне эмбриогенеза, женский организм проходит через феноменальный процесс гибели полученных первичных половых клеток. Почему происходит массовая гибель яйцеклеток, особенно в состоянии плода и после рождения, до сих пор непонятно — теорий и предположений есть несколько. Хотя колебания уровней гормонов играют важную роль в процессе созревания ооцитов, однако примордиальные фолликулы остаются нечувствительными к уровню половых гормонов и даже к уровню гормонов гипофиза. Поэтому механизм ускоренной гибели яйцеклеток не изучен. В процессе потери женских половых клеток есть три ключевых периода, когда эта потеря ускоряется и при этом гибнет очень большое количество яйцеклеток. Первый пик происходит на 20-й неделе беременности, когда из общего резерва в 7–10 млн гамет девочки-плода остается лишь около 2 млн половых клеток. В этот период, пройдя простое деление (митоз), гаметы формируют фолликулы (пузырьки). После первого простого деления яйцеклетки находятся в дремлющем состоянии вплоть до подросткового возраста, хотя их количество постоянно уменьшается с момента рождения девочки, но без скачков ускоренной гибели. Многим пузырькам так и не суждено будет вырасти до больших размеров и воспроизвести зрелую женскую половую клетку. Второй период массовой гибели яйцеклеток связан с рождением девочки. У новорожденной девочки имеется около 1–2 миллионов яйцеклеток — ооцитов. В этот период уровень женских половых гормонов (эстрогенов) в организме ребенка повышен, так как большую часть этих гормонов девочка получает перед родами от матери. Многие фолликулы начинают расти, но так как уровень эстрогенов быстро понижается (материнские гормоны распадаются и выводятся из организма, а у самой девочки уровень собственного эстрогена еще очень низкий), не достигнув полноценного развития, многие из фолликулов перестают расти и регрессируют. Большинство фолликулов погибает в процессе апоптоза (программированной клеточной гибели). Нередко у новорожденной девочки наблюдается невыраженное влагалищное кровотечение, так как внутренняя выстилка матки (эндометрий) тоже отслаивается из-за резкого понижения уровня эстрогенов. Третий период гибели большого количества яйцеклеток происходит в первые годы полового созревания. До этого периода яичники были гормонально неактивными. Начало полового созревания сопровождается процессом созревания ооцитов, который завершается овуляцией. Он также сопровождается динамичными качественными изменениями как в цитоплазме клетки, так и ее ядре. Кардинально меняется качественный и количественный состав фолликулярной жидкости. На момент первой менструации у девочки есть около 400 000 ооцитов. Уровень эстрогенов опять повышается, и это снова приводит к интенсивному росту большого количества фолликулов. Однако большинство из них снова останавливается в росте и регрессирует. Под конец полового созревания в каждом яичнике девушки имеется уже только около 25 000 ооцитов, которые продолжают гибнуть и дальше. Считается, что женщина с регулярным менструальным циклом производит в течение своей жизни около 400 зрелых ооцитов (по некоторым данным 300–500). Это не значит, что она может быть беременна 400 раз, потому что не все ее яйцеклетки полноценны, и нужно также исключить те периоды жизни, когда женщина не имеет открытых половых контактов с мужчиной, беременна или кормит грудью ребенка, а также принимает гормональные контрацептивы. Обычно после 37 лет у большинства женщин начинается период ускоренной гибели яйцеклеток. И вот когда количество яйцеклеток достигает 1000, наступает климакс, что наблюдается ближе к 50 годам.8.5.2. Роль эстрогенов в созревании половых клеток
В росте фолликула участвуют многие органические вещества, но наибольшую роль приписывают эстрадиолу, прогестерону, тестостерону, ряду цитокинов (ингибины, активины, инсулиновый фактор роста 2, несколько других факторов роста), концентрация которых меняется в фолликулярной жидкости в зависимости от дня цикла. Однако только измерение прогестерона и эстрадиола в фолликулярной жидкости нашло практическое применение для определения прогресса зрелости яйцеклетки, чаще всего в экспериментальных целях. Синхронизированный процесс созревания половых клеток в режиме месячного цикла зависит в первую очередь от развития самого фолликула и выработки им эстрадиола. Так как с началом поздней фолликулярной фазы наблюдается значительный рост уровня эстрогенов, предполагали, что именно эстрогены являются стимуляторами появления и активации прогестероновых рецепторов. Исследования, в которых принимали участие разные группы женщин с гипоэстрогенным состоянием (природным во время месячных и в менопаузе или искусственно вызванных), показали, что независимо от того, каким путем вызвано гипоэстрогенное состояние, всегда наблюдалась нехватка ПР-В. Эти данные подтвердили факт, что от качества (в том числе гормонального) первой фазы цикла зависит качество второй фазы цикла. Эстрогены оказывают иммуностимулирующее действие, то есть повышают защитные силы организма. Многие хирурги старого поколения знают, что заживление рубцов, как и гладкий (без осложнений) послеоперационный период, у женщин наблюдается в первой половине цикла. Поэтому раньше врачи старались проводить плановые операции сразу после месячных. Наоборот, тестостерон и прогестерон обладают иммуноподавляющим действием.8.5.3. Фолликулогенез
В процессе полового созревания и репродуктивного периода женщины очень маленькая часть фолликулов начинает свой рост, а еще меньшее количество (всего 300–400 из нескольких миллионов) созреет полностью до момента овуляции с выходом зрелой полноценной яйцеклетки за пределы яичника. В зависимости от стадии развития различают примордиальные, первичные, вторичные и предовуляторные (третичные) фолликулы. Рост и созревание фолликулов называется фолликулогенезом. Фолликулы имеют свою градацию, или степень зрелости: практически все они являются примордиальными с момента своего возникновения. Размеры примордиальных фолликулов составляют 0.03–0.05 мм, поэтому они не видны невооруженным взглядом. Другими словами, даже на УЗИ невозможно увидеть примордиальные фолликулы, поэтому, когда взаключении обследования содержится вывод о том, что с помощью УЗИ определили резерв примордиальных фолликулов, это является ошибкой. Активация примордиальных фолликулов является сложным и контролируемым процессом, и она начинается с полового развития девочки в подростковом возрасте быстрым ростом пузырьков и является необратимым процессом. Если фолликул не стал доминантным, его гибель проходит через атрезию, то есть размеры фолликула уменьшаются, ооцит гибнет. Более 99 % всех фолликулов, полученных при рождении, гибнут через процесс атрезии. Только в последние две недели жизни ооцита происходит его окончательное созревание, которое завершается овуляцией и которое регулируется гормонами — гонадотропинами. Механизм регуляции роста примордиальных фолликулов неизвестен. Когда происходит активация примордиальных фолликулов и они начинают расти, пузырьки становятся растущими и классифицируются на первичные, вторичные, ранние антральные фолликулы. Размеры всех этих фолликулов не превышают 2мм в диаметре. В их росте играет роль фолликулостимулирующий гормон (ФСГ), вырабатываемый гипофизом, однако он не имеет непосредственного прямого влияния на них, поэтому рост проходит медленно. На достижение размеров от первичного до преантрального фолликула уходит больше 4 месяцев, а на достижение размеров 2мм (антральный фолликул) уходит еще 2 месяца. В этот период гранулярные клетки пузырька проходят деление и их количество увеличивается. Это означает, что, если в течение 6 месяцев присутствуют факторы, влияющие на функцию гипоталамо-гипофизарно-яичниковой системы, в любое время процесс созревания яйцеклеток может быть нарушен, что может завершиться ановуляторным циклом и/или аменореей (отсутствием менструации). Обычно около 70 первичных фолликулов начинают рост, вторичного состояния (класс 1) достигают около 60 фолликулов, дальше около 50 становятся ранними антральными фолликулами (класс 2), что происходит в течение последующих 25 дней; около 20 фолликулов в течение 20 дней достигают уровня антральных (класс 3), и только приблизительно 10 из них окажутся чувствительными к ФСГ и начнут свой рост, чтобы в течение 14 дней рост одного из них закончился овуляцией. Все остальные фолликулы проходят процесс гибели через атрезию.
Под влиянием ФСГ антральные фолликулы начинают расти, но только один из них в большинстве случаев природного менструального цикла станет доминирующим (доминантным) и достигнет размеров 2 см, когда обычно происходит овуляция. Появление доминирующего фолликула наблюдается в первой трети фолликулярной фазы, обычно сразу после завершения менструации. Однако такое явление наблюдается у молодых женщин. У женщин более зрелого возраста доминирующий фолликул может появляться и раньше — в конце второй фазы предыдущего цикла (за несколько дней до менструации).

Самые высокие уровни зачатия наблюдаются при размерах зрелого фолликула около 21 мм. Чем больше размеры фолликулов, тем чаще в них наблюдается процесс старения или постлютенизации. В таких фолликулах нарушается пропорция стероидных гормонов и доминирующим гормоном, вырабатываемым гранулезными клетками, становится прогестерон, то есть независимо от того, произошла овуляция или нет, такой фолликул начинает превращаться в желтое тело без разрыва оболочки, что называется процессом лютенизации. В таблице, представленной ниже, приводится сравнительная характеристика размеров фолликулов и периодов их роста у ряда млекопитающих:

Таким образом, у женщин рост и развитие фолликула из преантрального состояния до овуляции занимает самый длительный период и размеры предовуляторного периода больше по сравнению с другими представителями животного мира.
8.5.4. Роль прогестерона в созревании фолликулов
У небеременных женщин в течение суток вырабатывается 2.3–5.4 мг прогестерона в фолликулярную фазу и 22–43 мг в лютеиновую фазу (в разных источниках могут быть разные цифры, но в целом показатели близкие). В первые пять дней менструального цикла (день 1–5-й) уровень прогестерона и эстрогена в организме женщины самый низкий, что позволяет эндометрию успешно отслоиться и удалиться из полости матки. В первую фазу уровень ФСГ и эстрогенов увеличивается, хотя наблюдаются колебания с падениями и поднятиями этих уровней, однако уровень прогестерона остается практически низким до конца фолликулярной фазы. Уровень ФСГ тоже понижается к этому времени, но с 21–22-го дня цикла может наблюдаться его постепенный рост, как и рост новых фолликулов в яичнике. Несмотря на очень низкий уровень прогестерона в крови в фолликулярную фазу, абсолютно противоположное явление наблюдается с уровнем гормона в фолликулах. То, что уровень прогестерона в зреющем фолликуле перед овуляцией выше уровней его в крови, было известно еще в 60-е годы. Др. Зандлер в 1954 году провел измерения уровня прогестерона в крови женщины, фолликулярной жидкости, желтом теле и плаценте и определил, что уровень прогестерона в фолликуле в сотни раз выше, чем уровень гормона в крови беременной женщины во втором и третьем триместре. Но эти данные не были приняты во внимание и о них вспомнили только через 40 лет. Современные исследования показали, что уровень прогестерона в фолликулярной жидкости в 6100 раз больше уровня эстрадиола и в 16 900 раз больше уровня тестостерона. Эти пропорции гормонов не зависят от зрелости фолликула до овуляции. Перед овуляцией, несмотря на чрезвычайно высокие уровни прогестерона в фолликулярной жидкости, существует баланс (корреляция) между эстрогеном и прогестероном. После овуляции уровень фолликулярного эстрадиола становится зависимым от уровня тестостерона, а не прогестерона. Интересно, что уровни фолликулярного прогестерона и тестостерона в фолликулярной жидкости остаются одинаковыми в течение всего цикла — значительно меняется только уровень эстрогена, причем он ниже в больших фолликулах (диаметр 10–15 мм). Не найдена также зависимость между уровнем стероидных гормонов и количеством (объемом) фолликулярной жидкости, как у фолликулов, ооциты которых были оплодотворены впоследствии, и наоборот, если фертилизация не состоялась. Маленькие фолликулы вырабатывают столько же прогестерона, сколько и большие. Эти исследования изменили взгляд на гормональную теорию фолликулогенеза и показали, что основным гормоном, который вырабатывается в процессе созревания фолликула, является прогестерон, который под влиянием гонадотропинов может превращаться в андрогены и эстрадиол. Это подтверждает тот факт, что прогестерон является матрицей стероидных гормонов, поэтому неудивительно, что во время беременности, когда для развития плода необходимы стероидные гормоны, плацента вырабатывает большое количество прогестерона, также трансформирующегося в эстрогены и тестостерон, уровень которых повышен при беременности тоже.8.6. Прогестерон и овуляция
Овуляция играет очень важную роль в жизни женщин, особенно планирующих беременность. Сам по себе прогестерон овуляцию не вызывает и даже тормозит ее, если его уровни выше нормальных физиологических уровней в первой фазе менструального цикла или его вводят дополнительно. Фактически действие контрацептивных препаратов основано на введении прогестерона с первых дней менструального цикла. И поводом к применению прогестерона как контрацептива послужили наблюдения за беременными женщинами: как только женщина беременеет, у нее прекращаются менструальные циклы, и созревание половых клеток подавляется, и на целых девять месяцев женщина входит в состояние физиологической менопаузы или аменореи. Как уже упоминалось выше, в течение всей первой фазы менструального цикла уровень прогестерона в крови женщины очень низкий, но без него овуляция тоже невозможна, и вещества, подавляющие выработку прогестерона, или антагонисты прогестерона могут тормозить и подавлять овуляцию. Отсутствие рецепторов прогестерона в яичниках тоже сопровождается отсутствием овуляции. Как прогестерон может одновременно подавлять овуляцию и стимулировать ее? Эти две противоположные стороны воздействия прогестерона на процесс созревания яйцеклетки требуют объяснения. Существует два экспериментальных доказательства участия прогестерона в возникновении овуляции: (1) введение антипрогестина RU-486 (мифепристона) подавляет овуляцию; (2) у самок мышей при нехватке нуклеарных рецепторов прогестерона овуляция отсутствует даже после индукции овуляции и появления растущих и хорошо развитых фолликулов. Овуляция не зависит от прогестероновых рецепторов В и, наоборот, полностью зависит от наличия ПР-А. Такое селективное значение разных изоформ прогестероновых рецепторов непонятно, однако предполагается, что ПР-А стимулируют выработку особых видов ферментов — металлопротеиназ, необходимых для процесса овуляции. Считается, что повышение уровня 17-α-гидроксипрогестерона в сыворотке крови женщины является первым признаком назревающей овуляции, и этот рост наблюдается за 12 часов до роста ЛГ, по которому обычно определяют предстоящую овуляцию. Существует немало мнений о том, каких размеров должен быть растущий фолликул, чтобы произошел его разрыв. В среднем овулируют фолликулы размерами 2–3 см, однако чаще всего разрыв происходит при размерах фолликула в 2.1–2.5 см.8.6.1. Роль повышения уровня ЛГ перед овуляцией
Феномен повышения уровня ЛГ перед овуляцией стал основой при создании тестов на овуляцию. Но длительное время ни ученые, ни врачи не могли объяснить, почему возникает скачок уровня ЛГ перед овуляцией и какова его роль. Исследования в этом направлении проводились как на животных моделях, так и на людях. Оказалось, что у 20 % женщин начало подъема ЛГ перед овуляцией наблюдается в 4 часа утра, а у остальных 80 % — в 8 часов утра. Такую четкую от времени суток зависимость начала пика ЛГ связывают со временем, когда возникает пик (акрофаза) циркадного (суточного) ритма кортизола. Максимальная концентрация кортизола в плазме достигается к 4 часам утра у женщин с началом роста ЛГ в это время и к 8 часам утра, когда рост ЛГ возникает в 8 утра.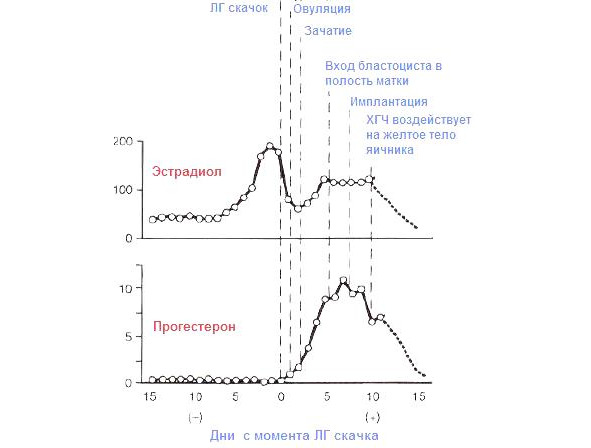
У других овулирующих животных пик ЛГ может наблюдаться в другое время суток, однако он тоже имеет тесную взаимосвязь с циркадным ритмом кортикостероидов. Эстрогены могут вызывать подъем ЛГ, но подъем будет постепенным и длительным, так как уровень эстрогенов тоже повышается без скачков. Считалось также, что низкий уровень прогестерона перед овуляцией приводит к резкому подъему ЛГ. Однако, когда у животных и у женщин после удаления яичников проводили стимуляцию эстрогенами, пика ЛГ не наблюдалось независимо от дозы, хотя уровень ЛГ был повышен без скачков. Именно поэтому у женщин, страдающих синдромом поликистозных яичников, стимуляция гипофиза эстрогенами приводит к постоянному повышению уровня ЛГ. Прогестерон может подавить подъем выработки лютеотропного гормона, но его действие всегда взаимосвязано с уровнем эстрадиола. Поэтому, когда на фоне эстрадиола вводить определенную дозу прогестерона, у самок животных и у женщин наблюдается скачок ЛГ. Оказалось также, что введение эстрадиола на фоне определенной дозы прогестерона самцам крыс, вызывало у них такой же пик гонадотропинов, как и у самок. Это навело на мысль, что для того чтобы перед овуляцией появился пик лютеотропного гормона, важно также перед этим повысить уровень прогестерона. Но до какого уровня и как надолго? Эксперименты показали, что существуют стимулирующая и подавляющая дозы прогестерона, влияющие на ЛГ и овуляцию. Одни уровни прогестерона могут приводить к овуляции, другие — к ее заглушению, о чем уже упоминалось раньше. Предовуляторные фолликулы содержат два вида прогестероновых рецепторов, А и В, появление и активация которых связана с ростом ЛГ перед овуляцией. Также в предовуляторном фолликуле доминируют ПР-А в отличие от ПР-В. Предполагается, что прогестероновые рецепторы модулируют разрыв фолликула под влиянием ЛГ, но не участвуют в лютенизации фолликула. У животных и людей наблюдается четкая зависимость временного фактора между кратковременным повышением уровня прогестерона и пиком ЛГ. Например, у крыс между повышением прогестерона и ЛГ существует промежуток в 14 часов. У женщин, а также у макак резус, такой временной промежуток между повышением уровня прогестерона и началом роста ЛГ составляет 12 часов. Необходимо вспомнить о некой путанице в определении промежутка времени между повышением уровня ЛГ и возникновением овуляции. Во многих публикациях, учебниках по гинекологии и аннотациях тестов на овуляцию можно найти утверждение, что после выброса лютеинизирующего гормона разрыв фолликула наблюдается в течение примерно 24–48 часов. Тесты на овуляцию основаны на реакции реактива на определенную концентрацию ЛГ в моче или других жидкостях организма женщины. Но у каждой женщины величина и скорость повышения/падения гормона индивидуальны. Требуемая концентрация может быть достигнута, например, за двое суток до овуляции, и, наоборот, уровень ЛГ может быть слишком низким для определения его тестом, но достаточным для овуляции. Погрешностей, из-за которых такие коммерческие тесты выдают ложноположительные и ложноотрицательные результаты, много. Важно понимать, что в определении временного промежутка между уровнем ЛГ и овуляцией неточности возникают по двум причинам: (1) за начало отсчета этого периода берут начало повышения уровня ЛГ, (2) за начало отсчета берут пик ЛГ, то есть его максимальные показатели. Публикации ВОЗ (1980) утверждают, что разрыв фолликула возникает через 32 часа после начала роста уровня ЛГ и через 17 часов после достижения пика ЛГ. Исследования показали, что начало роста ЛГ может быть раньше — до 40 часов, или немного позже. Но разрыв фолликула действительно чаще всего возникает через 17 часов после скачка ЛГ. К сожалению, в многочисленных ранних исследованиях упускался момент подъема уровня прогестерона после подъема уровня ЛГ или же это явление оставалось вне всякого объяснения. Интересно, что активация прогестероновых рецепторов наблюдается минимум через 4 часа после подъема уровня ЛГ и достигает максимума через 8 часов после пика гонадотропина. При использовании разных схем лечения бесплодия, в частности стимуляции и индукции овуляции, процесс разрыва фолликула после скачка ЛГ может затягиваться. Живые яйцеклетки были получены через 36 часов после пика ЛГ. Между резким повышением уровня ЛГ и затем прогестерона перед овуляцией существует очень шаткий, кратковременный период, нарушение которого может закончиться ановуляцией — лютеинизированным неразорванным фолликулом. Если подъем уровня прогестерона после скачка ЛГ запаздывает, овуляции не будет. Это связано с тем, что активность ферментов, расщепляющих оболочку яичника в месте роста фолликула, зависит от подъема уровня прогестерона. У некоторых женщин может наблюдаться дефект в выработке этих ферментов, и такие женщины страдают бесплодием. Эксперименты показали, что противовоспалительные средства, в частности нестероидные противовоспалительные препараты (ибупрофен, аспирин), назначенные в предовуляторные дни, вызывают ановуляцию через образование лютеинизирующего фолликула, а также меньшее повышение уровня прогестерона во второй половине цикла. Эти же препараты могут нарушить качество эндометрия и процесс имплантации, если их принимать во второй половине лютеиновой фазы. Помимо подъема уровня ЛГ перед овуляцией наблюдается подъем уровня ФСГ. Роль этого подъема до сих пор неизвестна. Предполагается, что скачок уровня этого гонадотропина важен для разрыва фолликула. Замечено также, что у женщин с короткой лютеиновой фазой подъем уровня ФСГ перед овуляцией незначительный или отсутствует.
8.6.2. Половые отношения и овуляция
В 2001 году в медицинских кругах появилась статья, в которой авторы, американские ученые, утверждали, что уровень спонтанных зачатий после изнасилования выше, чем после обычного коитуса (8 % по сравнению с 3.1 %), что вызвало большой резонанс среди врачей. Во-первых, известно, что стресс значительно понижает овуляцию и шанс зачатия. Но в большинстве публикаций под стрессом понималось длительное воздействие стрессовых факторов (эмоциональных, психологических, физических). Определение «хронического стресса» не приводилось, хотя под ним можно понимать наличие стрессовой ситуации в течение 3 месяцев и дольше. Однако очень многие женщины согласятся с тем, что, когда они были студентками, в периоды экзаменационных сессий у многих из них задерживались или исчезали менструации. Влюбленность, сопровождающаяся переживаниями и «страданиями», еще один частый фактор, из-за которого менструальный цикл девушек и женщин становился нерегулярным. Жесткие диеты в надежде похудеть быстро и намного тоже нередко выключают функцию репродуктивной системы. Таких примеров, где энергетический стресс, возникающий по разным причинам, нарушает овуляцию и меняет паттерн менструальных циклов, можно привести много. И часто воздействие стрессового фактора все же кратковременное. Во-вторых, многие работники правоохранительных органов любой страны согласятся, что часто насильником является постоянный сексуальный партнер женщины (муж, знакомый, друг, любовник), поэтому половые отношения у таких пар все же регулярные. Женщины, особенно в развитых странах, чаще обращаются к врачам с жалобами на беременность в результате изнасилования, и такие жалобы регистрируются. В то же время провести регистрацию и подсчет количества зачатий в результате единичного полового акта у женщин, имеющих редкие или случайные связи без элементов насилия, очень тяжело. Фактически никто не спрашивает беременную женщину при постановке на учет, сколько половых актов было у нее до зачатия ребенка, с одним или несколькими партнерами. Важно отметить, что случайные беременности, возникшие на фоне приема гормональных контрацептивов и внутриматочных средств, были исключены из проведенного статистического анализа. Но такие данные вызвали несколько других вопросов: как на самом деле влияет острый стресс на овуляцию? Повышается ли при остром стрессе шанс зачатия? Как меняются уровни гормонов у таких женщин? Традиционно мы привыкли к классическому описанию менструального цикла, которое приведено выше в других главах, и это описание подразумевает наличие одной овуляции, а значит, возможность забеременеть в день овуляции. А так как яйцеклетка способна к оплодотворению ограниченный период времени (обычно не больше суток), то шанс зачатия ребенка зависит от дня цикла. Однако в реальной жизни наблюдаются далеко не классические менструальные циклы. Большинство врачей уже соглашаются с тем, что в норме циклы бывают от 21 дня до 35 дней с колебаниями в 7 дней в обе стороны. Это значит, что, если вдруг у женщины очередная менструация появилась через две-три недели, такое явление может быть полной физиологической нормой. Мы привыкли говорить, что при наличии прогестероновой недостаточности менструальные циклы короткие, то есть меньше 21–24 дней (о чем читайте в соответствующей главе), но даже на коротких циклах многие женщины все же беременеют. В реальной жизни женщина может забеременеть в любой день цикла — и таких случаев зарегистрировано немало. В реальной жизни женщина может забеременеть без наличия менструальных циклов вообще (и беременности после родов в период лактации, в подростковом возрасте встречаются нередко). В реальной жизни у женщины может быть 2–3 овуляции в цикле (речь не идет об индукции и стимуляции овуляции), и новые скачки гонадотропинов наблюдаются иногда у женщин в течение одного цикла, а УЗИ подтверждает рост фолликулов. Даже во время беременности наблюдаются волны фолликулярного роста, хотя теоретически и практически высокий уровень прогестерона должен подавлять любую овуляцию. Оказывается, у многих животных тоже наблюдается рост фолликулов во время беременности и кормления. Во всем мире зарегистрировано всего 11 случаев суперфекундации (суперзачатия), когда двое детей были зачаты от разных отцов в течение одного менструального цикла с разницей между половыми актами в несколько дней. Но также в реальности рождение двойни, особенно разного пола, встречается довольно часто и теоретический шанс того, что отцами таких двоен могут быть разные мужчины не низкий (1 на 40 случаев). Все эти неклассические (не описанные в учебниках и популярных публикациях) «отклонения от нормы» в отношении зачатия детей вызвали интерес у многих ученых и врачей: а могут ли половые акты провоцировать овуляцию? Изучение моделей животных привело к интересным результатам. Крысы часто используются в исследованиях, так как между многими процессами в их организме и в человеческом организме, как и в поведении, существует немало сходства. Но также имеется и немало различий. Например, овуляция у крыс может быть вызвана не только обычным спонтанным путем, как это происходит у женщин, но и коитусом. У самок крыс нет функционального желтого тела, и для его развития сигналы должны поступать из вульвы, влагалища и от шейки матки, что возможно при совокуплении в брачный период. Именно половая жизнь активирует функцию желтого тела и выработку прогестерона у крыс. Овуляция, вызванная коитусом, наблюдается также у мышей, котов, верблюдов и лам. В главе «Роль повышения уровня ЛГ перед овуляцией» рассказывалось о роли пика ЛГ для овуляции. Известно, что хронический стресс может привести к блокировке, подавлению или задержки роста ЛГ, и такое влияние стресса наблюдается у животных (многочисленные эксперименты это доказали) и у женщин. Однако оказалось, что и у крыс, и у женщин острый стресс приводит к возникновению всплеска уровня ЛГ, вызванного взаимодействием надпочечников и прогестерона. При этом уровень прогестерона, основным источником которого становятся надпочечники (при остром стрессе), повышается до того, как повышается уровень ЛГ. Такое повышение наблюдается на фоне высокого уровня эстрогенов. Исследования показали, что, если женщинам в постменопаузе на фоне эстрогеновой терапии ввести прогестерон, в крови наблюдается рост ФСГ и ЛГ по предовуляторному типу. Введение некоторых глюкокортикоидов и минералокортикоидов (гормонов надпочечников), имеющих сходство с действием прогестерона, беременным крысам или тем, у кого были удалены яичники и проведена эстрогенная терапия, тоже приводит к росту гонадотропинов, как это наблюдается в овуляторных циклах. Многочисленные эксперименты на животных и клинические исследования на женщинах показали, что острый стресс, в том числе вызванный введением веществ, вырабатывающихся при стрессе (гормонов стресса), имеет разное влияние на овуляцию и яичники в зависимости от дня цикла. В середине фолликулярной фазы, в середине и конце лютеиновой фазы наблюдается положительное, стимулирующее влияние, что не исключает возможности еще одной овуляции. Необходимо помнить, что величина доминантного фолликула, в отличие от тех, которые пройдут через фазу атрезии, составляет 10–17 мм (в предовуляционный период его диаметр увеличивается еще больше). Но во вторую фазу цикла в яичниках все еще могут наблюдаться фолликулы размерами в 15 мм и больше, которые начали рост с доминантным фолликулом, но остановились в этом росте. Все эти фолликулы, несмотря на прекращение роста, являются потенциальными пузырьками, способными к овуляции. У 10 % здоровых женщин наблюдается вторая волна роста уровней ФСГ и ЛГ. Три волны роста уровней гонадотропинов в течение цикла, начиная с середины фолликулярной фазы, наблюдаются у 6 % женщин. Повторная овуляция у таких женщин является крайне редким событием, но все же возможна. Таким образом, незапланированный половой акт или коитус в результате изнасилования действительно может иметь связь с дополнительной стимуляцией овуляции, особенно если он происходит в середине первой фазы или второй фазы. Стимулируют ли регулярные половые отношения овуляцию, не сопровождающуюся стрессом? Скорее всего, у людей такое не происходит, в отличие от ряда представителей животного мира. Но все же более полный и точный ответ требует проведения дополнительных исследований.8.6.3. Нарушения овуляции при нормальных менструальных циклах
Среди семейных пар, страдающих бесплодием, имеется около 15 % таких, которым после их полного детального обследования ставят диагноз «бесплодия по неизвестным причинам». Возможно, в половине этих случаев все же есть какие-то упущения в обследовании, врачебные ошибки или погрешности диагностики, потому что, как показывают многие современные публикации по репродуктивной медицине, все же в большинстве случаев такие пары могут иметь детей при правильном выборе тактики лечения и вида репродуктивной технологии. Тем не менее, в группе бесплодных женщин имеются и такие, у которых при почти идеальных результатах обследования (в том числе и мужа) после исключения всех возможных диагнозов на фоне регулярных менструальных циклов беременность не наступает. Более детальный поиск причин бесплодия у таких женщин может выявить нарушения овуляции, которые не отражаются на продолжительности менструального цикла. У женщин, страдающих бесплодием, но имеющих нормальные (регулярные) циклы, может встречаться четыре типа нарушения функции яичников: • Отсутствие растущего фолликула • Нормальный рост и развитие фолликула, но отсутствие скачка уровня ЛГ • Нормальный рост и развитие фолликула, скачок уровня ЛГ, разрыв фолликула, но отсутствие лютеинизации • Нормальный рост и развитие фолликула, скачок уровня ЛГ, лютенизация, но отсутствует разрыв. Все эти виды нарушений овуляции можно обнаружить с помощью УЗИ, если проводить такое исследование часто, фактически через каждые несколько часов (3–8 часов) в период предстоящей овуляции и после нее. Использование Доплер-УЗИ помогает определить циркуляцию крови в доминирующем фолликуле и желтом теле после овуляции. Гистологические трансвагинальные пробы (биопсия) могут помочь в постановке правильного диагноза с подтверждением морфологических изменений в доминантном фолликуле. Классики считают, что у женщин с ановуляцией не может быть регулярных менструальных циклов, и в большинстве случаев так и происходит. Но при регулярном цикле нарушения овуляции тоже могут наблюдаться. При этом с помощью УЗИ можно обнаружить растущий фолликул в первую фазу или желтое тело во вторую фазу и предположить, что полноценная овуляция состоялась, хотя в реальности ее могло не быть, или же она была, но нарушен процесс образования желтого тела. До сих пор нет данных об интрафолликулярной васкуляризации, то есть кровотоке внутри фолликула и колебаниях этого кровотока перед овуляцией, с помощью которого можно прогнозировать разрыв фолликула. Но помимо перечисленных выше нарушений овуляции (даже при нормальном регулярном менструальном цикле) существует одно серьезное препятствие в определении нормальности овуляции: как можно определить, что овуляция завершилась выходом полноценной зрелой яйцеклетки? На современном этапе медицины пока что никак, если, конечно, после этого не возникло зачатие, приведшее к возникновению нормальной беременности. Но врачей, особенно специалистов репродуктивной медицины, интересует вопрос получения живых полноценных яйцеклеток. Определить или предсказать, что рост фолликула и овуляция закончатся выходом созревшей, а к тому же живой и генетически полноценной яйцеклетки пока что невозможно. Сколько овуляторных циклов в норме может закончиться образованием неполноценных или мертвых половых клеток? Этого никто не знает. Если в жизни женщины допускается определенное количество ановуляторных циклов, зависящее от возраста женщины, то сколько «патологических» овуляторных циклов тоже можно считать нормой у здоровой женщины, в том числе у той, у которой были беременности и роды? На этот вопрос современная медицина тоже не имеет четких ответов. Многие женщины слышали о пустом плодном яйце или анэмбрионической беременности, когда в плодном яйце нет эмбриона. Причин такого состояния может быть несколько (нарушение деления оплодотворенной яйцеклетки без формирования эмбриона, гибель эмбриона и его рассасывание). До 40 % ранних потерь беременности связаны с таким дефектом зачатия, и обычно природа отбрасывает такое неполноценное зачатие прерыванием беременности. Важно понимать, что беременность пустым плодным яйцом может возникнуть у совершенно здоровой женщины, и обычно такие случаи при последующих беременностях не повторяются. Если в жизни здоровых женщин могут возникать беременности с пустым плодным яйцом, то вполне логично предположить, что «пустые» овуляции, когда в фолликуле нет половой клетки (в том числе, живой), тоже могут иметь место. Могут быть овуляторные циклы, когда из фолликула выходит перезрелая или незрелая яйцеклетка. Пока что врачи не могут определить качество яйцеклеток в фолликулах, а также на момент их овуляции.8.7. Прогестерон и яичниковый резерв
Длительность репродуктивного периода, когда происходит рост фолликулов, возникает овуляция и возможно зачатие ребенка, зависит от нескольких факторов: яичникового фолликулярного резерва, уровня активации примордиальных фолликулов и уровня деления яйцеклеток. С возрастом не только уменьшается количество половых клеток в яичниках. Существует прямая связь между возрастом женщины и объемом яичников. Яичники — это органы, которые начинают стареть одними из первых. При этом их объем уменьшается постепенно, едва заметно, но большее уменьшение объема яичников наблюдается после 30 лет. Обычно между 30 и 35 годами жизни женщины существует физиологическое окно нерегулярности менструального цикла. Объяснить такое природное явление непросто, но это подтверждает факт начала более интенсивного старения яичников. Очевидно, включаются какие-то внутренние механизмы регуляции репродуктивной функции. Также известно, что в этот период начинается уменьшение выработки гормонов роста, которые оказывают влияние на многие эндокринные железы, в том числе и на яичники.8.7.1. Возраст и фертильность
Еще в недавнем прошлом, около столетия тому назад (что с точки зрения эволюции человека является чрезвычайно крошечным периодом), у женщин наступал климактерический период в 35–37 лет. Известно, что в среднем к 37 годам у женщин наблюдается волна ускоренной гибели яйцеклеток, и фактически с этого момента женский организм готовится к менопаузе. Это несовпадение. Скорее всего, это результат эволюции, определившей оптимальный период размножения для человека, как особого представителя животного мира. Несмотря на то что яичники уменьшаются в размерах после 30 лет, все же до 35–37 лет у женщин есть шанс забеременеть без вмешательства репродуктивных технологий, хотя на зачатие ребенка может уйти немного больше времени, чем у женщин 21–26 лет — в среднем полтора года. Если у женщин в возрасте до 30 лет шанс зачатия ребенка составляет до 20 % в месяц и 75 % в год, у женщин 40 лет этот шанс понижается до 6 % и 40 % соответственно, а в 43 года — 1 % в месяц. Клинические исследования показали, что у 40-летних женщин, которые проходят стимуляцию овуляции или другие виды лечения для улучшения уровня фертильности (фактически лечение возрастного бесплодия), имеется только 25 % шанса возникновения беременности с собственными яйцеклетками, в 43 года — 10 %, а к 44 годам этот показатель достигает 1.6 %. Но даже при возникновении беременности шанс вынашивания очень низкий: в 40 лет теряется 25–30 % беременностей, в 43 года — до 40 %, а в 44 года — до 60 %. Помимо высокого уровня спонтанных абортов, женщину после 40 лет ждет высокий уровень осложнений беременности, чаще всего в виде гипертонии беременных и гестационного диабета. Уровень хромосомных аномалий и пороков развития тоже возрастает драматически. К 40 годам частота синдрома Дауна составляет 1 случай на 100 беременностей, а в 45 лет — 1 на 30. Современные врачи-репродуктологи, которые еще 10 лет тому назад оптимистично уверяли, что ЭКО способно подарить ребенка чуть ли не каждой женщине после 40 лет, начинают говорить правду: если женщина хочет собственного биологического ребенка (из своих яйцеклеток), даже для ЭКО ее возраст не должен быть старше 37–40 лет. Ведь к этому времени полноценных яйцеклеток, которые можно получить для искусственного оплодотворения, практически не остается. Стимуляция яичников для получения яйцеклеток истощает их запасы еще больше.8.7.2. Понятие «яичникового резерва»
До сих пор не существует четкого понятия «яичникового резерва» — какие именно фолликулы входят в этот резерв. Согласно одному утверждению, резерв яичников состоит из примордиальных фолликулов, которые находятся длительный период жизни в состоянии «отдыха». Так как увидеть их с помощью УЗИ невозможно (их размеры меньше 0.05мм), только гистологическое исследование ткани яичника может определить количество примордиальных фолликулов. Но для определения яичникового резерва биопсия яичниковой ткани является нерациональным методом диагностики, так как провести ее не так просто, к тому же любое лапароскопическое вмешательство в репродуктивную систему может закончиться серьезными последствиями (бесплодие, ранняя менопауза и др.). Для определения резерва фолликулов врачи нередко используют метод подсчета антральных фолликулов. Каждый год женщина репродуктивного возраста теряет от 0.35 до 0.95 антральных фолликулов, то есть приблизительно 1–2 фолликула в два года, что можно подсчитать на УЗИ. Однако даже такие подсчеты являются относительными и неточными.8.7.3. Уровень прогестерона и яичниковый резерв
Можно ли по уровню прогестерона определить яичниковый резерв у женщин, страдающих бесплодием? Если измерение проводить без определения уровня других гормонов, такие результаты не будут иметь практического значения. Известно, что у женщин с низким яичниковым резервом наблюдается преждевременный подъем уровня ЛГ в первую фазу перед овуляцией и преждевременный подъем уровня прогестерона. Уровни прогестерона и эстрогена практически не зависят от возраста женщин вплоть до предклимактерического периода и климакса, поэтому не отражают состояния яичникового резерва. Однако если проводить определение прогестерона у женщин после теста с кломифеном цитрата (такой тест проводят у женщин для определения яичникового резерва при бесплодии) на 10-й день цикла, при низком резерве яичников отмечается подъем уровня прогестерона, что приводит к укорочению фолликулярной фазы и низкому уровню фертильности. Чаще всего определение уровня прогестерона в подготовке женщин к ЭКО не имеет практического значения, особенно в определении яичникового резерва, поэтому проводится редко.8.7.4. Антимюллеров гормон
Антимюллеров гормон (АМГ) вырабатывается гранулярными клетками растущих фолликулов. Ежегодно у женщины имеется от 20 до 150 растущих фолликулов размерами 0.05–2мм, но обнаружить их доступными методами диагностики невозможно. Поэтому определяют АМГ, уровень которого зависит от количества антральных фолликулов. До сих пор неизвестно, имеется ли взаимосвязь между уровнем этого гормона и количеством фолликулов размерами меньше 2мм (растущие вторичные и преантральные). Утверждение, что количество антральных фолликулов, или же уровень АМГ, отражают яичниковый резерв, не является точным. С помощью УЗИ можно увидеть и подсчитать фолликулы размером 2–5мм и их количество, взаимосвязанное с уровнем АМГ. Однако половина из этих фолликулов атрезируется, то есть прекратит свой рост. Кроме того, УЗИ не позволяет определить, является ли фолликул растущим или атрезирующим — на УЗИ все они выглядят одинаково. Стимуляция яичников может позволить определить, являются ли видимые фолликулы чувствительными к гонадотропинам (ФСГ) и реагируют ли ростом, т. е. растущие ли это фолликулы, или большинство фолликулов атрезировано. В случаях наличия «умирающих» фолликулов стимуляция будет неэффективной. Являются ли фолликулы, которые выросли под влиянием стимуляции овуляции, морфологически здоровыми, неизвестно, но предполагается, что их качество не отличается от фолликулов, созревших натурально. Можно ли спасти атрезирующие фолликулы от гибели? Считается, что небольшое количество атрезирующих фолликулов (на ранних стадиях) можно спасти стимуляцией гонадотропинами. Атрезия начинается и на уровне преантральных фолликулов (до 2мм), которые чувствительны к гонадотропинам. И, наоборот, антральные фолликулы (больше 2мм), которые видны на УЗИ, могут находиться уже на поздних стадиях атрезии, поэтому быть нечувствительными к стимуляции гонадотропинами. По этой причине использование гонадотропинов с целью «спасения» фолликулов от гибели пока что практического применения в медицине не нашло.8.8. Яичники как эндокринный орган
Выше, в главах, посвященных теме взаимосвязи прогестерона с яичниками и их функцией, эти важные органы рассматривались с точки зрения репродукции человека — процесса размножения. Хотя о выработке прогестерона и других гормонов фолликулами упоминалось не раз, равно как и о значении этих гормонов для созревания половых клеток, однако речь шла об эндогенном (внутреннем) использовании гормонов самими же яичниками. Конечно же, и созревание клеток, и овуляция требуют определенных уровней и пропорции гормонов в крови. Но если рассмотреть очередность всех процессов, происходящих в яичнике, то первая фаза полностью «сконцентрирована» на созревании половой клетки. Гормоны, которые вырабатываются яичниками в этот период, большей частью используются внутри самого яичника, поэтому говорят о паракринной функции этого органа. Во второй фазе в функции яичника доминирует эндокринная активность, то есть выработка гормонов, которые необходимы для имплантации оплодотворенной яйцеклетки и развития беременности. Поэтому большая часть вырабатываемых яичником гормонов поступает в общее кровяное русло женщины и разносится по всему организму, в первую очередь для их использования маткой и молочными железами. В предыдущих главах также не раз упоминалось, что уровень прогестерона в крови в первую фазу очень низкий вплоть до овуляции. Но ошибочным будет полагать, что в этот период цикла вырабатываются только эстрогены. Если внимательно посмотреть на процессы, происходящие в яичниках, то в фолликулярной фазе прогестерон является джином, которого природа удерживает в бутылке — фолликуле, не позволяя ему вырваться на свободу. И только после разрыва фолликула он «обретает свободу» и достигает величия в своем действии на женский организм, особенно на ткани-мишени. Некий мистицизм прогестерона состоит в том, что он играет роль покровителя процесса размножения — от начала жизни и до порождения новой жизни. И складывается впечатление, что прогестерон является неким матричным веществом, выполняющим защитную функцию по отношению к программе саморазмножения и самовоспроизведения, заложенной не только в генном материале каждой клетки, но и в отдельном участке центральной нервной системы (предположительно в лимбической системе мозга). Первичные половые клетки находятся в фолликулах с жидкостью, насыщенной прогестероном, другими стероидами и веществами, причем концентрация этого гормона в тысячи раз выше концентрации вне фолликула. Фактически половая клетка «окутана» этим «прогестероновым рассолом» до тех пор, пока ей не будет суждено выйти за пределы яичника в качестве зрелой яйцеклетки. После разрыва фолликула прогестерон «не оставляет» половую клетку без своей заботы. Он участвует в привлечении сперматозоидов (см. главу «Прогестерон и сперматозоиды»). Пока половая клетка движется по своим «родовым путям» — маточной трубе, в другое пространство — матку, фактически, другой мир, где она может затеряться, умереть, быть убитой под влиянием многих факторов, прогестерон «заботится» не только о том, чтобы яйцеклетка была оплодотворена в этот период второго рождения, но уже рождения в новом состоянии — зачатка новой жизни, была принята «дружелюбно» маткой, подготовленной прогестероном к такому принятию. Теперь уже формирующееся желтое тело начинает распространять увеличивающиеся дозы прогестерона, словно радиостанция, распространяющая радиоволны и сообщающая всему миру, что родилась яйцеклетка, готовая к реализации программы воспроизведения потомства, поэтому все должно быть готово к зарождению новой жизни. А дальше, если зачатие состоялось, плодное яйцо начинает вырабатывать свой прогестерон, и снова в таких высоких концентрациях, при которых женский организм работать бы не смог. Вся эта массивная доза прогестерона снова накапливается и удерживается в плаценте между плацентой и маткой как прогестероновый кокон (к слову, плацента — порождение плодного яйца, а не матки). После 9 месяцев жизни в прогестероновом царстве ребенок, зачатый в маточной трубе, рождается заново через родовые пути — своеобразную трубу из влагалища. Интересно, смерть человека часто описывают как переход в иной мир тоже через «трубу» или «тоннель». Многие люди в состоянии клинической смерти или наркоза испытывают такие видения — передвижение по какому-то тоннелю. То ли это память яйцеклетки, а может память рождающегося ребенка, или же это действительно очередной этап перехода с одного уровня жизни на другой, из одного состояния материи в другую — можнотолько предполагать, фантазировать, догадываться. Но пока что многие тайны жизни остаются недоступными для нашего понимания. Возвращаясь к яичникам, можно сказать однозначно (и об этом упоминалось не раз), что доминирующим гормоном этих органов является прогестерон.9. ПРОГЕСТЕРОН И МАТКА
Можно смело сказать, что матка — это единственный орган, который формирует основное отличие между функцией женщины и мужчины. Женщина создана для вынашивания потомства, поэтому все процессы в ее организме направлены на выполнение этого задания. Для матки, как органа, не важно, кто будет донором мужских половых клеток и от кого женщина забеременеет. Ей также не важно, чей человеческий зародыш она примет, и суррогатное материнство или беременности старших женщин с использованием донорских яйцеклеток и нередко донорских сперматозоидов подтверждают это. Это всего лишь резервуар для вынашивания ребенка, поэтому с точки зрения физиологии ей важно только, чтобы эмбрион был здоровым и способным «прижиться» в матке, прикрепившись к одной из ее стенок. Любое плодное яйцо, будь оно получено естественным путем или искусственно через ЭКО, для организма женщины, а значит и матки, всегда является инородным телом, потому что имеет свой уникальный набор хромосом (кариотип) и генов (генотип). Поэтому, чтобы принять это инородное тело, чужеродные белки, чужеродную генную информацию и позволить эмбриону вырасти до размеров плода, когда он может выжить в окружающей среде, в матке должно произойти множество процессов, позволяющих вынашивание потомства. Матку называют органом-мишенью, если рассматривать ее отношение к половым гормонам и ряду других веществ. Хотя в тканях этого органа вырабатываются определенные вещества, но в целом вся функция матки ограничивается ролью резервуара для плода. Эта функция полностью зависит от функции яичников, потому что именно их ритму подчиняется матка, и все изменения в ней проходят под эгидой созревания половых клеток в яичниках. Ошибочно некоторые женщины и даже врачи думают, что основная функция матки — быть источником менструаций, поэтому у таких людей в понятие регуляции менструальных циклов входит получение регулярных менструаций. Менструация — это всего лишь «кровавые слезы» по несостоявшейся беременности, и ничего более. Не она определяет регулярность циклов. Но более подробно об этом читайте в главе «Прогестерон и менструация». Итак, основная функция матки — это вынашивание беременности, поэтому каждый месяц под влиянием гормонов яичников матка готовится к принятию оплодотворенной яйцеклетки.9.1. Строение матки
Строение матки описано во всех учебниках и очень многих публикациях, посвященных вопросам женского здоровья. Чтобы не повторять одну и ту же информацию, запомним только, что матка состоит из двух частей — тела и шейки матки, причем отношение длины тела к длине шейки матки у подростков и нерожавших женщин больше, хотя размеры меньше, по сравнению с женщинами, у которых были беременности и роды. Матка имеет три слоя: внутренний — эндометрий, и о нем пойдет речь дальше; средний — миометрий, или мышечный слой, который сокращается, а поэтому принимает участие в эвакуации мертвого эндометрия во время месячных, ребенка во время родов, плодных яиц во время выкидыша. Сокращения миометрия участвуют также в процессе оплодотворения, помогая сперме перемещаться через полость матки в маточные трубы. Наружный слой является серозной оболочкой матки, выполняющей защитную функцию. Хотя матка есть у всех млекопитающих и играет важную роль в продолжении рода и вынашивании потомства, однако только у людей и некоторых приматов определенная часть эндометрия (две трети, или функциональный слой) удаляется, если оплодотворение не состоялось, что проявляется менструацией. Поэтому важно понимать, что эндометрий — это динамическая ткань, в которой постоянно происходят кардинальные изменения, порой противоположные в зависимости от фазы менструального цикла. Весь этот процесс изменений проявляется в росте эндометрия (пролиферации), изменении его качества (дифференциации) и его отслойки (линьки). Эндометрий состоит из двух слоев — функционального, который отслаивается при каждой менструации, и базального, из которого происходит рост нового функционального слоя. При проведении аборта (чистки) удаляется функциональный слой эндометрия, однако нередко может повреждаться базальный слой, что приводит к возникновению спаек (синехий), а в худшем случае — к синдрому Ашермана, проявляющемуся скудными менструациями или их отсутствием, а также бесплодием. Иногда врачебное вмешательство в полость матки при проведении аборта (как по показаниям, так и по желанию женщины) может закончиться серьезной травматизацией базального слоя эндометрия, что чаще всего приведет к бесплодию (от 3 до 5 % женщин после аборта становятся бесплодными, хотя защитники абортов утверждают, что между абортом и бесплодием связи нет). Первая треть лютеиновой фазы и изменения в эндометрии регулируются эстрогеном и прогестероном. Середина лютеиновой фазы регулируется прогестероном. Поздняя лютеиновая фаза не регулируется ни эстрогенами, ни прогестероном, так как уровень этих гормонов очень низкий, и менструация является результатом отмены прогестерона. Рост эндометрия и изменения в нем регулируются эндометриоидными генами — одни играют роль в первой половине цикла, другие — во второй. Активация и инактивация генов очень важна для нормальной функции эндометрия. У женщин, страдающих эндометриозом, нарушен переход генов из активного состояния в неактивный и наоборот под влиянием гормональных изменений в организме. Эндометрий имеет не только сложную структуру, но и уникальное кровоснабжение за счет образования сосудов особого вида — спиральных артериол. Эти сосуды размещены в верхних двух третях функционального слоя эндометрия. Они играют важную роль в насыщении эндометрия лейкоцитами и сокращении во время менструации для уменьшения кровопотери.9.1.1. Изучение эндометрия на животных моделях
Детальное изучение изменений человеческого эндометрия проводилось благодаря методу ксенотрансплантации, когда клетки эндометрия женщин подсаживались в матку иммуноподавленных мышей. Но нередко такой эндометрий «растворялся» в чужеродной среде, которой являлся эндометрий мышей. Поэтому чуть позже эндометрий начали подсаживать под оболочку почек животных с использованием гормонального прикрытия эстрогенами с прогестероном или без него. Таким способом удавалось получать (фактически выращивать) эндометрий, который ничем не отличался от эндометрия женщин, что позволило детально изучить многие аспекты изменений этой ткани перед менструацией и в период ее. Недостатком таких моделей было отсутствие или нехватка лейкоцитов, которые играют важную роль в жизни женщин. Еще один недостаток состоял в том, что процесс децидуализации эндометрия у мышей наблюдался считанные часы, тогда как у женщин он занимает несколько дней (о роли лейкоцитов для репродуктивной системы и децидуализации читайте дальше). Практически все эти животные модели позволяют изучить менструальный цикл и изменения эндометрия под влиянием разных веществ, в первую очередь стероидных гормонов, которые вводились в организм животных или непосредственно в эндометрий.9.1.2. Исследования эндометрия у женщин
Исследование эндометрия у женщин перед менструацией и в период менструального кровотечения проводилось и проводится с разными целями, но редко с экспериментальной. Фактически такие исследования являются «отпечатком» определенного момента в жизни женщины — в конкретный день, но не отражают весь процесс изменений в динамике. В то же время ткань человеческого эндометрия, полученного в разные дни менструального цикла, применяется очень широко учеными и врачами для экспериментов и научных опытов. Для понимания механизма менструации чаще всего используется эндометрий, полученный в середине второй фазы менструального цикла и непосредственно перед менструацией. В отличие от клеток железистого эпителия клетки стромы эндометрия применяются в исследованиях реже по той причине, что состав стромы кардинально меняется в течение всего менструального цикла.9.1.3. Датировка эндометрия
Ученые изучили строение эндометрия «вдоль и поперек», стараясь составить атласы суточного изменения эндометрия на клеточном и биохимическом уровнях. И, казалось бы, при наличии такого детального описания строения эндометрия наконец-то можно отличить норму от патологии, особенно у женщин, страдающих бесплодием, расстройствами менструального цикла и другими заболеваниями. Но обнаружилось, что датировка эндометрия по образцам тканей, то есть определение дня менструального цикла и сравнение с нормой, является чрезвычайно трудным и совершенно непрактичным методом диагностики. Такие трудности связаны в первую очередь с тем, что изменения в эндометрии не являются скачкообразным процессом, а медленным переходом разных участков эндометрия из одного состояния в другое. Также, этот процесс индивидуален не только у разных женщин, но и в разных менструальных циклах. То, что можно назвать отклонением от условного стандарта, может быть нормой для конкретной женщины и не вызывать у нее никаких жалоб, в том числе бесплодия или кровотечения. Конечно, речь не идет о патологическом состоянии эндометрия, а лишь о разнообразии нормального развития эндометрия в зависимости от фазы менструального цикла. До сих пор нет четко согласованного мнения врачей о том, какую следует выбрать точку отсчета оценки эндометрия — овуляцию, первый день менструации, последний день менструации и т. д. Хотя между яичниковым и маточным циклом есть четкая синхронизация процессов, однако у ряда женщин эта синхронизация может быть смещена в сторону раннего или позднего созревания эндометрия относительно дня овуляции, что является индивидуальной физиологической нормой таких женщин и обычно их репродуктивная функция не нарушается. Условно за норму принято два дня отклонений в гистологической картине эндометрия по сравнению с «классическими стандартами». Но чтобы сделать вывод о том, действительно ли есть отклонения в изменениях в эндометрии, важно знать точный день менструального цикла. Хотя традиционно первым днем цикла принято считать первый день маточного кровотечения, но у многих женщин менструация не начинается выраженными кровянистыми выделениями, а может проявляться в виде кровянистой мазни, что далеко не патология для большинства из них. Оптимальным и точным днем начала менструального цикла можно было бы считать день овуляции, однако овуляция незаметна, то есть редко сопровождается видимыми признаками, на которые бы женщина обратила внимание. Имеются данные, что люди в далеком прошлом, а также аборигены из племен, живущих примитивной жизнью в условиях дикой природы, могут распознать овуляцию намного лучше людей, живущих в условиях урбанизации. Тем не менее, овуляцию можно определить разными лабораторными и диагностическими методами, но все они требуют финансовых затрат. Начало менструации может обнаружить сама женщина без всяких вспомогательных методов — достаточно проследить за влагалищными выделениями. Поэтому и принято считать начало цикла с началом кровянистых выделений. Но, оказывается, такой метод определения дня цикла совсем не подходит для датирования эндометрия. Многие врачи предлагают учитывать несколько параметров, а не только гистологическое строение эндометрия. Эти параметры могут включать биохимический и гормональный профили как сыворотки крови, так и самого эндометрия. Некоторые врачи используют до 17 таких параметров (показателей), анализируя состояние эндометрия, что является дорогостоящим методом постановки диагноза, но оправдывающим себя в ряде случаев, особенно при оценке причин бесплодия и невынашивания беременности на ранних сроках. Но даже при наличии биопсии и детального морфологического анализа состояния эндометрия масштабные исследования разочаровали врачей тем, что не показали четких различий между эндометрием у фертильных и бесплодных женщин, а также его точное датирование. Анализ всех существующих методов оценки эндометрия показал, что ни один из этих методов не является точным и достоверным, все они страдают рядом погрешностей.9.1.4. Децидуализация эндометрия
В животном мире менструирует только небольшое количество видов животных, и этот вопрос рассматривается ниже. Почему менструация не возникает у всех млекопитающих? В чем различие между эндометрием и гормональной регуляцией у разных видов животных? Отличие кроется в особенности изменений эндометрия после овуляции. Овуляция происходит у многих млекопитающих, но только у некоторых видов клетки эндометрия изменяются, а точнее, дифференцируются на децидуальные клетки. Децидуальные изменения клеток эндометрия — это особое состояние, фактически подготовка матки к принятию плодного яйца, если оно оплодотворено, и к развитию беременности. Децидуальная ткань играет важную роль в имплантации плодного яйца, а также выполняет функцию защитной прослойки от повреждения стенок матки агрессивно внедряющимся хорионом — ворсинками плодного яйца. У тех животных, у которых менструация отсутствует, децидуальная ткань появляется только с появлением беременности. У тех животных, у которых есть менструальные циклы, включая человека, децидуальные изменения эндометрия возникают после овуляции и существуют несколько дней. Децидуальные изменения являются невозвратимым процессом (так считают большинство ученых и врачей), происходящим в эндометрии, поэтому при отсутствии оплодотворения и имплантации такой эндометрий должен быть замещен новым. Процесс децидуализации изучен лучше на животных моделях, чем у людей, несмотря на то что у женщин часто проводится забор (соскоб или аспирация) эндометрия в разные дни менструального цикла для изучения его строения. С одной стороны, децидуализация действительно выполняет определенную защитную функцию и предохраняет стенку матки от слишком глубокого внедрения хориона. В местах повреждения эндометрия (рубцы после кесарева сечения и оперативных вмешательств на матке, синехии после абортов и диагностических выскабливаний) децидуализация нарушена, поэтому нередко у таких женщин повышается риск патологических видов прикрепления плаценты — ее врастание в стенку матки, а во время родов может потребоваться ручное или инструментальное удаление плаценты. С другой стороны, децидуализация сопровождается интенсивным формированием сосудов (ангиогенезом), что очень важно для нормальной имплантации плодного яйца. В этот период в эндометрии появляется большое количество клеток иммунной системы — натуральных киллеров, и проходят процессы дифференциации эндометриальной стромы в децидуальные клетки. Таким образом, является ли децидуализация защитой от плодного яйца или, наоборот, почвой для лучшей имплантации, определить невозможно. Это, скорее всего, интеграция двух функций измененного эндометрия. Фактически децидуализация является ответной реакцией на повышение уровня прогестерона после овуляции, поэтому прогестерон считают единственным сигналом, вызывающим децидуализацию у человека и менструирующих животных. У неменструирующих животных прогестерон роли в процессе дециадуализации не играет, и основным сигналом для изменений эндометрия будет само плодное яйцо. Помимо роли в защите организма матери от инвазивности плодного яйца, спонтанная децидуализация может играть роль в выборе здорового, полноценного эмбриона, позволяя ему имплантироваться. И, наоборот, при «ощущении» дефектного зачатия, имплантация не состоится. Изучая процесс имплантации бластоцист (эмбрионов) и реакции эндометрия при вхождении плодного яйца в полость матки, ученые заметили разную реакцию эндометриальной стромы и ее дифференциации. Известно, что, входя в полость матки на 4–6-й день после зачатия, бластоциста находится в «подвешенном состоянии» сутки, а то и больше, не имплантируясь. Очевидно, в этот период с помощью определенных сигналов происходят «переговоры» между организмом матери и зачатым ребенком. Предполагается, что чувствительность организма женщины по отношению к здоровому или дефектному зачатию происходит через децидуальную ткань. Когда в полость матки женщин с нарушенной децидуализацией вводили здоровые эмбрионы, реакции эндометрия не наблюдалось. Также оказалось, что уровни хромосомных предымплантационных дефектных зачатий у высших приматов и человека почти одинаковы, то есть отсеивается такое же количество нездоровых эмбрионов (около 80 %) до имплантации. Другие исследования показали, что при ухудшении качества эмбрионов с возрастом у человека и приматов (из-за ухудшения качества половых клеток) процесс децидуализации тоже нарушается. Введение эмбрионов, полученных от старых родителей, в матку здоровых молодых женщин или самок приводило к очень низкому уровню имплантации, а процесс развития децидуальной ткани тоже останавливался. Таким образом, между качеством децидуальной ткани и качеством эмбрионов существует связь. Неудивительно, что в репродуктивной медицине женщинам старше 37–40 лет предлагают проведение ЭКО с донорскими яйцеклетками, полученными у молодых женщин. Количество рецепторов эстрогена и прогестерона меняется в зависимости от дня менструального цикла и от цикла к циклу. К середине второй фазы (что бывает на 7-й день после овуляции) секреторные изменения в эндометрии достигают максимума, в том числе и уровень децидуализации. Оказывается, у женщин, предохраняющихся от беременности (но не гормональными контрацептивами), или тех, которые не беременеют, в каждом цикле уровень децидуализации может быть совершенно разным — от минимального до максимального, что является нормой. В гинекологии такие изменения называются также фенотипическими изменениями. Давайте вспомним, что набор генов в хромосомах, где хранится информация о строении и функции человека, называется генотипом. Преимущественное количество генной информации одинаково у всех людей, но в совокупности действие генов проявляется формированием человека с уникальными особенностями-отличиями. Поэтому, несмотря на сходство, все люди отличаются друг от друга. Такое наружное проявление генотипа называют фенотипом. Генотип проявляется и на внутренних органах — через их размеры, строение, выполнение функции. Репродуктивная система женщины — не исключение. Даже при наличии одинаковых для всех женщин механизмов регуляции функции этой системы у каждой женщины менструальные циклы могут протекать по-разному, то есть иметь свои особенности. Поэтому изменения в эндометрии тоже могут иметь свои фенотипические особенности.9.1.5. Биохимические изменения в эндометрии
Для возникновения беременности или возникновения менструации децидуальных изменений в эндометрии недостаточно. С ростом прогестерона после овуляции в эндометрии происходят не только децидуальные изменения, но и появляются разные вещества, от количества и пропорции которых будет зависеть ответная реакция эндометрия на повышение и понижение уровней гормонов, в частности самого прогестерона. Важную роль играет выработка цитокинов и хемокинов. Цитокины — это небольшие белковые вещества, которые выполняют информационную функцию. Они вырабатываются одними клетками, чтобы взаимодействовать с рецепторами других клеток, что приводит к передаче сигнала от одной клетки к другой. В эндометрии — это взаимодействие с рецепторами прогестерона. Хемокины — это разновидность цитокинов, поэтому это тоже белковые вещества. Их основная функция состоит в контроле миграции клеток, а также в развитии-росте ткани. Процесс роста и отслойки эндометрия не может происходить без участия хемокинов. Так как во время менструации повреждается большое количество сосудов, хемокины участвуют в образовании и росте новых сосудов, а также «привлекают» в зону отслойки, — что фактически является определенным участком поврежденной ткани и сопровождается воспалительной реакцией, — лейкоциты и другие защитные элементы крови.9.1.6. Фазы состояния эндометрия
Эндометрий матки может находиться в разных качественных состояниях, которые называют фазами — нейтральной, принимающей или рецептивной, и непринимающей или рефракторной. Эти фазы определяются готовностью эндометрия принять плодное яйцо для имплантации, и они возникают в каждом овуляторном менструальном цикле. Классификацию эндометрия по фазам используют в репродуктивной медицине как для диагностики бесплодия, так и для подготовки эндометрия для подсадки эмбрионов после ЭКО. Для перехода эндометрия из одной фазы в другую требуется время, и это время зависит от видовой принадлежности млекопитающих. У женщин изменения тоже не являются скачкообразными, они также зависят от уровней соответствующих гормонов. Нейтральная фаза — это период, когда эндометрий не готов принять плодное яйцо, и он может переходить из состояния пролиферации (первая фаза менструального цикла) в секреторное состояние (первая половина второй фазы менструального цикла). Несмотря на то, что нейтральное состояние эндометрия регулируется эстрогеном и прогестероном, принять плодное яйцо он в такой фазе не может. Такое же состояние можно вызвать введением эстрогенов и прогестерона искусственно (например, при использовании гормональных контрацептивов или заместительной гормональной терапии). Следует подчеркнуть, что пролиферация эндометрия происходит за счет влияния эстрогенов, а не прогестерона. Прогестерон подавляет пролиферацию и трансформирует эндометрий в секреторное состояние. Когда врачи назначают прогестерон для «наращивания» эндометрия, это проявление обыкновенной малограмотности в вопросах женского здоровья. Также заметим, что комбинация эстрогенов и прогестерона — это та же контрацептивная схема, что и при применении готовых комбинированных гормональных контрацептивов. При использовании таких схем овуляции у женщин не бывает. К сожалению, многие женщины «сидят» на таких схемах «регуляции менструального цикла» годами, оставаясь бесплодными искусственно. Вторая фаза — фаза рецептивности — не может регулироваться искусственно. Эта фаза и есть истинным окном имплантации. Эндометрий можно подготовить для принятия плодного яйца, однако провести контроль имплантации искусственно невозможно. Ошибочно считается, что благодаря прогестерону происходит имплантация. Когда бластоциста попадает в полость матки, около двух суток она находится «в подвешенном состоянии», ожидая сигнала о переходе эндометрия из нейтральной фазы в рецептивную фазу, то есть о его готовности к имплантации. Этот период называется окном имплантации, и он также зависит от уровня эстрогенов, а не только прогестерона, как и от наличия достаточного количества полноценных эстрогенных и прогестероновых рецепторов. Более подробно эта тема раскрыта в главе «Прогестерон и имплантация». Третья фаза — рефракторная, когда эндометрий становится нечувствительным к плодному яйцу и не в состоянии поддержать имплантацию. Эта фаза может быть вызвана искусственно. Например, назначение прогестерона приведет к возникновению нейтральной фазы, которая перейдет в рецептивную фазу на фоне назначенного эстрогена, но через короткий период времени возникнет рефракторная фаза. Длительный прием прогестерона может удлинить фазу рефракторности. Перепрограммирование эндометрия в отношении чувствительности к гормонам также требует определенного периода времени — нескольких дней, и оно всегда возникает после отмены прогестерона. Пик прогестерона характеризуется не только блокировкой пролиферации эндометрия, но и его дифференциацией за счет развития секреторных желез и децидуализации эндометрия, активацией выработки разных клеток иммунной системы из костного мозга и их привлечением к репродуктивным органам, и процессом образования новых сосудов.9.2. Прогестерон и менструация
Современные женщины начинают менструировать раньше и входят в состояние климакса позже, чем женщины прошлого столетия, не говоря уже о женщинах 12–18-го столетий. Расширение репродуктивного периода связано с тем, что современные женщины беременеют и рожают значительно реже, чем женщины в прошлом. Беременности и послеродовые периоды — это всегда смена гормонального фона, которая сопровождается не столько стимуляцией функции яичников, сколько подавлением их работы. Женщины прошлого выходили замуж фактически в подростковом периоде, когда только начиналось созревание половой системы. Не все беременели сразу, но многие жены-подростки не имели менструальных циклов, потому что не менструация определяет плодовитость, а овуляция. Буквально с первых нормальных овуляций такие женщины беременели. Часто беременности терялись у юных и незрелых женщин, сопровождались серьезными осложнениями и гибелью женщин, особенно в родах, поэтому постепенно во многих обществах оптимальным сроком для замужества начали считать не 12–14, а 16–18 лет. К этому времени менструальные циклы достигали уже определенной регулярности, хотя далеко не у всех. Такие женщины беременели легче, а также вынашивали беременность с наименьшим количеством осложнений. С наступлением беременности менструации прекращались, после родов их не было тоже — женщины кормили новорожденных грудью, и как только восстанавливалась овуляция, они снова беременели, часто не имея менструаций (на фоне грудного вскармливания). И все шло по кругу. И так повторялось 8–12 раз, потому что выбора в контрацептивах в прошлом не было. Да и понятие роли женщины было совершенно другим — на первом плане замужней женщины стояло материнство и семейность, а значит, рождение нескольких детей. Потеря беременности, как и потеря ребенка, хотя и воспринималась тяжело, но оправившись после потери, женщины снова беременели — жизнь продолжалась. Частые беременности, роды, послеродовый период были сильной нагрузкой на женский организм, в том числе на репродуктивную систему. Поэтому яичники истощались быстрее, как и истощался женский организм, и обычно к 35–37 лет большинство женщин умирало — средняя продолжительность жизни была значительно ниже таковой у мужчин (45–47 лет). Таким образом, количество менструирующих женщин в прошлых веках было незначительным. Общественное понятие материнства состояло в понятии беременностей и рождения детей, а наличие месячных всегда оценивалось как бесплодие, какой-то дефект, «грязнота» женственности, «негативная печать». Если менструации считались нормой у девочек-подростков и даже воспевались у некоторых народов как символ готовности девочки к материнству, то у зрелой женщины, а тем более, если у нее не было детей, — менструация нередко считалась признаком хвори и бесплодия. Для продолжения рода требовались молодые женщины с хорошо развитыми молочными железами, нормальным или большим тазом, и даже жировой тканью в области живота и бедер. У многих народов мира фертильность, а значит материнство, ассоциировалась именно с такой формой тела и ассоциируется до сих пор. Достаточно вспомнить археологические находки — женские статуэтки и фигурки, изображения женщин, начиная от наскальных рисунков и заканчивая картинами великих мастеров вплоть до середины прошлого столетия. В современном мире ситуация изменилась и в отношении продолжительности жизни женщин, и в количестве беременностей и родов. Если в развитых странах, где женщины беременеют и рожают редко (обычно не больше 1–3 раз), количество менструальных циклов может быть около 400 за всю жизнь женщины, в развивающихся странах, где высокие уровни рождаемости и плохие социально-экономические условия, до сих пор большинство женщин большую часть своей жизни не имеют менструации. Это явление связано с тем, что женщины этих стран начинают менструировать позже, имеют большее количество беременностей и родов и более продолжительные периоды грудного вскармливания — фактически живут традициями прошлых поколений.9.2.1. Эволюция менструации
Среди всех млекопитающих кровянистые выделения из-за отслойки эндометрия наблюдаются только у небольшого количества видов: почти всех высших приматов, некоторых видов летучих мышей, прыгунчиков. Отслойка эндометрия вызвана падением уровня прогестерона. У других видов млекопитающих отслойка, точнее, поломка эндометрия, как и падение уровня прогестерона, не сопровождается кровотечением. У собак кровянистые выделения наблюдаются из влагалища, а не из матки, и падения уровня прогестерона в этот период не наблюдается. Почему у большинства животных нет менструации, в то время, когда у наивысших в эволюционном древе представителей фауны появились менструации? В чем здесь рациональность природы? Существует множество гипотез, от вполне научных до анекдотичных и абсурдных. Противники менструаций (есть и такие, особенно среди увлеченных экстремальными диетами, когда серьезно нарушается менструальный цикл и репродуктивная функция) утверждают, что менструация является ошибкой природы, неким нерациональным шагом в эволюции животных, в том числе человека. Но если принять во внимание факт, что менструации наблюдаются как раз у высших приматов и человека — в последнем звене эволюционного развития животного мира на сегодняшний момент, то как-то верится с трудом, что произошла ошибка в формировании и развитии репродуктивной системы через программу размножения, которая выразилась появлением менструации. Другие противники менструации считают, что во время месячных женщина теряет слишком много крови, железа и других важных элементов, что ее иммунная система истощается, поэтому скорее могут заболеть половыми и другими инфекциями. Действительно, женщина теряет кровь во время месячных, но количество влагалищных выделений, которые состоят большей частью из обрывков мертвого эндометрия и крови, не превышает 50 мл у большинства женщин, что равнозначно 2–3 столовым ложкам, хотя женщине может казаться, что у нее слишком обильные выделения. Если рассматривать жизнь женщин через призму менструаций, абортов, родов (при которых может теряться до 500 мл крови), кесаревых сечений (до 1000 мл крови), то по сравнению с мужчинами женский организм должен быть слабее, подвергаться большему количеству заболеваний. Однако известно, что женщины выносливее, уровни заболеваемости разными болезнями у них не выше, чем у мужчин, а продолжительность жизни современных женщин больше и опережает таковую у мужчин на 5–10 лет. Важно также учесть тот факт, что, хотя современные женщины беременеют и рожают реже, но у них значительно возросло количество менструаций, а менопауза приходит позже на 10–15 лет по сравнению с женщинами 19-го века. Однозначно, менструация не является «ошибкой» природы. Наиболее распространенные гипотезы о возникновении менструации следующие: 1. Теория удаления патогенных микроорганизмов, занесенных со спермой: во время полового акта во влагалище и другие половые органы вместе со спермой попадают микроорганизмы, которые могут вызвать воспаление органов репродуктивной системы, поэтому матка «линяет» ежемесячно, стараясь «очиститься» от попавших инфекционных агентов. Однако патогенные микроорганизмы передаются через половой акт и у животных, не имеющих менструации. Менструируют также регулярно и женщины, и животные, которые не имеют половой связи. 2. Гипотеза сохранения энергии: удаление эндометрия энергетически выгоднее, чем поддержание его постоянной функции на одном и том же уровне. Такая гипотеза не может объяснить возникновение овуляции и значение эндометрия для имплантации, тем более что у многих видов животных отторжения и обновления эндометрия не наблюдается. 3. Гипотеза подготовки матки к защите от агрессивности плодного яйца. Согласно этой гипотезе «линька» эндометрия предохраняет матку от воспалительных процессов и разрушающего влияния хориона плодного яйца, а также понижает окислительные процессы, которые значительно повышаются при беременности. Однако беременеют и успешно вынашивают беременности животные, у которых нет менструации. Не совсем понятна связь между менструацией (отслойкой эндометрия) и успешной последующей беременностью. 4. Гипотеза очистки эндометрия от спонтанной децидуализации (о децидуальной ткани читайте выше). Такая гипотеза наиболее приемлема, но до сих пор нет четких представлений, почему возникают децидуальные изменения у менструирующих животных. Последняя гипотеза заслуживает внимания, так как она объясняет изменения на уровне эндометрия через призму гормональных изменений и процесса овуляции. Спонтанная децидуализация — это ключ к пониманию появления менструации у животных. Однако до сих пор нет четкого понимания, какие процессы в ходе эволюции привели к появлению децидуализации. Наиболее распространенное объяснение — это наличие конфликта между матерью и эмбрионом, постоянная борьба принятия плодного яйца или его отторжения, о чем уже упоминалось, и она научно доказана. Даже тот факт, что у людей половина первых беременностей прерывается чаще всего как результат иммуннологического конфликта между матерью и плодным яйцом, что фактически является проявлением незрелости отношений между двумя генетически чужеродными телами, подтверждает это объяснение. Если рассмотреть эволюцию размножения и вынашивания потомства, то млекопитающие — это единственный класс животных, которые носят потомство от начала зачатия до их рождения внутри своего тела. Исключение составляют сумчатые (инфракласс млекопитающих), которые имеют специальное приспособление в виде сумки на передней стенке живота. Их детеныши частично развиваются внутри тела самки, а потом недоразвитыми продолжают расти в этой сумке. Тем не менее, все без исключения плацентарные звери (млекопитающие) вынашивают потомство внутри матки, поэтому у них всегда существует конфликт между их телом и зачатым потомством. У всех млекопитающих процесс зачатия потомства происходит в период овуляции или же овуляция стимулируется копуляцией (совокуплением). Почему природа «перевела» выведение потомства снаружи, в окружающей среде (в виде яиц) во внутрь тела самок? Скорее всего, этот рациональный шаг эволюции способствовал повышению шансов получения здорового потомства — от количественного зачатия до качественного, от сотен, тысяч и даже миллионов зачатков, выброшенных в жесткие условия внешней среды, в которой выживут единицы индивидуумов, а до половой зрелости доживет еще меньше, до единиц, максимально — дюжины развитых организмов, выращенных внутри матери и получивших необходимые питательные вещества, и фактически приспособленных к выживанию во внешней среде при кратковременной или длительной поддержке матери (грудное вскармливание). Является ли плод своего рода паразитом, не только существуя за счет использования питательных веществ из организма матери, но и живя в нем определенный период жизни? В какой-то степени — это действительно так. Однако в соответствии с определением понятия «паразитизм» плод не является представителем другого вида животных, а также зрелой, развитой формой, взрослой особью. Во время беременности в организме женщины происходят изменения, которые позволяют плоду выжить, то есть между ребенком и матерью формируется специфическая взаимосвязь. Усвоение питательных веществ из пищи у беременных женщин увеличивается, кровоснабжение матки, в которой находится плод, тоже увеличивается. Генетически плод содержит 50 % ДНК матери, что уменьшает степень иммунологического конфликта. Плацента, или детское место — производное плода, поэтому тоже является чужеродным телом для матери. Но она обладает свойством внедрения в стенку матки для обеспечения зачатому потомству необходимых питательных веществ. Поэтому неудивительно, что децидуальная ткань, которая возникает у неменструирующих животных только при появлении беременности, особенно в месте прикрепления плаценты, действительно предохраняет стенку матки от слишком глубокого внедрения ворсин хориона. Однако у этих животных процесс зачатия потомства происходит только в сезоны размножения. У приматов и человека степень инвазии плаценты намного больше, чем у других представителей зверей, поэтому требуется формирование децидуальных клеток до начала имплантации. Эволюция размножения у млекопитающих привела к тому, что чем «агрессивнее» становится плод по отношению к женскому организму, тем большая защита наблюдается в виде децидуальной ткани. И женщина в этом отношении не исключение.9.2.2. Отношение современных женщин и общества к менструации
Отношение женщин и всего общества к менструациям кардинально изменилось за последнее столетие, в основном благодаря появлению женских гигиенических средств (прокладок и тампонов), что дало женщинам возможность принимать активное участие в жизни общества независимо от дня менструального цикла. А также благодаря достижениям науки и медицины в познании механизма возникновения и регуляции этого цикла. Тем не менее, до сих пор среди людей разных обществ и культур доминируют многочисленные мифы о менструации, неверно объясняющие работу женского тела. Исторически сложилось так, что одни народы относятся к менструации как важному положительному событию в жизни женщины, другие же рассматривают ее как настоящее проклятие. Поскольку с древних времен кровь наделялась таинственной, магической силой, потеря крови во время месячных считалась положительным или отрицательным признаком. У некоторых народов периоды менструации сопровождались ритуалами, танцами, различными традициями. До сих пор некоторые люди считают, что во время месячных женщины обладают неконтролируемой демонической силой, способной наносить вред другим людям, поэтому у ряда этнических групп и народов до сих пор существуют правила поведения для менструирующих женщин. Например, некоторые племена коренных жителей Канады и Венесуэлы требуют от женщин укрываться в специальных хижинах в течение периода менструации. В Коста-Рике в некоторых племенах такие женщины могут принимать пищу, пользуясь банановыми листами, и пить воду из специальных кружек. Считается, что, если кто-то случайно выпьет воду из кружки менструирующей женщины, этот человек может умереть. В Уганде менструирующим женщинам не разрешается трогать руками посуду и даже готовить еду, чтобы не отравить мужчин. Однако все же у большинства древних и современных народов менструация рассматривается как положительный признак функционирования женского тела. В ряде народов менструальное кровотечение наделено мистической силой, поэтому существуют ритуалы, в том числе среди мужчин, которые симулируют состояние менструации. В африканском племени Чага существует специальное обучение девочек перед первой менструацией — шига, которое также включает вопросы сексуального поведения, зачатия и вынашивания потомства. Обычно в течение некоторого времени до начала менструаций девочка-подросток проводит в доме будущей свекрови. Мужчины этого племени имеют ритуалы, симулирующие менструальное кровотечение. В Европе до сих пор существует культ «менструальной крови», согласно которому выделения во время месячных обладают магической силой, поэтому каплю этой крови добавляют в напитки (любовные привороты или эликсиры омоложения). Страх и негативное отношение к менструации в христианской религии появились вследствие запрета для женщин находиться во время месячных в общественных местах, так как не было гигиенических прокладок, и кровь стекала по ногам и подолу юбок, оставляя следы на полу и на земле. В древнем Риме к менструации относились как к сильнейшей отраве, способной убивать насекомых и животных. Поэтому касаться менструирующей женщины и даже смотреть на нее считалось опасным для жизни. Запрет нахождения менструирующих женщин в церквях и храмах появился параллельно с запретом их пребывания в общественных местах, и вскоре он оброс мифическими объяснениями. Если в ортодоксальном иудаизме менструирующие женщины совершают специальное ритуальное омовение (миква), в ортодоксальном христианстве таким женщинам не разрешалось причащаться. В наше время до сих пор в ряде религий и религиозных направлений существуют некоторые запреты для женщин в период менструации, но довольно часто они выдумываются местными священнослужителями, страдающими негативным отношением к женщинам и не принимающими во внимание научные факты и объяснения функции женского тела.9.2.3. Понятие о «критических» днях
Сейчас стало популярным (модным) называть менструацию критическими днями. Но это ошибочное название. В недалеком прошлом критическими днями называли дни, когда женщина могла забеременеть. Эти дни выпадали на середину цикла, так как у большинства женщин в этот период происходила овуляция. Точный момент овуляции установить непросто, но признаки назревающей овуляции может определить любая женщина (если ее этому научить). Таким образом, дни наибольшей вероятности зачатия ребенка назывались критическими, особенно в плане нежелательной беременности. Кардинальное изменение понятия о «критических днях» произошло около 20 лет тому назад, скорее всего, по вине врачей. Одно необдуманное высказывание, слетевшее с уст врача, и это ложное понимание начало распространяться среди женщин. Причина изменения значения «критических дней» кроется в том, что очень многие врачи, к сожалению, считают менструацию основойменструального цикла, поэтому постоянно «регулируют» менструальные циклы ради получения регулярных месячных кровотечений. Овуляция — это ключик к регулярности цикла, то есть к регулярности менструальных выделений. Она всегда первичная, а менструация — всегда вторичная. Поэтому, если женщина хочет быть матерью, важно получить регулярную овуляцию, а не менструацию. Овуляция не всегда сопровождается менструацией, и наоборот, отсутствие овуляции может сопровождаться менструацией — существуют ановуляторные циклы. Но они никогда не приводят к возникновению беременности.9.2.4. Возникновение естественных менструальных кровотечений
Если рассматривать механизм возникновения менструации на гормональном уровне, то это — то же кровотечение отмены гормонов, которое возникает на фоне приема гормональных контрацептивов. При возникновении зачатия уровень прогестерона во второй фазе менструального цикла остается повышенным, потому что плодное яйцо, попав в полость матки, начинает имплантироваться, что «продлевает» жизнь желтого тела яичников на 2–3 недели, пока это яйцо не возьмет на себя выработку собственного прогестерона. Если зачатие не состоялось, а также у женщин, не живущих половой жизнью или предохраняющихся разными методами, — не дождавшись сигналов от имплантирующегося плодного яйца, желтое тело прекращает свою функцию, но не скачкообразно, а постепенно — медленной регрессией и атрофией, что обычно длится 5–7 дней (с 21-го по 26–28-й день менструального цикла). Уровни эстрогенов к этому времени понижены, так как они вырабатываются зернистыми клетками растущего фолликула, а не желтого тела. Уровень прогестерона к этому времени тоже значительно понижается — желтое тело прекратило свою функцию, уменьшилось в размерах и стало белым телом из-за наличия рубцовой (соединительной) ткани. Таким образом, перед возникновением менструации уровни гормонов в женском теле достигают очень низких показателей. Это приводит к отслойке эндометрия — возникает менструация, или физиологическое кровотечение отмены гормонов. Хотя репродуктологами и эндокринологами менструальный цикл изучен детально на уровне клеток, генов, химических веществ, однако до сих пор существует множество «белых пятен», раскрытие которых позволило бы увидеть картину в целом, понять механизм менструации, а также патологических кровотечений. То, что менструальное кровотечение можно вызвать искусственно введением гормонов, а потом их отменой, говорит в пользу регуляции маточного кровотечения стероидными гормонами. Если уровень прогестерона поддерживать искусственно, менструация не наступит. Если назначать антагонисты прогестерона, например, мифепристон, в секреторную фазу менструального цикла, они свяжутся с рецептами прогестерона и не позволят прогестерону усвоиться, что вызовет маточное кровотечение.9.2.5. Фазы менструации
Для изучения механизмов менструального цикла женщин использовались разные животные модели, но чаще всего макаки-резус и мыши. Самыми оптимальными, то есть близкими к человеку, оказались макаки. У них менструальный цикл составляет в среднем 28 дней, как и у женщин, а также строение матки и эндометрия очень близки к женской репродуктивной системе. Отмена прогестерона вызывает у макак менструацию, которая протекает в две фазы. Первая фаза менструации длится 24 часа после падения уровня прогестерона, и назначение прогестерона в этот период может остановить кровотечение. Вторая фаза менструации обычно возникает после 36 часов отмены прогестерона, и с этого момента процесс менструации является невозвратным, то есть остановить отслойку эндометрия невозможно. Менструации у женщин имеют точно такую же фазность. Понимание детальной фазности менструации важно в первую очередь в тех случаях, где менструальные выделения обильные или длительные — как остановить кровянистые выделения, когда их количество и продолжительность выходят за допустимые нормы? На каком уровне происходит поломка в каждом конкретном случае: на уровне клеток эндометрия, сосудов, взаимоотношений между разными клетками эндометрия, молекулярных и биохимических уровнях? Как правильно диагностировать эти поломки? Правильные ответы на эти важные вопросы могут помочь подобрать правильное лечение.9.2.6. Процесс отслойки эндометрия
Менструация — это не только кровотечение. Фактически это процесс «линьки эндометрия». Большая часть функционального эндометрия отслаивается-отторгается, что сопровождается кровотечением. Процесс линьки не является одномоментным, то есть эндометрий не отслаивается сразу и всюду, а начинается в определенных точках, и продолжается 4–5 дней, и при этом одновременно проходит процесс восстановления эндометрия. Электронная микроскопия эндометрия показывает, что небольшие очаги отслойки эндометрия начинаются на 28-й день нормального цикла. Одновременно с массовой гибелью и отслойкой эндометрия происходит и массовая поломка сосудов. Но параллельно с процессом отслоения происходит процесс восстановления эндометрия и построения новых сосудов. Два противоположных процесса происходят одновременно, участок за участком, что практически не позволяет ученым изучить механизм менструации детально. Менструальная кровь не содержит тромбы, то есть сгустки крови, а все, что видит женщина и принимает за сгустки, является кусочками отслоившегося эндометрия. И чем старше женщина, тем эти кусочки крупнее. Если в молодом возрасте многие женщины характеризуют выделения наличием «песка», то есть красных мелких включений, то после 35 женщины чаще жалуются на выделения крупных «сгустков». Интересно, что участок, где произошла отслойка эндометрия, является открытой раной, но в этом месте никогда не образуются рубцы, а ежемесячно нарастает новый эндометрий.9.2.7. Возникновение искусственных менструальных кровотечений
Открытие синтетических форм прогестерона (точнее — стероидных веществ со свойствами, близкими к прогестерону) стало не только началом гормональной контрацепции, но и дало женщинам определенную свободу в профилактике нежеланной беременности, а также в создании регулярных искусственных кровотечений, которые в свою очередь создавали видимость «нормального менструального цикла». Эти циклы никогда не были «нормальными», хотя бы потому, что они были искусственными. Но для многих женщин, у которых менструальные циклы были нерегулярными, поэтому вызывали стресс, особенно если женщины вели открытую половую жизнь, не пользуясь другой контрацепцией, появление регулярных кровотечений сняло стрессовую нагрузку и переживания. Механизм действия гормональных контрацептивов основан на том, что большинство из них подавляет овуляцию, заглушая работу яичников. Ошибочно думать, что яичники при этом «отдыхают». Их работа подавлена введением в организм синтетических заменителей гормонов (в первую очередь прогестинов), которые в натуральном цикле вырабатываются не яичниками как таковыми, а зреющими фолликулами. На фоне гормональной контрацепции фолликулы не растут. Если принимать гормональные контрацептивы в непрерывном режиме, кровотечений не будет, за исключением «прорывных» у некоторых женщин. Эндометрий чуть-чуть будет нарастать, но так как фазности цикла при применении комбинированных оральных контрацептивов (КОК) не наблюдается, его качество будет оставаться практически неизменным. Для удобства, — так как большинство женщин привыкли иметь свои менструальные циклы, — и чтобы не возникало ложной тревоги по поводу отсутствия менструации, а значит, возможной беременности, схема приема гормональных контрацептивов такова, что создаются ложные менструальные циклы. Появление кровотечения основано на том же принципе отмены гормонов: в течение 21 дня женщина должна принимать синтетические гормоны, потом перерыв в 7 дней или прием таблеток-пустышек, содержащих обычно сахар. Этот 7-дневный период без гормонов отражает 22–28-е дни цикла, когда уровень прогестерона при нормальном цикле начинает падать. Закономерно, что на фоне такого понижения уровней гормонов у женщины возникает кровотечение отмены — менструация, но уже вызванная искусственно. Прогестерон, а точнее, его низкий уровень перед месячными, является тем триггером, который провоцирует появление кровотечения. Неважно, что гормональные контрацептивы являются комбинированными и помимо синтетического прогестерона содержат синтетические эстрогены. Эстрогены играют большую роль для начала цикла — нарастания эндометрия. Гормональные контрацептивы, содержащие только прогестины (мини-пили), вызывают при их отмене (после приема 21 таблетки) такие же кровотечения отмены, как и другие гормональные противозачаточные средства. У пластырей и колец, содержащих прогестины, действие идентичное — после трех недель выделения гормонов в организм женщин наступает «гормонально чистый» период и возникает кровотечение отмены. Внутримышечная система «Мирена» выделяет в организм женщины определенное количество прогестина постоянно, хотя чем дольше применятся эта гормональная система, тем больше понижается уровень выделяемого гормона. Поэтому у таких женщин менструальные периоды могут быть нерегулярными и даже отсутствовать какой-то период времени, сопровождаясь периодически кровомазаньем и «кровотечением прорыва». «Мирена» подавляет овуляцию у большинства женщин, но не у всех. Синтетический прогестерон также может привести к увеличению кровотечения и менструальных выделений, особенно у женщин с фиброматозными узлами. Инъекции синтетических прогестинов (Депо-Провера) подавляет функцию яичников на три месяца (у некоторых женщин на долгий период), создавая искусственную менопаузу — большая концентрация гормона требует времени для выведения из организма и достижения минимального уровня, когда возможно возникновение менструального кровотечения. Таким образом, менструация — это всегда кровотечение отмены прогестерона или в натуральном виде, или в синтетическом.9.2.8. Первая менструация — менархе
Вот уже несколько десятков лет, почти столетие, во многих странах проводится государственная регистрация многих заболеваний и причин смертности. Сравнительный анализ полученных данных позволяет проводить статистический анализ не только состояния здоровья населения в разных регионах мира, но и наблюдать динамические изменения — тенденцию роста продолжительности жизни, увеличение или понижение уровня ряда заболеваний. Эти данные также позволяют проследить за физиологическими изменениями в общей популяции населения в отношении появления первой менструации, частоты беременностей и родов, наступления менопаузы. Давно уже замечено, что возраст наступления первой менструации значительно помолодел за последние 100 лет: с 14.5 лет до 12.5 лет, а в некоторых странах до 11.5 лет. Данные американского Центра Контроля Заболеваний (Center of Disease Control) отмечают также интересный феномен: с уменьшением количества беременностей (многие современные женщины не хотят беременеть, поэтому предохраняются большую часть своей репродуктивной жизни) увеличилось количество спонтанных выкидышей, внематочной беременности и хромосомных аномалий даже у женщин молодой возрастной категории (до 30 лет). Ученые считают, что такое явление объясняется тем, что сдвиг начала полового созревания и возникновения менархе к более раннему возрастному периоду привел к сдвигу начала старения и угасания функции яичников, что повлекло за собой подъем показателей осложнений беременности, которые чаще наблюдаются после 30 лет, то есть в старшей возрастной категории женщин. Также нельзя упускать факт использования большинством молодых женщин гормональных контрацептивов, часто с конца юношеского возраста, что также может быть причиной нарушений на морфологическом и генетическом уровне в яичниках и возникновения более ранних процессов старения. Интересно, что начало месячных циклов (менархе) имеет высокую наследственную зависимость, то есть повторяет паттерн матери, бабушки и т. д. В 60 % случаев менструальные циклы определяются генетическими факторами. Наследственный фактор обнаружен и в паттерне протекания беременностей. Пока что точных данных о том, какие гены в каких хромосомах вовлечены в менархе и менструальный цикл, не существует, но уже известно, что важную роль играют в этом гены, отвечающие за строение и функцию прогестероновых рецепторов. Также существует тесная связь между этими генами и возникновением рака молочной железы, рака яичников и эндометрия матки (известно, что эти виды рака имеют определенную наследственную тенденцию к возникновению). Некоторых исследователей интересовал вопрос, когда появляется овуляция у подростков, сопровождается ли первая менструация овуляцией и как часто овулируют подростки, а также что происходит с уровнями гормонов перед менархе и в первые годы становления менструации. Было замечено, что перед менархе у девочек-подростков наблюдаются частые всплески прогестерона, что долго не могли объяснить из-за трудностей в проведении адекватного наблюдения за подростками (такие наблюдения требовали регулярных частых заборов крови для определения уровней гормонов). Исследования показали, что у 12 % девочек-подростков (средний возраст 12 лет) наблюдаются колебания уровней эстрогенов и прогестерона по овуляторному типу, означающие, что возможность наличия овуляции до менархе не исключена. Однако такие находки не были подтверждены УЗИ обследованием. Все девочки-подростки имеют повышенные уровни тестостерона, эстрадиола и 17-ОПК, а у девочек с овуляторными подъемами гормонов показатели уровней даже выше. Дальнейшие исследования показали, что у большинства подростков первая менструация не сопровождается овуляцией перед месячными. Но повышение уровня ЛГ и прогестерона перед менархе у некоторых девочек объясняет случаи беременности у подростков до появления месячных. Между этнической и расовой принадлежностью и возникновением менархе зависимости нет, но существует зависимость между индексом массы тела и уровнями прогестерона. У тех девочек, у которых наблюдались овуляторные подъемы прогестерона, индекс массы тела был ниже, чем в группе подростков с ановуляторными уровнями прогестерона, но не ниже допустимых норм веса для подростковой возрастной группы.9.3. Прогестерон и лейкоциты
Среди женщин нередко возникает настоящая паника, когда у них во влагалищном мазке обнаруживают лейкоциты и ставится «туманный» диагноз «воспаления», а какого именно — практически никогда не уточняется, или же женщину пугают всякими скрытыми инфекциями. Лейкоцитоз, то есть повышенное количество лейкоцитов, в тканях и крови женщины играет важную роль и зависит от дня и фазы менструального цикла. Лейкоциты и репродуктивная система женщины — неразделимы. Это далеко не признак воспалительного процесса, а динамический процесс, который наблюдается в организме женщин, и этот процесс полностью зависит от гормонального фона. Количество, как и вид лейкоцитов, меняется в зависимости от дня менструального цикла. Физиологический лейкоцитоз наблюдается перед овуляциями и во второй половине цикла, особенно перед менструацией. Во время беременности лейкоцитоз — это неотъемлемое и необходимое состояние, без которого беременность не будет протекать нормально. Лейкоциты есть во влагалищных выделениях, так как они сформированы из просочившейся через стенку влагалища и прилегающих сосудов жидкой части крови и мигрирующих лейкоцитов. Все без исключения виды лейкоцитов могут проникать через стенку капилляров. Шеечная слизь — это депо лейкоцитов, количество которых зависит от гормонального фона. Во время беременности из лейкоцитов и слизи канала шейки матки формируется плотная шеечная пробка (поэтому она белая и твердая на вид). Большое количество лейкоцитов появляется в тканях матки, в частности в эндометрии, к концу цикла. Непосредственно перед менструацией из всех клеток стромы эндометрия лейкоциты составляют 50 %. Другими словами, эндометрий «нафарширован» лейкоцитами перед менструацией. Эндометрий содержит разные лейкоциты: лимфоциты Т и В, макрофаги, нейтрофилы и ряд других. Он также содержит уникальный вид лейкоцитов — маточные натуральные киллеры (мНК, uNK), которые появляются в конце лютеиновой фазы и в начале беременности. Без достаточного количества этих лейкоцитов имплантация, плацентация и развитие беременности невозможны. В отличие от других натуральных киллеров, маточные НК отличаются специфическим строением, чувствительны к гормональным колебаниям, поэтому их количество полностью зависит от уровня половых гормонов и прогестерона. Так как в эндометрии к началу менструации наблюдается увеличение количества лейкоцитов, повышается количество человеческого лейкоцитарного антигена класса 1 (ЧЛА или HLA 1), что является нормой, особенно на поверхности эндометриальных стромальных клеток. Этот антиген выполняет очень важную роль. Лейкоциты мНК участвуют в процессе гибели и отторжения эндометрия и помогают в расщеплении (лизисе) отслоившихся клеток — без этого менструация невозможна. Но они также могут привести к лизису базального слоя эндометрия и стромы. Однако в природе этого не происходит, потому что человеческий лейкоцитарный антиген связывается с этим видом лейкоцитов и предохраняет строму и базальный эндометрий от повреждения. Пролактин (ЛТГ), который вырабатывается гипофизом, также вырабатывается клетками эндометрия во второй половине менструального цикла, то есть непосредственно в матке. Маточный пролактин стимулирует выработку лимфоцитов. Натуральные киллеры содержат рецепторы пролактина, которые позволяют реагировать не только на пролактин, но и на прогестерон (этот вид лейкоцитов не имеет прогестероновых рецепторов). Нейтрофилы присутствуют в тканях эндометрия в небольшом количестве почти весь менструальный цикл, но за несколько дней до начала менструации их количество значительно повышается, и они доминируют весь период менструального кровотечения. Считается, что именно быстрое понижения уровня прогестерона со второй половины лютеиновой фазы является пусковым сигналом появления большого количества лейкоцитов в репродуктивных органах. Основные нейтрофилы матки — это полиморфноядерные лейкоциты (ПЯЛ). Во всех учебниках и публикациях можно найти информацию о том, что этот вид лейкоцитов появляется в очаге воспаления. Действительно, по количеству именно этих видов лейкоцитов и их соотношению к клеткам плоского эпителия во влагалищных выделениях можно заподозрить воспалительный процесс. Но в реальности большинством постсоветских лабораторий этот показатель не определяется и не учитывается, а в результатах указано общее количество лейкоцитов в поле зрения и довольно грубый и неточный подсчет (например, 50–100 лейкоцитов в поле зрения). Но что делают ПЯЛ в полости матки и эндометрии, если воспаления на самом деле нет? Этот вид лейкоцитов участвует не только в борьбе с воспалительным процессом, поглощая (фагоцитируя) и микроорганизмы, и мертвые клетки, и обрывки тканей. Во время менструации происходит гибель большого количества клеток эндометрия, также он смешивается с кровью, создавая отличную почву для размножения микроорганизмов, которые могут попадать в полость матки из влагалища. Нейтрофилы становятся санитарами, очищающими поверхность участка, на котором произошло отторжение старого эндометрия от его остатков, и предотвращают попадание бактерий, вирусов, грибков в ткани эндометрия и матки. Другой вид лейкоцитов — макрофаги — тоже выполняют важную роль в функции эндометрия. Они составляют до 20 % всех лейкоцитов, появляющихся в матке к концу лютеиновой фазы. Хотя макрофаги не имеют прогестероновых и эстрогенных рецепторов, их количество в эндометрии и других тканях генитального тракта зависит от уровня гормонов и дня менструального цикла. Макрофаги содержат ферменты, которые расщепляют мертвые клетки эндометрия, они также вырабатывают ряд органических веществ, важных в процессах регенерации тканей. Таким образом, лейкоцитоз в любой форме является очень важной стадией физиологической нормы менструального цикла женщины.10. ПРОГЕСТЕРОН И ЗАБОЛЕВАНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Итак, в предыдущих разделах и главах была дана характеристика прогестерона, описано его воздействие на репродуктивные органы женщин и значение для функции женского организма вне беременности. Роль прогестерона в возникновении и прогрессе беременности обсуждается в разделе «Прогестерон и беременность». Если прогестерон важен для нормальной функции половых органов женщины, как влияет на работу этих органов нехватка или излишек прогестерона? Как влияют разные болезни на выработку и усвоение прогестерона? Выше уже упоминалось, что половое различие между мужчиной и женщиной предопределяет и различие в возникновении и протекании ряда заболеваний. Нарушения функции женской половой системы — это «чисто женская прерогатива», но не втянут ли в это нарушение прогестерон, которого меньше у мужчин, чем у женщин? Если прогестерон все же как-то причастен к заболеваниям, то насколько эффективным будет его назначение для лечения нарушений функций женской репродуктивной системы или, наоборот, подавления его выработки? Эти и другие вопросы будут рассмотрены в этой главе.10.1. Прогестерон и нерегулярность менструального цикла
Насколько нерегулярность менструального цикла является патологией, требующей срочного обследования и лечения? При обсуждении этого вопроса со многими женщинами выясняется, что большинство из них не знает, что такое регулярный цикл и когда действительно необходимо вмешательство врача. В разделе 8.4, посвященном менструальному циклу, этот вопрос частично обсуждался. В разделе 8.4.5 «Регуляция менструального цикла» упоминалось о факторах, влияющих на регулярность цикла. Современная женщина постсоветской страны сталкивается с выраженной гинекологической и акушерской агрессией, идет на поводу у страха, потому что практически ничего не знает о нормах функционирования собственного тела. Сравнив свои «показатели» с описанием идеальности всего «женского» в публикациях, которые копируют тексты старых учебников по гинекологии, женщина впадает в настоящую панику при задержке менструации в 1–3 дня. Она мчится к врачу, чтобы чаще всего попасть в руки человека, который воспользуется ситуацией и направит женщину на дорогостоящее обследование, придумав целую комбинацию (букет) всевозможных популярных диагнозов и назначив гору ненужного и даже опасного лечения. В жизни постсоветских женщин существуют следующие сценарии «нерегулярности менструального цикла», или «гормонального дисбаланса», которые требуют внимания читателей, чтобы они не столкнулись с такими сценариями в своей собственной жизни: 1. Подросток (12–18 лет), у которого сплошные нагрузки (уроки, тренировки, танцы, музыка, факультатив иностранного языка и т. д.), первая любовь, непонимание родителей, недосыпание из-за переживаний и сидения за компьютером по ночам, страх перед «лишним весом», а поэтому эксперименты с недоеданием, после отсутствия менструации в 1–3 месяца решается рассказать матери о своих проблемах. Поход к врачу заканчивается «страшными» диагнозами: поликистоз яичников, гормональный дисбаланс, гиперандрогения, дальше идет перечисление «страшных» последствий в случае непроведения срочного лечения. А какого лечения? Обычно гормональные контрацептивы, Диане-35, прогестерон (дюфастон), что не только не помогает, но и нарушает функцию репродуктивной системы еще больше. 2. Молодая худая женщина, постоянно беспокоящаяся о своей фигуре, ничего толком не знающая о строении и работе своих репродуктивных органов, у которой менструальные циклы в пределах 35–45 дней, приходит на осмотр к врачу, чтобы столкнуться с массой диагнозов: «эрозия», поликистоз, прогестероновая недостаточность, гипоплазия матки, эндометриоз/аденомиоз и т. д. Женщинам, планирующим беременность, назначают контрацептивные схемы гормонов и запрещают беременеть в течение длительного периода времени для «регуляции цикла», чтобы «яичники отдохнули», а потом их «запустят заново». Женщинам, не планирующим беременность, тоже назначают гормональные препараты, все для того же «отдыха яичников». Иногда этих препаратов так много, что в менструальных циклах вообще наступает настоящий хаос. Хуже всего, когда пользуются препаратами, вызывающими искусственную менопаузу. 3. Женщина в послеродовом периоде, кормящая грудью или только-только завершившая грудное вскармливание, активно «вертящаяся» вокруг ребенка (детей), недосыпающая, всегда беспокоящаяся обо всех и обо всем, обращается к врачу по поводу того, что у нее нет регулярных менструальных циклов. Одинаковое лечение на все случаи жизни — прогестерон или гормональные контрацептивы. 4. Женщина молодых или средних лет, решившая перед летним отпуском резко сбросить лишний вес, поэтому воспользовавшаяся «чудо-диетой» вкупе с горой «чудо-препаратов» для похудения. После потери 15 кг в течение 1–1.5 месяца сталкивается с проблемой отсутствия менструации (2–6 месяцев). Ей ставят «поликистоз яичников», аденомиоз, недостаточность прогестероновой фазы и назначают обычно дюфастон в качестве лечения или гормональные контрацептивы. 5. Женщина 40–45 лет пожаловалась врачу, что ее месячные стали нерегулярными, и вышла из кабинета специалиста ошарашенная букетом диагнозов: аденомиоз, поэтому нужно выключать менструальный цикл полностью, лейомиома, а значит, нужно удалять матку, гиперплазия эндометрия — выскабливать, выскабливать и еще раз выскабливать, и в придачу «поликистоз». Конечно же, без дюфастона или утрожестана из кабинета врача она уже не выйдет, но также ей предложат «Мирену», (потому что врач за продажу гормональной системы получит вознаграждение), и другие лекарства. Таких сценариев много, но обычно все они заканчиваются назначением одних и тех же гормональных препаратов, среди которых всегда есть прогестерон (прогестины) или гормональные контрацептивы. Когда женщины обращаются к врачам с жалобами на нерегулярность менструального цикла, в постановке правильного диагноза упускаются четыре важных фактора: • возраст, • пропорция веса и роста, • наличие стресса, • наличие других заболеваний. Очень часто ставится диагноз «нарушение гормонального фона», что вообще не является диагнозом. Какое именно нарушение? Каких именно гормонов? Почему гормональный фон нарушен? Когда женщина приходит к врачу, ее практически никто не спрашивает об отношениях с мужем, о каких-то проблемах на работе или в семье, о перенесенном стрессе (смерть родных, потеря работы, дорожно-транспортное происшествие, болезнь ребенка и т. д.). Никто не смотрит на ее вес и рост, хотя комплекция видна невооруженным глазом, никто не уточняет, сидела ли она на жестких диетах и ходила ли в спортзал, чтобы сбросить вес. Однако услышав жалобу о нерегулярности цикла или продолжительных циклах, женщину тут же посылают на УЗИ, результаты которого будут звучать туманно, но чрезвычайно традиционно: «Отсутствие доминирующего фолликула, поликистозные яичники, гиперплазия эндометрия». И появятся в истории такой женщины диагнозы «синдром поликистозных яичников», «гиперплазия эндометрия», «ановуляция», «гипоплазия матки», «нарушения гормонального фона» и ряд других, но ни одного правдивого. И принимает женщина лечение (прогестерон или КОК) — менструальные циклы регулярные. Прекращает лечение — снова начинается «нарушение гормонального фона» и серьезные сбои цикла. И снова все по кругу. Практически единицы врачей спросят, планирует ли женщина беременность. Даже если она и планирует, ее вынудят сидеть на контрацептивных схемах лечения, о чем она может и не подозревать, потому что ничего не знает о действии гормонов (того же прогестерона). Проблема неправильной постановки диагноза и, соответственно, неправильного назначения лечения является основной проблемой, наблюдаемой в гинекологии многих стран. Практически никто не объясняет женщине, что прием гормональных контрацептивов или гормонов (и чаще всего по контрацептивной схеме) не является лечением, а таким назначением создаются регулярные кровотечения отмены — ничего более. Натуральный гормональный фон замещается приемом экзогенных гормонов, синтетических или биоидентичых. Яичники при этом не отдыхают — объяснение об «отдыхе» является чрезвычайно абсурдным. Их функция просто подавлена, и как раз подавление функции не означает, что это полезно для женского организма. Нерегулярность менструального цикла — это не диагноз. Это всего лишь один из симптомов, который может наблюдаться как при патологических состояниях и заболеваниях, так и в норме, но при определенных условиях. Если нерегулярные циклы сопровождаются регулярной овуляцией, у таких женщин нерегулярность может быть вызвана другими сопутствующими заболеваниями (например, щитовидной железы, желудочно-кишечного тракта). Кроме того, необходим анализ режима питания, работы, отдыха, устранения стрессов. Всегда важно выявить связь между нерегулярностью менструального цикла женщины и нормальным функционированием ее организма, то есть вызывает ли нерегулярность цикла серьезный дискомфорт, планирует ли женщина беременность или, наоборот, заинтересована в предохранении от нее. И уже исходя из этого выбирать тактику ведения такой женщины.10.2. Прогестерон и предменструальный синдром
Почему у женщин перед менструацией появляются жалобы на плаксивость, эмоциональность, раздражительность, смену настроения, повышенную утомляемость, бессонницу и другие симптомы со стороны нервной системы и психики? Обычно у женщин, принимающих гормональные контрацептивы и у которых отсутствуют овуляции, такая зависимость психоэмоционального фона от месячных не наблюдается. Речь идет о так называемом предменструальном синдроме, о котором ведутся споры между врачами уже несколько десятилетий, и этот синдром включает более 100 признаков-жалоб. Такое разнообразие жалоб приводит к тому, что до сих пор нет четких диагностических критериев постановки диагноза. Что считать в таком случае нормой, если чуть ли не каждая женщина может пожаловаться на то, что у нее было «предменструальное состояние», сопровождающееся дискомфортом и рядом жалоб? Почему об этом синдроме обычно говорят в случаях двуфазности цикла, то есть связывают появление симптомов с наличием регулярной овуляции? Ведь регулярная овуляция — это прекрасная норма функционирования женского организма. Чтобы ответить на эти вопросы, необходимо понимать значение второй фазы менструального цикла, когда уровень прогестерона повышается — значительно выше, чем эстрогенов и других гормонов. Чаще всего женщины начинают жаловаться на проявление предменструального синдрома со второй половины лютеиновой фазы, за несколько дней до начала менструации, когда уровень прогестерона постепенно понижается до минимума, что приводит к появлению менструального кровотечения. Считается, что около 80 % женщин репродуктивного возраста испытали в своей жизни хотя бы один симптом предменструального синдрома, но можно смело утверждать, что все 100 % женщин имели минимум один признак изменений со стороны психоэмоционального состояния и изменений на уровне физического тела перед менструацией. Но далеко не все женщины воспринимают такие признаки как отклонения от нормы, поэтому обычно не жалуются. Клинические исследования показали, что проблема зарыта чаще всего на уровне сознания: как сама женщина воспринимает свои менструации, потому что 80 % женщин избавляются от жалоб после применения плацебо (пустышки). Другими словами, большинство женщин сами создают зависимость от психоэмоциональных страданий и разного рода лечения. Если девочке-подростку, ожидающей первую менструацию, объяснить, как может проявляться подготовка тела к менструации и какие симптомы могут быть с началом менструального кровотечения, ее восприятие периода менструации будет совершенно другим — более спокойным, без лишних страхов (что доказано проведением клинического исследования). Но чаще всего девушки невежественны в вопросах собственного здоровья, поэтому знания и опыт они получают с течением жизни, и далеко не из достоверных источников. То же самое можно сказать и о климактерическом периоде: менопауза стала «страшной болезнью» для женщин развитого общества, в основном белой расы, в котором вопросы «натуральности» или «природности» изменений в женском организме с возрастом обсуждаются редко, а зависимость (фактически психологическая) от разного рода лекарств достигла катастрофического уровня. Впервые предменструальный синдром был описан двумя английскими врачами, Катариной Далтон и Рэймондом Грином, в 1953 году. Др. Далтон на собственном примере описала состояние предменструальной мигрени, которую она успешно лечила инъекциями прогестерона. Комбинация же прогестерона с эстрогеном усиливала проявление мигрени, как и оральные контрацептивы. Чем выше доза эстрогенного компонента в контрацептивах, а точнее, чем выше пропорция между количеством эстрогена и прогестина (прогестерона) в контрацептивах, тем чаще появляются головные боли. Точная частота предменструального синдрома с выраженными клиническими симптомами неизвестна, и в разных публикациях имеются разные данные: от 3–8 % до 13–20 % случаев. Чрезвычайно (экстремально) выраженный предменструальный синдром называют предменструальным дисфорическим расстройством.10.2.1. Признаки предменструального синдрома
Определение и постановка диагноза предменструального синдрома страдают неточностью, так как он может проявляться по-разному. Чаще всего женщины жалуются на следующие симптомы: • со стороны кожи: акне, жирность • со стороны ЖКТ: запоры, диарея, тошнота, рвота; сильное желание приема определенных видов пищи (шоколад, соль, сахар, сладкие блюда, острые блюда, пряности) или, наоборот, отвращение к ряду продуктов, метеоризм, потеря аппетита или повышение аппетита • со стороны мышечно-скелетной системы: боль в суставах, боль в мышцах, судороги в ногах, боль в пояснице, боль в крестце, боль внизу живота • со стороны молочных желез: отечность груди, болезненность, выделения из сосков • со стороны общего состояния: повышенная усталость, низкая работоспособность, слабость, головокружение, бессонница, головные боли, чувство тяжести в теле, особенно внизу живота, чувство отечности, частое потение, чувство холода в теле • со стороны психики и нервной системы: тревога, раздраженность, чувство энергетического истощения (реже — прилива энергии), депрессия, апатия, безысходность, плаксивость, лабильность настроения, плохая концентрация внимания, печаль, напряжение, ухудшение памяти. При наличии такого большого количества симптомов диагностика предменструального синдрома является сложным процессом, и чаще всего женщина обращается не к гинекологу, а другим специалистам, которые ставят диагнозы, не замечая связи с цикличностью появления симптомов. Например, при болях в пояснице или в шейном отделе позвоночника хирург или вертебролог «обнаружит» проблемы дисков или остеохондроз. Маммолог «прицепится» к мастопатии и назначит лечение, которое может кардинально нарушить менструальный цикл, но не избавит женщину от жалоб. Психиатр найдет депрессию и «посадит» женщину на антидепрессанты. Гастроэнтеролог увидит в жалобах кишечный «дисбактериоз» или синдром раздраженного кишечника. Невропатолог будет лечить невроз. Эндокринолог назначит гормональные контрацептивы (обычно старый препарат Диане-35), чтобы избавить женщину от акне, что большинству не поможет. И наконец, гинеколог вспомнит об эндометриозе, ставшим модным коммерческим диагнозом в постсоветских странах, и подавит функцию яичников серьезными лекарственными препаратами, игнорируя желание женщины иметь детей и вызывая искусственную менопаузу, а некоторые начнут тщательно искать очаги эндометриоза в животе, проводя лапароскопию чуть ли не всем подряд с жалобами на боль внизу живота перед менструацией. Если женщина обратится сразу к нескольким специалистам, у нее есть шанс собрать целый букет «распространенных заболеваний», от которых она будет избавляться долго и безрезультатно, до родов, а иногда и до начала менопаузы. Учитывая такое большое количество признаков предменструального синдрома, женщинам и врачам необходимо понять, что эти симптомы встречаются и у совершенно здоровых женщин, поэтому не являются теми диагнозами, которые выставляются чаще всего ошибочно. Только у небольшого количества женщин один или несколько симптомов могут быть выраженными, создающими дискомфорт и вызывающими страдания. Очень редко жалобы могут отмечаться в фолликулярной фазе цикла с их развитием и увеличением перед месячными. Однако в таких случаях как раз и важно исключить разные заболевания, потому что менструальный цикл и возникновение менструаций могут быть вторичными, а заболевание — первичным.10.2.2. Особенности протекания предменструального синдрома
Несмотря на то, что даже здоровые женщины испытывают разные симптомы перед менструацией, чаще всего количество и интенсивность проявления симптомов не имеют строгого паттерна. Это означает, что в одном цикле болезненность груди может быть больше, в следующем — меньше, в третьем — появится вздутие живота и боль в пояснице, в четвертом — могут быть боли внизу живота и часто с одной стороны, что неопытный врач назовет «хроническим аднекситом» или, еще хуже, «внематочной беременностью» и направит женщину на лапароскопию без всякой правильной диагностики беременности. Хотя циклы могут быть относительно регулярными (21–35 дней), по количеству признаков предменструального состояния они могут быть совершенно разными — от нормальных, без всяких жалоб, до выраженных жалоб, которые могут ввести женщину в настоящую панику. В большинстве случаев предменструальный синдром не является диагнозом. Клиническими исследованиями также доказано: чем больше женщина ждет менструацию и чем больше «прислушивается» к изменениям в своем теле, тем больше выражены симптомы перед менструацией. Причина такого ажиотажа в ожидании менструации может быть разной: одни женщины с нетерпением ждут задержки менструации, а значит беременности, а другие, наоборот, боятся оказаться беременными. Исследования также показали, что, если женщина не понимает фазности цикла, но ей сказать, что она находится в предменструальном периоде (хотя у нее другой период цикла), у нее возникают типичные предменструальные синдромы, что означает, что большинство жалоб женщин зависят от того, как они сами воспринимают свое состояние и что они думают, чего боятся, чего ожидают.10.2.3. Механизм возникновения предменструального синдрома
При рассмотрении лютеиновой фазы и периода возникновения предменструальных симптомов оказывается, что у небольшого количества женщин жалобы могут появляться сразу же после овуляции. Но у большинства женщин максимальное количество жалоб наблюдается с началом падения уровня прогестерона.
Интересно, что более ранние исследования (80–90-е гг. прошлого века) показали отсутствие взаимосвязи между возникновением предменструальных симптомов и уровнем прогестерона. Но оказалось, что определение уровня этого гормона имело некоторые погрешности, в том числе неудачно выбранные дни менструального цикла для проведения теста. Более поздние исследования показали, что у женщин с менее выраженными предменструальными симптомами, а также с меньшим чувством тревоги и страха, уровень прогестерона был выше на протяжении всего менструального цикла, то есть в обе фазы цикла, по сравнению с контрольной группой. Симптомы чаще всего возникают за 5 дней до начала менструации. Это приблизительно 23-й день при 28-дневном менструальном цикле. Если женщина не беременна или плодное яйцо к этому времени уже погибло, желтое тело перестает функционировать, продукция прогестерона понижается, и как раз с 23-го дня начинают развиваться предменструальные симптомы. Таким образом, сначала наблюдается выработка максимального количества прогестерона, и повышение уровня может быть значительным. Но после этого повышения, если перед этим не произошло зачатие и не началась имплантация, уровень прогестерона начинает быстро понижаться. И как раз в период понижения появляются признаки предменструального синдрома. Как только появляются кровянистые выделения, то есть менструация, практически все признаки исчезают. Если женщина беременна, желтое тело продолжает свою активность еще в течение двух недель и потом его функция постепенно понижается. Фактически женщины с предменструальным синдромом при наступлении беременности могли бы заметить разницу в отсутствии многих признаков, но чаще всего этот момент упускается и начинается период страхов и паники с обнаружением беременности после задержки менструации. Важно не путать болезненные менструации, что называется альгодисменореей (дисменореей), с предменструальным синдромом. Альгодисменорея встречается у многих молодых женщин и девушек, и, хотя она имеет строгую связь с двуфазностью цикла, механизм развития этого состояния зависит от накопления в тканях матки простагландинов и других веществ, участвующих в сокращениях матки, в отслойке эндометрия и выведении его из полости матки наружу.
10.2.4. Нейростероиды
Понижение уровня прогестерона и его метаболитов не являетсяединственным механизмом возникновения предменструального синдрома. Скорее всего, комплексное изменение уровня ряда веществ, и особенно их пропорций, играет важную роль в возникновении жалоб перед месячными. Здесь следует вспомнить о нейростероидах. Эти вещества — продукты обмена прогестерона и кортизола, которые также могут быть синтезированы из холестерина в клетках мозга. У женщин основным источником нейростероидов является прогестерон, который усваивается мозговой тканью. Обмен прогестерона вне репродуктивной системы называется периферическим метаболизмом. Нейростероиды очень важны для нормального функционирования центральной нервной системы. Они взаимодействуют со специальными рецепторами нервной системы (GABAА-рецепторами) и могут оказывать точно такое же влияние, как алкоголь, снотворные (барбитураты), некоторые антидепрессанты, то есть они действуют как успокаивающие, противосудорожные и расслабляющие средства. Метаболиты прогестерона действуют так же. Известно, что аллопрегнанолон, метаболит прогестерона, обладает сильным противоболевым действием, в 6–8 раз сильнее пентобарбитала, который широко используется для лечения эпилептических судорог, как обезболивающий препарат в анестезии. Пентобарбитал также применялся для приведения в исполнение смертных приговоров в США, в ветеринарии для обезболивания и усыпления животных, а также до сих пор применяется для эвтаназии в ряде стран. GABAА-рецепторы являются бимодальными, то есть могут вызывать противоположную реакцию, которая зависит от дозы «раздражителя». Низкие дозы нейростероидов вызывают не успокоительное действие, а, наоборот, раздражение, агрессивность, которая может проявляться неадекватным поведением человека. Именно низким уровнем прогестерона перед менструацией, что необходимо для начала отслойки эндометрия и маточного кровотечения, объясняются многие психоэмоциональные симптомы женщин и жалобы на нервную систему.10.2.5. Нейростероидный парадокс
В женском организме наблюдается нейростероидный парадокс, который является загадкой для многих ученых. Он состоит в том, что GABAA-рецепторы, которые являются модуляторами аллопрегнанолона и алкоголя, при высоких дозах прогестерона в крови женщины не должны вызывать негативные реакции. Однако предменструальные негативные симптомы появляются не в первой фазе, когда уровень прогестерона относительно невысокий, а на высоком уровне прогестерона — в начале второй половины лютеиновой фазы. Такую парадоксальную реакцию можно объяснить блокировкой рецепторов на пике высокого уровня прогестерона и его метаболитов, из-за чего они становятся нечувствительными к нейростероидам в течение некоторого времени. Седативный и расслабляющий эффект аллопрегнанолона осуществляется через увеличение открытых каналов ионов хлора, что ведет к угнетению нейронной проводимости. Но практически существует ограничение количества ионных каналов, как и скорости пропуска ионов через них. Пик прогестерона в середине лютеиновой фазы может привести к максимальному открытию канальцев, что может заблокировать их работу от перенасыщенности ионами (как это, например, происходит при обмене кальция в ЖКТ). Возможно, существует определенное ограничение для количества открытых канальцев, то есть организм контролирует обмен хлора в нервной системе лимитацией «открытых дверей» или же уменьшением скорости обмена. Заблокированные рецепторы могут оказаться «вне действия» на какой-то период времени, что будет принято нервной системой как дефицит прогестерона и его метаболитов, а поэтому появятся симптомы, характерные для нехватки нейростероидов. Фактически такое состояние можно назвать «отравлением прогестероном» и реакцией женского организма на повышение его уровня в крови женщины в середине второй фазы цикла. Похожая ситуация возникает при употреблении алкоголя. Известно, что прием небольшого и умеренного количества алкоголя может спровоцировать агрессивное поведение у некоторых людей, но чаще всего оказывает успокаивающий, расслабляющий эффект. Обычно агрессивное поведение чаще наблюдается при поглощении больших доз алкоголя или как похмельный синдром. От 2.5 % до 5.4 % людей могут быть агрессивными после инъекции амобарбитала натрия. То есть реакция нейрорецепторов зависит от дозы и продолжительности воздействия вещества-модулятора, что проявляется совершенно противоположными реакциями в поведении человека (и животных тоже). GABAA-рецепторы имеют очень сложное строение и подразделяются на несколько классов, поэтому могут реагировать на определенные молекулы, вызывая разную реакцию в нейронах. Другими словами, реакция этих рецепторов зависит не только от дозы вещества, но и от вида вещества, с которым они реагируют. Комбинация веществ также может вызывать разную реакцию. Например, эксперименты на животных показали, что разные комбинации алкоголя и метаболитов прогестерона приводят к разному воздействию на поведение животных — от спокойствия до выраженной агрессии. И не секрет, что поведение женщины, принимающей алкоголь в одной и той же дозе после месячных и перед ними, может кардинально отличаться и эмоциональным фоном, и поступками, и реакцией на людей и окружающий мир. Так как воздействия алкоголя и нейростероидов на центральную нервную систему имеют много общего, почему бы не рассматривать предменструальный синдром не просто как реакцию на понижение уровня прогестерона, а как синдром отмены, или «похмелья», который наблюдается и после интоксикации алкоголем, то есть принятия большой дозы спиртных напитков. Не у всех людей возникает похмелье после принятия большой дозы алкоголя, и не у всех женщин наблюдаются предменструальные симптомы. И, наоборот, у ряда людей похмелье может выражаться чрезвычайно агрессивным поведением и жалобами на физическое состояние. Точно так же у небольшого количества женщин предменструальные жалобы переходят в состояние предменструального дисфорического расстройства, которое может сопровождаться и агрессивностью, и раздражительностью, и низкой работоспособностью.10.2.6. Предменструальное дисфорическое расстройство (ПМДР)
Предменструальный синдром (ПМС) не признается заболеванием, то есть не является диагнозом, а считается физиологической нормой в жизни женщин репродуктивного возраста. Однако у 3–6 % менструирующих женщин симптомы настолько выражены, что говорят о предменструальном дисфорическом расстройстве (ПМДР). Такие женщины жалуются на сильные перепады настроения, раздражительность, злость, агрессивность, что может также сопровождаться жалобами на физическом уровне — напряжение и отечность молочных желез, выраженная болезненность молочных желез, метеоризм, ощущение тяжести внизу живота. Предменструальное дисфорическое расстройство сопровождается также низкой работоспособностью, быстрой утомляемостью, особенно со второй половины цикла. Хотя жалобы и симптомы ПМДР начинают появляться на пике выработки прогестерона и его метаболитов, однако максимума в проявлении они достигают в дни понижения прогестерона, то есть перед менструацией. Поэтому предполагается, что в поздней лютеиновой фазе женщины страдают от нехватки нейростероидов, которая проявляется предменструальными симптомами. Предменструальное дисфорическое расстройство поначалу входило в группу депрессивных расстройств, тем более что состояние тревоги и раздражительности часто встречается у многих женщин перед месячными. Нередко женщин называют паникершами, ссылаясь на их «вечные страхи» по поводу и без повода. В реальности паническое расстройство, которое входит в группу расстройств, связанных с регуляцией системы тревоги, встречается у женщин в два раза чаще, чем у мужчин. Гормональные колебания, связанные с изменениями в яичниках во время менструального цикла, взаимосвязаны с появлением и развитием многих расстройств психики, в том числе состояния паники. Предменструальное дисфорическое расстройство оказывает серьезный негативный отпечаток на жизнь женщины, увеличивая количество дней нетрудоспособности, ограничивая социальную жизнь и общение с другими людьми. Существует также связь между выраженным предменструальным синдромом и повышенной частотой алкоголизма, курения и ожирения. Также, у таких женщин чаще наблюдаются психические расстройства и суицид. И, наоборот, у женщин, страдающих разными психическими заболеваниями, менструальный цикл влияет на проявление симптомов и обострение заболеваний, что обычно наблюдается перед менструацией. Например, 64 % женщин, проходящих лечение от депрессии, отмечают, что перед менструацией симптомы депрессии у них увеличиваются; более половины женщин с фобиями отмечает ухудшение состояния и повышение уровня тревоги перед месячными; у 33 % женщин увеличивается частота панических атак перед менструацией. Влияют ли социальный статус и условия жизни на протекание предменструального периода и частоту появления ПМДР? Оказывается, влияют. По сравнению с одинокими и разведенными женщинами замужние женщины реже жалуются на предменструальный синдром. Также у женщин средних социальных слоев предменструальный синдром встречается реже, чем у женщин бедных слоев. Индивидуальная реакция женщин на окружающий мир, стрессовые ситуации значительно влияют на появление симптомов перед месячными: больше страдают те женщины, которые испытывают постоянное беспокойство, тревогу, страх, негативные эмоции, плохо реагируют на стрессовую ситуацию. Эмоциональная травма из-за плохих отношений с близкими людьми, постоянных ссор, смерти или болезни близкого человека также приводит к ухудшению предменструальных симптомов и даже развитию ПМДР. Многие врачи считают, что именно стресс является основной причиной возникновения ПМДР.10.2.6.1. Диагностические критерии постановки ПМДР
Когда мы говорим не о нормальном протекании предменструального состояния, а ставим диагноз ПМДР? • Симптомы имеют выраженную цикличность и приводят к частичной потере трудоспособности • Признаки и жалобы появляются со второй половины менструального цикла, то есть после менструации, и интенсивно нарастают перед менструацией • Симптомы должны быть выражены не меньше одной недели перед менструациями • Признаки проходят с наступлением менструации и отсутствуют в течение минимум одной недели после завершения менструации • Предменструальные симптомы практически не ухудшаются с количеством менструальных циклов, то есть не прогрессируют до худшего по качеству состояния • Должно быть не меньше 5 признаков для большинства менструальных циклов в течение 12 месяцев • Одним из постоянных симптомов должно быть подавленное настроение, или тревога/напряжение, или выраженная эмоциональная лабильность, или злость/раздражение • Симптомы значительно влияют на отношения с другими людьми, учебу/работу, на регулярную активность женщины • Признаки и жалобы не являются частью другого психического расстройства Такие критерии диагностики помогают исключить случаи, когда обследование и агрессивное лечение будут лишними. Нередко к врачам обращаются женщины, у которых появляются жалобы, характерные для предменструального синдрома, впервые в жизни (чаще всего это девушки и молодые женщины). И нетерпение проявляют обычно не женщины, а врачи, которые тут же направляют женщину на объемное дорогостоящее обследование. И одновременно назначают объемное дорогостоящее лечение: от хронического аднексита, уреаплазмоза, спаечного процесса чуть ли не последней степени, «эрозии» шейки матки, эндометриоза, мастопатии, что обычно вызывает массу побочных эффектов и увеличивает страдания женщины, потому что «лечение» приходится повторять не один раз. Как отличить, что у женщины не доминирует расстройство психики, а имеются признаки ПМДР? Чтобы не оказаться жертвой собственной паники и врачебной ошибки, каждая женщина с жалобами на предменструальный синдром должна наблюдаться в течение нескольких месяцев. А также вести дневник жалоб и симптомов — каждый день от начала менструального цикла и до его конца проводить запись того, что она ощущает. А еще записывать важные события, которые могут повлиять на ее психоэмоциональное состояние или функцию тела (например, крупная ссора, переутомление, недосыпание, прием алкоголя, травма и т. д.) в течение 2–3 месяцев подряд. Хотя психические заболевания могут усугубляться предменструальным состоянием, однако жалобы будут существовать в течение всего менструального цикла. При ПМДР существует «окно» отсутствия жалоб в течение не менее семи дней после окончания менструации.10.2.7. Лечение предменструального синдрома
Все проведенные за последние несколько лет клинические исследования показали, что любой метод лечения предменструального синдрома оказывает плацебо-эффект. Поэтому предменструальный синдром перестал считаться диагнозом. С появлением прогестерона стало модным назначать его при ПМС. Однако, как показывают исследования, ни кратковременное, ни длительное применение прогестерона ситуацию не улучшает. Интересно, что назначение прогестерона во второй половине цикла для лечения предменструального синдрома не имеет научных обоснований, а является всего лишь теоретическим предположением, что женщины с ПМС страдают недостаточностью лютеиновой фазы. Но в реальности предменструальный синдром не является признаком недостаточности второй фазы. Большинство современных врачей считает, что в 80 % случаев от предменструального синдрома можно избавиться корректировкой питания и образа жизни. Недостаточность лютеиновой фазы при предменструальном синдроме не наблюдается, потому что уровень прогестерона, когда появляются признаки (а они появляются за несколько дней до месячных) все еще высокий. Ведь пик прогестерона наблюдается обычно на 7-й день после возникшей овуляции, при 28-дневном цикле — это 21–22-й день. На фоне менструации отмечаются самые низкие показатели эстрогенов и прогестерона, тем не менее, с наступлением кровотечения все предменструальные симптомы обычно исчезают. Для улучшения состояния женщинам чаще всего достаточно объяснить, почему возникают предменструальные симптомы и как повысить качество жизни с помощью сбалансированного здорового питания, физической активности, использования антистрессовых программ, медитации, релаксации. Лечение предменструального дисфорического расстройства требует индивидуального подхода: в зависимости от жалоб и признаков в качестве лечебных препаратов могут быть использованы успокоительные средства, антидепрессанты, обезболивающие, прогестерон, психотерапия, гипноз и другие альтернативные психотерапевтические методы. Исследования показали, что ановуляторные циклы практически не сопровождаются симптомами, связанными со сменой настроения, негативными эмоциями и другими негативными жалобами на состояние психики. Исключение составляют женщины, которые очень сильно хотят забеременеть, поэтому нетерпеливы и раздражительны из-за страха разочарования от того, что они не беременны. Такие женщины создают искусственный ажиотаж вокруг своего состояния, чрезмерно прислушиваются к своему телу, фактически вызывая ложную беременность, которая тоже может проявляться болезненностью и отечностью молочных желез, болями внизу живота, задержкой менструации. Ановуляторные циклы не имеют фазности, потому что именно созревание и выход яйцеклетки, что является овуляцией, делит менструальный цикл на две фазы. Так как лютеиновой фазы тоже нет из-за отсутствия желтого тела, подъема и падения прогестерона не наблюдается. Поэтому подавление овуляции разными лекарственными препаратами может использоваться как один из методов лечения ПМДР. Практически все комбинированные оральные контрацептивы подавляют овуляцию, создавая ановуляторный цикл, поэтому у женщин, принимающих КОК, предменструальный синдром не наблюдается. Назначение лекарственных препаратов, которые могут подавлять желтое тело (гонадотропин-рилизинг гормоны), тоже устраняет предменструальные симптомы. Бусерилин, который нередко используют для создания искусственной менопаузы (аменореи), также успешно применяется в небольших дозах во второй фазе для лечения предменструального дисфорического расстройства. При этом уровень эстрогенов остается без изменения, что важно, если женщина хочет сохранить овуляцию, то есть двухфазность цикла. Однако в реальности наблюдается злоупотребление этими препаратами, когда врачи просто выключают репродуктивную функцию под предлогом якобы «необходимого отдыха для яичников». Такой подход чреват серьезными нарушениями менструального цикла, а также совершенно неэтичен, если женщина планирует беременность. Нередко предменструальный синдром исчезает после беременности и родов. Врачи старшего поколения часто советуют женщинам с предменструальными симптомами и болезненными менструациями забеременеть и родить, и в таком совете действительно есть определенная рациональность. Беременность выключает овуляцию на 9 месяцев, а дальше у женщины наблюдается несколько месяцев послеродовой аменореи, что лишает ее предменструального синдрома на длительный период времени. Переключение внимания на заботу о подрастающем поколении (психологический фактор) приводит к тому, что женщина обращает меньше внимания на свои ощущения. Довольно часто она просто забывает о своих «болячках» на какой-то период времени.10.3. Прогестерон и ановуляция
На страницах этой книги уже не раз упоминалось такое состояние, как ановуляция — это отсутствие овуляции или, другими словами, отсутствие разрыва фолликула, при котором происходит выход яйцеклетки для последующего ее оплодотворения. Женщины, планирующие беременность, боятся ановуляции как огня, потому что обычно первый же визит к врачу заканчивается походом на УЗИ и заключением о «синдроме поликистозных яичников», потому что якобы отсутствует доминирующий фолликул, а значит, цикл ановуляторный. Существует ряд клинических признаков, по которым можно предположить, является ли цикл ановуляторным или овуляторным. Овуляторные менструальные циклы в основном регулярные, более стабильные по продолжительности, длительности месячных, по количеству выделений во время менструации. Другие признаки, которые часто ассоциируются с овуляцией, — боль внизу живота в середине цикла, усиленные влагалищные выделения в период овуляции, нагубание молочных желез перед менструацией, болезненные менструации, что редко наблюдается при ановуляторных циклах. Ановуляторные циклы обычно длиннее и обильнее. Ановуляция — довольно частое явление в жизни женщин, и практически каждая женщина имеет ановуляторные циклы в определенные периоды жизни. В подростковом периоде, когда появляются менструации, особенно в первые два года менструаций, в послеродовом периоде и перед менопаузой ановуляторные циклы являются нормальным явлением. После 35 лет у здоровых женщин наблюдается хотя бы один ановуляторный цикл, после 40 лет таких циклов может быть 2–3, после 45 лет — до 6 циклов в год. Хроническая ановуляция наблюдается у 10–15 % женщин репродуктивного возраста.10.3.1. Ановуляторные фолликулярные волны
В главах, посвященных созреванию половых клеток и овуляции, упоминалось, что у женщин могут наблюдаться две «фолликулярные» волны, а у небольшого количества женщин — три волны, которые способны завершиться дополнительной овуляцией в одном менструальном цикле. Оказалось, что такие волны могут завершиться не только овуляцией, но, наоборот, и ановуляцией. Ановуляторных фолликулярных волн тоже может быть несколько. 21 % всех наблюдаемых фолликулярных волн называются большими, потому что затрагивают развитие доминантного фолликула — попросту овуляция не происходит. Остальные 79 % ановуляторных фолликулярных волн называются малыми, потому что не связаны с наличием доминантного фолликула и могут быть в те периоды цикла, когда доминантного фолликула нет (например, во второй половине лютеиновой фазы). Таким образом, даже при наличии нормального изменения гормональных уровней около трети циклов может быть ановуляторными. Как отличить доминантный фолликул, который окажется ановуляторным, от овуляторного фолликула? Большая ановуляторная волна затрагивает фолликулы размерами 10–17 мм, в среднем около 13 мм. Чаще всего максимальные размеры таких фолликулов не превышают 17 мм. Это означает, что, если наблюдается нормальный рост доминантного фолликула и приблизительно с 13 мм рост прекращается, — такой признак характерен для ановуляции. Спонтанная овуляция наблюдается только у фолликулов больше 15 мм в диаметре. В дальнейшем, если овуляция не состоялась, такой фолликул может пройти лютенизацию (и на УЗИ обнаружат желтое тело) или атрезию (уменьшится в размерах и рассосется). Малые ановуляторные волны характерны для фолликулов 8 мм (7–9 мм). Если на УЗИ обнаруживают один или несколько таких фолликулов и их рост не наблюдается, это подтверждает наличие ановуляторной волны, что может завершиться возникновением ановуляторного цикла (обычно продолжительного) или же быть частью нормального овуляторного цикла, если такая волна наблюдается перед менструацией (во второй половине цикла). Между периодами овуляции (интеровуляторные периоды) может наблюдаться несколько волн фолликулярного развития, и причиной таких волн могут быть половые отношения (коитус), хотя такая связь между овуляцией и коитусом у женщин оспаривается. Но известно, что регулярная половая жизнь не подавляет овуляцию, то есть не является причиной ановуляторных циклов (если, конечно, женщина не вступает в половые отношения принудительно и такие отношения не сопровождаются выраженным негативным эмоционально-психическим стрессом).10.3.2. Причины возникновения ановуляции
Ановуляция возникает из-за нарушения гормонального баланса в функции яичников. Наиболее часто такое нарушение возникает в результате стресса, острого или хронического. Стресс — это для овуляции враг номер один. Факторы, которые влияют на регуляцию менструального цикла и которые были перечислены в ряде глав раньше, могут провоцировать ановуляцию, то есть нарушать овуляцию. Все причины можно разделить на группы, в зависимости от уровня поражения того или иного органа или системы органов. Согласно классификации Всемирной организации здравоохранения (ВОЗ) существуют три класса и несколько подклассов ановуляции. Мы не будем вдаваться в подробности этой классификации, а рассмотрим самые частые причины этого состояния. Гипоталамическая ановуляция наблюдается на фоне нарушений выработки определенных веществ гипоталамусом под воздействием факторов внешней среды (стресс, радиация, повышенная физическая активность) или системных заболеваний (анорексия, гипертония). При резкой потере веса возникает порочный круг дисбаланса, который очень трудно разорвать и привести работу гипоталамуса и яичников в норму. Тучность часто связана с ановуляторными циклами в результате накопления жировой тканью эстрогенов и андрогенов, и затруднений с выведением этих гормонов из организма. Это приводит к нарушениям выделения ЛГ, пик которого важен в возникновении овуляции. Заболевания щитовидной железы могут непосредственно влиять на работу яичников и процесс овуляции, а также стимулировать выработку пролактина. Гиперплазия коры надпочечников приводит к повышенному уровню андрогенов, что тоже отразится на процессе овуляции. У таких женщин также вырабатывается большее количество прогестерона. Синдром Кушинга может быть причиной ановуляции и дисфункциональных маточных кровотечений. Хроническая ановуляция ассоциируется с возникновением инсулиновой резистентности, повышенным уровнем инсулина, ранним появлением диабета (тип 2), нарушением уровня жиров в крови, развитием сердечно-сосудистых заболеваний и бесплодия. Больные астмой и принимающие противоастматические медикаменты могут иметь нерегулярные менструальные циклы в связи с анормальным уровнем половых гормонов. Применение ряда медикаментов (кортикостероиды, психотропные средства, морфин, резерпин, фенотиазиды, атропин, нейролептики и др.) может привести к ановуляции. У некоторых женщин ановуляция может наблюдаться после прекращения применения оральных гормональных контрацептивов. Всегда нужно помнить, что ановуляция — это не болезнь, а признак нарушений работы репродуктивной системы женщины. В США было проведено одно интересное исследование. Исключив женщин, у которых ановуляция была следствием анатомических дефектов репродуктивной системы или следствием яичниковой неполноценности, ученые обнаружили, что в 32 % случаев ановуляция вызвана нарушениями на уровне гипоталамуса, в 17 % случаев ановуляция возникла из-за повышенного уровня пролактина, и в 35 % случаев повышенный уровень андрогенов был причиной хронической ановуляции.10.3.3. Диагностика ановуляции
Универсального метода диагностики ановуляции не существует. Около 300 видов различных заболеваний, без учета генетических и хромосомных синдромов, могут сопровождаться ановуляцией, поэтому лабораторные методы диагностики и другие исследования будут зависеть от результатов опроса и осмотра женщины. Чрезвычайно важным моментом в постановке правильного диагноза является сбор информации о перенесенных заболеваниях. Перенесенные в прошлом хирургические вмешательства, инфекционные процессы, выскабливания полости матки могут быть причиной нарушений менструального цикла. Нужно также обращать внимание на внешний вид женщины, состояние органов репродуктивной системы, их строение и положение. Важно знать, какими заболеваниями страдает женщина, и какие медикаменты и другие виды лечения она принимает.10.3.4. Ановуляция и недостаточность прогестерона
Чаще всего уровень прогестерона определяют у женщин, страдающих редкими менструальными циклами, ановуляцией и аменореей, и самой распространенной врачебной ошибкой в таких случаях будет диагноз недостаточности лютеиновой фазы (прогестерона) и назначение дюфастона, утрожестана или других препаратов прогестерона. Важно знать, что ановуляторный цикл не сопровождается фазностью, потому что овуляции нет. Если нет овуляции, то нет желтого тела, поэтому пик прогестерона не наблюдается. Его уровень будет соответствовать уровню первой фазы, то есть он будет низким, но нормальным. Поэтому диагноз прогестероновой недостаточности при наличии ановуляции всегда будет ошибочным. Назначение прогестерона в таких случаях ановуляцию не устранит. Если его и назначают, то только на кратковременный период, чтобы после отмены вызвать искусственное кровотечение.10.3.5. Лечение ановуляции
Поскольку ановуляция — это симптом, а не заболевание, всегда важно установить причину ановуляции, то есть основное заболевание женщины, которое приводит к нарушению нормального менструального цикла. Так как заболеваний много, выбор лечения всегда индивидуален. Целью такого лечения часто будет не возобновление овуляции, а уменьшение влияния основного заболевания на протекание менструального цикла. К сожалению, многие врачи пытаются стимулировать овуляцию, не разобравшись до конца в проблемах женщины, что в большинстве случаев заканчивается безрезультатно или же может привести к синдрому гиперстимулированных яичников. Как показывают исследования, несмотря на редкие менструальные циклы и отсутствие менструации, такие женщины все же беременеют, особенно после правильного лечения. В одном из исследований лечение женщин с ановуляцией и аменореей проводили с помощью ФСГ индукцией овуляции. Только в 22 % менструальных циклов удалось получить беременность, в 19 % — беременность была подтверждена клинически определением уровня ХГЧ в крови. В 3 % циклов беременность была биохимической. Из всех клинически подтвержденных беременностей 87.5 % закончились рождением живого ребенка, что в целом привело к уровню рождаемости почти 17 % для всех стимулированных циклов. Однако, как показал анализ полученных данных, соотношение между клинической и биохимической беременностью не зависело от уровня лютеинового прогестерона до зачатия, а значит, соотношение потерь беременности в процессе имплантации, как и клинических беременностей после завершения имплантации, не различалось тоже. Клинические беременности чаще возникали при уровне лютеинизированного прогестерона выше 10 нг/мл. Возникновение биохимической беременности от уровня прогестерона не зависело. В предклимактерическом периоде, когда наблюдаются колебания гормонов, нередко женщины страдают расстройством менструального цикла, проявляющимся нерегулярными кровотечениями. Чаще всего эти кровотечения являются следствием ановуляторных циклов, а также при наличии полипов эндометрия, лейомиом и новообразований шейки матки. Как и при вторичной аменорее, в предклимактерическом периоде ановуляция приводит к образованию гиперплазии эндометрия. С целью лечения нерегулярных кровотечений, возникающих из-за ановуляции в предклимаксе, используют гормональные контрацептивы, а также прогестины. Прогестерон назначают обычно с 15-го дня цикла. Нередко требуется несколько циклов лечения, так как у многих женщин улучшение наблюдается после третьего менструального цикла. Однако с прекращением лечения у большинства женщин нерегулярные кровотечения возобновляются.10.4. Прогестерон и аменорея
Аменорея — это отсутствие менструаций в течение 6 месяцев и более. Существует аменорея физиологическая, то есть нормальная (беременность, послеродовый период, климактерический период) и патологическая, причин которой может быть множество. Также различают первичную и вторичную аменорею. Первичная аменорея определяется как отсутствие месячных в возрасте 14 лет при отсутствии вторичных признаков полового созревания (увеличение груди, оволосение лобка и др.) или отсутствие менструаций в 16 лет с нормальными признаками полового созревания. Вторичная аменорея — это прекращение менструаций и их отсутствие в течение 6 месяцев у женщин, у которых до этого были менструации (по другим определениям — более 3 месяцев). Если у девушки или женщины была хотя бы одна менструация (не вызванная искусственно), то исчезновение месячных будет называться вторичной аменореей. У около 5 % женщин месячные могут отсутствовать в течение 3 месяцев. Регулярные циклы являются показателем здоровья женщины. Поэтому нарушения менструального цикла в виде редких месячных или их отсутствия являются сигналом гормональных нарушений и дисфункции яичников. Половые гормоны играют важную роль в обмене кальция и других микроэлементов костной ткани, поэтому редкие менструации ассоциируются с двукратным увеличением количества переломов костей по сравнению с уровнями переломов у здоровых женщин. Около 10 % женщин с аменореей страдают преждевременным старением яичников.10.4.1. Причины аменореи
Основная причина аменореи — хроническая ановуляция, которая может возникать по многим причинам, но чаще всего на фоне стресса (физического, эмоционального, энергетического). В 60 % случаев первичной аменореи причиной является нарушение полового развития и общего развития (слишком низкий вес, анорексия, булимия), а в 40 % случаях — эндокринные нарушения, чаще всего на уровне гипоталамуса. Незрелость гипоталамо-гипофизарно-яичниковой системы регуляции менструального цикла приводит к задержке менархе и возникновению аменореи. Заболевания щитовидной железы, а также аденома гипофиза с повышенной выработкой пролактина тоже могут встречаться часто при первичной аменорее. При вторичной аменорее самыми частыми причинами ее возникновения являются резкие перепады веса тела, особенно его большая потеря (больше 10 % от общего веса в течение 3 месяцев), чрезмерные занятия спортом и большие физические нагрузки. У одной трети молодых женщин, занимающихся профессиональным спортом или имеющих большие физические нагрузки, менструальные циклы нерегулярные, чаще наблюдаются ановуляция и аменорея, проблемы с зачатием ребенка и вынашиванием беременности. У девочек-спортсменок менархе появляется позже, чем у их ровесниц, а также уровень первичных аменорей выше. Все другие причины (эндокринные, генетические, метаболические) встречаются редко. У женщин с аменореей показатели гормональных уровней чаще всего не в норме — низкие уровни ЛГ и ФСГ, а также эстрадиола. Измерение уровня прогестерона в таких случаях малоинформативно, потому что он тоже будет понижен.10.4.2. Лечение аменореи
При возникновении аменореи нарушается циклическая выработка эстрогенов, однако менструацию можно вызвать искусственно путем назначения и отмены прогестерона или прогестинов. Такое лечение не устранит основную причину аменореи и будет скорее «симптоматическим», но оно предотвратит гиперплазию эндометрия из-за постоянного влияния на него эстрогенов. Как показывают результаты исследований, у 95 % женщин менструальные циклы восстанавливаются в течение двух лет благодаря корректировке питания и образа жизни без применения лекарственных препаратов. Важно не назначать таким женщинам гормональные контрацептивы, которые создадут регулярные искусственные кровотечения отмены, но проблему не решат — после их отмены циклы останутся нерегулярными, и овуляция не восстановится. Назначение прогестерона также будет ошибкой — проявлением некомпетентности и просто нежелания анализировать ситуацию и искать причины аменореи. Исключив эндокринные и другие редкие причины аменореи, рассказав женщине о важности нормального веса, устранив стресс, можно ожидать восстановления менструаций. Чаще всего ждать еще несколько недель или месяцев не хотят не так женщины, как врачи. Измерение уровня эстрадиола может быть неплохим прогностическим фактором: если его уровень составляет> 110 пмоль/л (30 пг/мл), менструация появится в течение 3–6 месяцев. Для создания искусственного кровотечения при вторичной аменорее прогестерон обычно назначают в течение 10 дней. Чем выше доза прогестерона, тем лучше эффект. Исследования показали, что у 90 % женщин возникает искусственная менструация после принятия 300 мг прогестерона, у 58 % — 200 мг и у почти 30 % женщин, принимавших плацебо. Такой высокий процент женщин, у которых плацебо подействовало как лечебный препарат, говорит в пользу психического компонента аменореи — она чаще встречается у эмоционально неуравновешенных женщин и тех, кто не умеет адекватно реагировать на стрессовую ситуацию. Несмотря на то, что прием прогестерона вызывает у определенного количества женщин кровотечение отмены, все же концентрация его в крови женщин настолько разная, что это не позволяет найти оптимальную дозу прогестерона для получения кровотечения. Исследования также показали, что разницы в побочных эффектах среди женщин, принимавших прогестерон, в зависимости от дозы не наблюдалось. Существует золотое правило: перед назначением прогестерона и прогестинов необходимо исключить беременность. Исключение беременности означает не проведение коммерческого теста на беременность, а определение β-ХГЧ в крови женщины. Этому правилу необходимо следовать особенно при назначении 19-нопрогестинов, которые имеют тератогенный эффект. Но и в случае назначения прогестерона следует исключить беременность, потому что после курса высоких доз прогестерона может возникнуть кровотечение отмены, что в свою очередь может привести к нарушению имплантации, если лечение назначено на раннем сроке беременности.10.5. Прогестерон и синдром поликистозных яичников (СПКЯ)
Синдром поликистозных яичников стал коммерческим диагнозом в постсоветских странах, потому что его ставят почти всем подряд женщинам если не по результатам одного лишь УЗИ и обнаружению «поликистозных яичников», то по одному показателю незначительно повышенного уровня тестостерона или его метаболита. Отсутствие идеальных циклов в 28 дней (некоторые врачи считают циклы в 30–35 дней патологией) дополняет такой малограмотный подход. СПКЯ считается эндокринопатией, то есть гормонально-метаболическим заболеванием, проявляющимся на клеточном, тканевом и биохимическом уровнях. Основными признаками синдрома поликистозных яичников являются нарушения менструального цикла (цикл меньше 21 дня или больше 35 дней, меньше 9 циклов в год), отсутствие созревания яйцеклеток (ановуляция), повышенная волосатость (гирсутизм), акне. Из трех классических признаков синдрома поликистозных яичников — олигоменорея/аменорея, гиперандрогения и поликистозные яичники, последний признак исключен из американских диагностических критериев, потому что поликистозные яичники наблюдаются почти у трети здоровых женщин. К тому же, очень часто врачи, проводящие УЗИ и интерпретирующие результаты, не знают УЗИ-признаков синдрома поликистозных яичников, а ставят диагноз только из-за отсутствия доминантного фолликула. Действительно, при ановуляторном цикле или, когда овуляция запаздывает (цикл больше 28 дней), доминантный фолликул может отсутствовать в первые две недели цикла. Если учесть, что яичники имеют фолликулярное (кистозное) строение, то поликистозные яичники можно обнаружить довольно часто как нормальное строение яичников. Поэтому многие врачи предлагают переименовать синдром поликистозных яичников и назвать его метаболическим расстройством. Синдром поликистозных яичников является комплексным заболеванием, но имеет в большинстве случаев генетический компонент. Поэтому он чаще встречается у женщин определенных этнических и расовых групп (наиболее распространен СПКЯ среди женщин — выходцев из Южной Азии, проживающих в Европе). Самый важный признак этого заболевания — инсулиновая резистентность, которая встречается у преимущественного большинства женщин. Инсулин может нарушать овуляцию как прямым воздействием на фолликулы, повышая выработку мужских половых гормонов, так и через подавление выработки гонадотропин-рилизинг гормонов в гипоталамусе. Повышенный уровень ЛГ тоже стимулирует выработку андрогенов, а нехватка ФСГ приводит к тому, что нарушается процесс превращения андрогенов в эстрогены. Рост фолликулов при этом тормозится, а овуляция подавляется. Другой признак СПКЯ — это гиперандрогения, то есть повышенная выработка мужских половых гормонов. Гиперандрогения может проявляться по-разному, но чаще всего женщины жалуются на повышенное оволосение тела (гирсутизм), акне и очень редко — на облысение и усиленное выпадение волос. Некоторые врачи используют шкалу оценки роста волос в 9–11 частях женского тела (шкала Ферримана-Голлвея). Оценку оволосения по этой шкале легче проводить у женщин белой расы, но очень трудно у подростков, у которых повышенное оволосения в подростковом периоде является нормой. Нерегулярный менструальный цикл у женщин, которые завершили половое созревание, имеет связь с бесплодием, раком эндометрия и нарушением обменных процессов (диабет, нарушение обмена жиров, гипертония) в будущем. Интересно, что СПКЯ является единственным заболеванием, которое сопровождается аменореей, но при этом потеря костной ткани и возникновение остеопороза не наблюдается.10.5.1. СПКЯ и подростковый период
Синдром поликистозных яичников обычно появляется после завершения полового созревания, хотя его можно диагностировать и в подростковом возрасте. В отличие от физиологической нерегулярности менструальных циклов, СПКЯ у подростков сопровождается чаще первичной и вторичной аменореей. Также у таких девочек вес нормальный или имеется ожирение, и очень часто существует наследственная история (СПКЯ страдали матери и сестры). Несмотря на актуальность темы СПКЯ у взрослых женщин, до сих пор не существует диагностических критериев постановки этого диагноза у подростков (до 21–22 лет). Подростковый период сопровождается инсулиновой резистентностью, а также повышенными уровнями мужских половых гормонов, а на появление регулярных овуляторных циклов уходит несколько лет (в среднем 3–5, но нередко и до 7). Если у девочки низкий вес и она часто испытывает стресс (любой природы), регулярность цикла может не наблюдаться вплоть до полной половой зрелости (до 25–26 лет), однако такие девочки вскоре окажутся в кабинете врача и им будет поставлен диагноз синдрома поликистозных яичников и назначены гормональные контрацептивы. Многие врачи предлагают не спешить ставить диагноз синдрома поликистозных яичников у этой категории женщин в течение двух лет наблюдений, чтобы избежать гипердиагностики и необоснованного гормонального вмешательства, которое может нарушить созревание гипоталамо-гипофизарно-яичникового комплекса и привести к ухудшению ситуации.10.2.5. Вес новорожденной девочки и СПКЯ
В научной литературе имеется много противоречивой информации о взаимосвязи веса новорожденной девочки и возникновения СПКЯ в будущем. Одни исследования показали, что между низких весомы новорожденных девочек и СПКЯ существует связь — у таких девочек подъем мужских половых гормонов (адренархе) наблюдается раньше, чем у девочек с нормальным весом при рождении. Преждевременное адренархе приводит к отложению жировой ткани в области живота, бедер, молочных желез, а также появлению инсулиновой резистентности. Другие исследования, наоборот, опровергли такие данные — зависимости между весом ребенка при рождении, преждевременным адренархе и возникновением СПКЯ не существует.Поэтому до сих пор неизвестно, как влияют вес новорожденной, прибавка в весе в детском возрасте и появление адренархе на регулярность менструального цикла в будущем, а также на развитие синдрома поликистозных яичников.10.5.3. Недостаточность прогестерона при СПКЯ
Так как при синдроме поликистозных яичников большинство циклов ановуляторные, нехватка прогестерона часто является результатом отсутствия фазности цикла. У женщин, страдающих СПКЯ, наблюдается большая выработка прогестерона для подавления ускоренной частоты пульсации выработки ЛГ гормона, поэтому уровень ЛГ при СПКЯ нередко повышен. Из-за того, что при синдроме поликистозных яичников наблюдается дезинтеграция между гонадотропинами и выработкой половых гормонов, повышенный уровень ЛГ или отклонения в пульсирующих режимах его выработки приводит и к понижению уровня прогестерона. Недостаточность прогестероновой фазы при СПКЯ является вторичной, так как всегда страдает первая фаза менструального цикла. Это приводит к тому, что у женщин с СПКЯ уровень спонтанных потерь беременности немного выше по сравнению со здоровыми женщинами. Этот вопрос спорный, тем не менее, после применения репродуктивных технологий для лечения бесплодия при СПКЯ многие врачи назначают прогестерон для поддержки лютеиновой фазы.10.5.4. Прогестероновые рецепторы при СПКЯ
Синдром поликистозных яичников сопровождается низкими уровнями фертильности не только из-за нарушения овуляции. Хотя вопрос повышенного риска спонтанных выкидышей при СПКЯ оспаривается до сих пор, все же существует предположение, что имплантация плодного яйца может нарушаться из-за некачественного эндометрия. Было обнаружено, что у женщин, страдающих СПКЯ, наблюдается пониженная рецепторная активность эндометрия, которая также сопровождается продолжительным негативным действием эстрогенов, вызывающих определенную степень гиперплазии. Такое явление можно объяснить прогестероновой резистентностью (устойчивостью), которую часто обнаруживают у женщин, страдающих бесплодием. Почему возникает нечувствительность эндометрия к прогестерону, можно объяснить несколькими механизмами. Один из них предполагает поломку на уровне прогестероновых рецепторов. Другие механизмы включают поломки на уровне коактиваторов прогестероновых рецепторов — разных видов ферментов и других активных веществ (ко-шаперонов). Часто у женщин, страдающих СПКЯ, для стимуляции овуляции используют цитрат кломифена. Оказалось, что уровень зачатий после такой стимуляции составляет 15 %, однако она сопровождается высоким уровнем спонтанных выкидышей. Поэтому во многих публикациях можно найти утверждение, что при СПКЯ повышается уровень спонтанных выкидышей. Сам по себе цитрат кломифена нарушает прогестероновую чувствительность эндометрия, поэтому ухудшает его качество, как и качество шеечной слизи. Такие искусственно созданные шеечный и маточный факторы бесплодия понижают успех возникновения беременности не только у женщин с СПКЯ, но и у всех женщин, проходящих стимуляцию или индукцию овуляции. Прогестероновая резистентность эндометриоидной ткани обнаружена у женщин, страдающих эндометриозом. Но в течение продолжительного времени данных о том, что прогестероновая резистентность эндометрия у женщин с СПКЯ может быть результатом нарушения функции прогестероновых рецепторов, не имелось.При сравнении образцов эндометрия у женщин с СПКЯ, использовавших цитрат кломифена и прогестерон, и здоровых женщин было исследовано более 54 500 генов. Оказалось, что около 500 видов генов эндометрия здоровых женщин и женщин, страдающих СПКЯ, имеют различия в своей активности (экспрессии), что может свидетельствовать о нарушении усвоения прогестерона и наличии прогестероновой и инсулиновой резистентности. Полученные данные требуют дальнейшего изучения.
10.5.5. 17-ОПГ в диагностике СПКЯ
Прогестерон нашел применение в диагностике синдрома поликистозных яичников. Обычно врачи, начиная обследовать женщину, предлагают ей сдать кровь на определение уровня андрогенов, 17-ОПГ, прогестерона и ряда других гормонов. Определение мужских половых гормонов и 17-ОПГ является традиционным и наиболее информативным, потому что позволяет подтвердить диагноз СПКЯ и исключить диагноз гиперплазии коры надпочечников. Однако следует подчеркнуть, что 17-ОПГ является продуктом обмена прогестерона, а не только тестостерона. Поэтому уровни этого гормонального вещества повышаются во вторую фазу менструального цикла, а также при беременности. Таким образом, во избежание ошибок в интерпретации результатов анализов определение уровней андрогенов и 17-ОПГ рекомендовано проводить в первые дни менструального цикла. Прогестерон кратковременно влияет на андрогены, понижая их уровень, что также может исказить результаты анализов.10.5.6. Использование прогестерона при СПКЯ
Врачи часто назначают прогестерон женщинам при СПКЯ, однако не все знают, какой форме прогестерона и какому способу введения гормона отдать предпочтение с учетом особенностей его усвоения и воздействия на органы, и не только репродуктивной системы. Прогестерон у женщин с синдромом поликистозных яичников применяется со следующими целями: • Вызвать кровотечение отмены • Подавить выработку ЛГ для нормализации менструального цикла • При проведении индукции овуляции у женщин, устойчивых к цитрату кломифена • Для поддержки лютеиновой фазы после АРТ (ассистированных репродуктивных технологий) У женщин с СПКЯ циклы не только нерегулярные, но могут длиться неделями и месяцами, то есть менструации могут отсутствовать по 2–3 месяца. Когда женщина приходит к врачу с жалобами, она зачастую не знает, когда у нее появится следующая менструация, чтобы сдать анализы «по правилам». Поэтому часто врачи назначают препараты прогестерона, чтобы вызвать кровотечение отмены — искусственную менструацию. Такой подход не является лечением — это всего лишь вспомогательный метод диагностики. Таким образом, прогестерон у женщин с СПКЯ используется для оптимизации менструального цикла, чтобы определить уровни гормонов в начале цикла. Многие женщины ошибочно думают, что если прием прогестерона помог вызвать менструацию, то он произвел лечебный эффект. Хуже всего, когда прогестерон у таких женщин назначают по контрацептивной схеме. Фактически прием прогестерона по любой схеме, рекомендуемой в аннотациях, будет контрацептивной схемой, потому что эти рекомендации рассчитаны на циклы в 28 дней. Назначение прогестерона с 16-го дня цикла, когда при 28-дневном цикле должна уже состояться овуляция, у женщин с олигоменореей будет подавлять овуляцию, так как она обычно наступает позже. А тем более — назначение прогестерона с 11-го дня, — такой метод лечения недопустим у женщин с СПКЯ. И обычно, «сидя» на прогестероне месяцами, женщины говорят, что месячные циклы у них идут регулярно, каждые 28 дней, а забеременеть они не могут. Фактически такие женщины предохраняются от беременности прогестероном. Если прогестерон назначать в постоянном режиме женщинам с СПКЯ, уровень ЛГ придет в норму, однако это тоже будет контрацептивная схема лечения, поэтому она не может применяться у женщин, планирующих беременность. При применении постоянных схем лечения предпочтение отдают влагалищным формам гормона, реже — таблетированным. Известно, что проведение индукции овуляции у женщин, страдающих синдромом поликистозных яичников, сопровождается высоким уровнем неудач (неэффективностью). Это связано с тем, что у таких женщин наблюдается устойчивость к цитрату кломифена, который используется с этой целью чаще всего. Прогестерон подавляет ФСГ и ЛГ, поэтому его применение перед использованием кломифена приводит к лучшей ответной реакции яичников на стимуляцию овуляции. Нередко прогестерон в небольших дозах назначают в течение 10 дней для поддержки лютеиновой фазы (при этом овуляция должна быть подтверждена существующими методами диагностики). Однако в научной литературе не существует достоверных данных о том, что такое лечение производит лечебный эффект, поскольку уровень прогестерона в плазме крови большинства женщин остается низким, а повышение его уровня, которое удается достичь у некоторых женщин, является кратковременным и нестабильным. Поэтому многие врачи отдают предпочтение внутримышечным инъекциям гормона, особенно для поддержки желтого тела на ранних сроках беременности. Опять же, важно строго контролировать уровень прогестерона в плазме крови при назначении инъекций гормона.10.5.7. Методы лечения СПКЯ
Первоочередной задачей в лечении женщин с СПКЯ является потеря лишнего веса, что автоматически кардинально улучшает гормональное состояние женщины. В последние годы стало популярным назначать противодиабетические препараты (метформин) для понижения инсулиновой резистентности у женщин с СПКЯ. Анализ результатов первых клинических исследований показал, что метформин улучшает овуляцию и повышает шанс зачатия, но не повышает положительный исход таких беременностей — рождение живых детей. Лечение метформином женщин, планирующих беременность, становится неэффективным, что объясняют высоким весом у таких женщин и наличием все тех же нарушений метаболизма (метформин влияет только на обмен глюкозы и незначительно на триглицериды). Клинические исследования 2006–2008 годов показали, что метформин действует как плацебо и не улучшает уровень зачатий и вынашивания беременности. Метформин может понизить уровень инсулина натощак, но только у женщин с нормальным весом. У женщин, страдающих ожирением (индекс массы тела 30 кг/м2 и больше), лечебный эффект этого препарата не наблюдается. Также было проведено несколько исследований по изучению действия цитрата кломифена и метформина, порознь и вместе, и данные однозначно подтвердили факт, что у женщин, планирующих беременность, предпочтение желательно отдать только кломифену. Другими словами, метформин исключен из схем лечения синдрома поликистозных яичников в рекомендациях многих профессиональных обществ и ассоциаций мира. Индукцию овуляции у женщин с СПКЯ проводят не менее чем в 6 циклах. В отличие от лечения других категорий женщин предпочтение отдают кломиду (цитрату кломифена). Этот препарат обладает слабым противоандрогенным действием. Кроме того, гиперстимуляция наблюдается реже. Индукция гонадотропинами используется реже, и она может проводиться короткими или длинными протоколами. Протоколы стимуляции и индукции овуляции гонадотропинами дороже таковых при использовании кломифена цитрата, поэтому не все женщины могут позволить себе длинные протоколы гонадотропинами, эффективность которых выше по сравнению с короткими. Гонадотропины чаще используются женщинами с нормальными циклами при наличии нарушений спермы и для получения большого количество фолликулов (например, для ЭКО). В последнее время для стимуляции овуляции используют также агонисты и антагонисты гонадотропин-рилизинг гормонов. Как показывают данные исследований, антагонисты имеют преимущество над агонистами в получении лучшего исхода беременностей — рождении живого ребенка. Антагонисты требуют меньшего времени для проведения индукции овуляции и меньшего количества гонадотропинов. После индукции овуляции рекомендуется поддержка лютеиновой фазы препаратами прогестерона. У женщин, страдающих СПКЯ, в результате ановуляции чаще наблюдается негативное влияние излишка эстрогенов и нехватки прогестерона, что проявляется гиперплазией эндометрия. Такие женщины находятся в группе риска по развитию рака эндометрия. Поэтому рекомендуется вызывать у них менструальные кровотечения (кровотечения отмены) хотя бы каждые три месяца. Женщинам, которые не планируют беременность, рекомендуется прием комбинированных гормональных контрацептивов (КОК), которые от СПКЯ женщину не избавят, но предохранят ее от гиперплазии эндометрия. К тому же, некоторые из них обладают противоандрогенным действием и могут временно подавлять выработку излишка андрогенов яичниками. Заметим, что у многих женщин прием КОК усугубляет нарушение обменных процессов и протекание СПКЯ, повышает инсулиновую резистентность и ожирение. Применение антиандрогенных препаратов (в чистом виде или в комбинации с эстрогенами) для лечения СПКЯ применяется не часто, потому что обычно такие препараты рассчитаны на понижение высоких уровней андрогенов. Они негативно влияют на обмен жиров и функцию печени, а также могут вызывать депрессию. Поэтому такие препараты применяются непродолжительно (обычно 1–2 месяца, максимум 6 месяцев). Хирургический метод лечения (лапароскопическое сверление отверстий в капсуле яичника) используется чаще в Европе и нередко необоснованно. В странах Северной Америки, в Австралии такой метод лечения применяется реже, в основном у женщин, планирующих беременность, когда не удается получить овуляцию ее индукцией в кломифен-устойчивых случаях, реже при отказе женщины от индукции овуляции и ЭКО.10.6. Прогестерон и гиперплазия эндометрия
Ановуляторные циклы — чрезвычайно частое явление в жизни подростков и молодых женщин. Обычно после 21–22 лет цикл становится более стабильным, хотя ановуляция может наблюдаться 1–2 раза в год, а при наличии факторов, подавляющих созревание половых клеток (стресс), и чаще. Но если у женщины низкий или высокий вес, нерегулярность циклов может продолжаться. Ановуляторные циклы характеризуются доминированием эстрогенов, так как желтое тело из-за отсутствия овуляции не возникает, а значит, прогестерона действительно не хватает. Однако это относительная прогестероновая недостаточность — всего лишь по сравнению с уровнями эстрогенов, а не по количественным показателям. Как правило, уровень прогестерона у большинства женщин с ановуляторными циклами в норме, хотя пика выработки гормона не наблюдается. Так как влияние эстрогенов не подавляется большей выработкой прогестерона, происходит усиленный рост эндометрия, что часто называют гиперплазией эндометрия. Ошибочно диагноз гиперплазии эндометрия ставится по УЗИ-измерениям толщины эндометрия: измерял УЗИ-врач или УЗИ-технолог толщину эндометрия, и она ему не понравилась, потому что не «вписалась» в норму или же вписалась, но все равно врачу не понравилась такая «норма» — у него свои нормы. Толщина эндометрия зависит от дня менструального цикла. В период менструации и в первые дни цикла толщина эндометрия составляет 1–4 мм. С 6-го по 14-й день цикла толщина становится 5–7 мм. В предовуляторную фазу можно заметить два слоя эндометрия — эхогенный базальный слой и гипоэхогенный функциональный слой. Толщина эндометрия в этот период 9–11 мм. После овуляции в течение 48 часов «слоистость» эндометрия исчезает, поэтому на УЗИ ее заметить трудно. Эхогенность — это УЗИ-термин, характеризующий акустические свойства исследуемых тканей и органов. На экране УЗИ-аппарата гиперэхогенные участки (плотные по строению) будут выглядеть светлее. И наоборот, полые или жидкостные образования будут темными, то есть гипоэхогенными. Каждый УЗИ-аппарат имеет серую шкалу монитора, по которой врачи и УЗИ-технологи должны сравнивать эхогенность объекта. Но на практике большинство врачей определяет степень эхогенности «на глазок», то есть субъективно. Кроме того, определение яркости изображения зависит от правильной настройки яркости и контрастности монитора. Поэтому к оценке реального состояния органов и тканей необходимо подходить с учетом субъективности проведенного обследования. В лютеиновую (секреторную фазу) рост эндометрия прекращается, потому что прогестерон подавляет пролиферацию эндометрия. Секреторные изменения возникают не только в железах эндометрия, но и в строме. Толщина эндометрия становится чуть больше (7–14 мм) из-за отечности клеток, но измерить ее правильно в этот период с помощью УЗИ трудно, потому что и два слоя эндометрия, и строма становятся гиперэхогенными. Поэтому расширенные железы эндометрия в этот период цикла часто ошибочно принимаются за очаги аденомиоза. У женщин репродуктивного возраста, нормально овулирующих, толщина эндометрия особой роли не играет, так как в норме она может быть от 5 до 15 мм, поэтому измерение толщины эндометрия у здоровых женщин проводят редко. Важно также учитывать то обстоятельство, что правильное измерение толщины может быть проведено только в предовуляторный период. У женщин с нарушениями овуляции, сопровождающимися нерегулярностью менструального цикла (но не всегда), толщина эндометрия может быть в норме, но плохого качества; при этом физиологическая гиперплазия эндометрия бывает следствием его реакции на длительное влияние эстрогенов. У женщин в постменопаузе измерение толщины эндометрия проводят чаще всего при наличии жалоб на кровянистую мазню или кровотечение. В норме толщина эндометрия у этой категории женщин не должна быть больше 5 мм. Но так ли плохо и так ли необходимо проводить диагностическое выскабливание, если у женщины на УЗИ постоянно обнаруживают толщину эндометрия в 6–7 мм при отсутствии жалоб на состояние репродуктивной системы? Очевидно, всегда необходим индивидуальный подход к оценке ситуации. Термин «гиперплазии эндометрия» является лабораторным, то есть он характеризует изменения эндометрия на тканевом и клеточном уровнях, поэтому характеризует микроскопическое состояние эндометрия, а не толщину эндометрия, измеренную по УЗИ (и довольно часто неправильно). Поэтому «гиперплазию эндометрия» увидеть «на глазок» невозможно (если не рассматривать материал биопсии под микроскопом). Это не диагноз, не патология, не заболевание, а всего лишь характеристика внутренней выстилки матки, которая отражает гормональное состояние женщины, а также говорит о том, что в гормональном фоне доминируют эстрогены — собственные или введенные извне. Это не показатель нехватки прогестерона, а показатель того, что механизм переключения доминирования одних гормонов на другие не работает, потому что нет овуляции или же введены слишком большие дозы эстрогенов. А диагнозов, когда отсутствует овуляция, как и состояний (те же переутомление, нервный срыв, перенесенный эмоциональный шок и т. д.), приводящих к ановуляции, много. Гиперплазия эндометрия характеризуется тем, что она сопровождается прорывными кровотечениями, которые принимаются за менструацию. Эти кровотечения могут быть едва выраженными (мазня), длительными или, наоборот, обильными, вызывая сильное беспокойство у женщин. Ановуляторные циклы чаще всего нерегулярные, хотя могут чередоваться с овуляторными циклами.10.6.1. Классификация гиперплазии эндометрия
Невзирая на то, что чаще всего врачи ставят диагноз гиперплазия по толщине эндометрия, измеренной с помощью УЗИ, диагностическими критериями постановки этого диагноза (точнее, этого состояния эндометрия, а не заболевания) являются изменения клеток и ткани эндометрия, которые можно определить только с помощью гистологического исследования. До сих пор нет четкой классификации гиперплазии эндометрия, но часто используют классификацию ВОЗ, согласно которой есть типическая гиперплазия (простая — железистая или сложная — аденоматозная) и атипическая гиперплазия (простая — железистая с атипией и сложная — атипическая аденоматозная). Большинство врачей все же не соглашаются с такой классификацией, потому что простая железистая гиперплазия с атипией по морфологическому строению уже является сложной, или комплексной. К тому же, такая классификация не учитывает признаки проявления таких вариантов гиперплазии, а точнее, многочисленные диагнозы, при которых могут наблюдаться разные виды гиперплазии эндометрия. Все чаще на практике используется новая, терапевтическая, классификация, которая включает три вида гиперплазии эндометрия: простую, комплексную и атипическую. Две последние делят на те, которые возникают в предклимактерическом и климактерическом периодах. Такая классификация более удобна в выборе диагностики и лечения и помогает избежать лишнего вмешательства и ошибок. Простая железистая гиперплазия, которая часто встречается у женщин репродуктивного возраста и которую многие врачи «лечат» выскабливанием или гормональными контрацептивами, чаще всего в лечении не нуждается, особенно при отсутствии жалоб. Такой вид гиперплазии не переходит в рак, поэтому запугивание женщин развитием рака в будущем является проявлением малограмотности.10.6.2. Какая гиперплазия переходит в рак?
Слово «атипия» всегда пугает женщин, потому что атипию клеток часто приравнивают к раковому процессу. Атипичные клетки встречаются во всех тканях человеческого организма, и это чаще всего не рак или злокачественное перерождение. В медицине термин «атипичные клетки» означает: «не соответствуют ни одному диагнозу». Это может быть норма, может быть отклонение от нормы, но не настолько значительное, что нужно срочно бить тревогу. В классификации гистологических и цитологических исследований имеется специальная терминология, применяемая при описании подозрения на рак или раковых изменений. Внимания заслуживают только те атипические гиперплазии, которые встречаются у женщин климактерического периода. Обычно эти женщины жалуются на длительную кровянистую мазню или кровотечение, например, после 1–2 лет отсутствия менструаций. Обследование таких женщин проводят разными методами, в том числе диагностическим выскабливанием, которое имеет строгие показания для его проведения. Простая железистая гиперплазия неприятна только тем, что она сопровождается кровомазаньем или кровотечением, которое обычно не опасно для здоровья женщины (не приводит к анемии или другим серьезным осложнениям), хотя может вызвать у женщины немало страха и опасений за собственную жизнь. Часто нерегулярные обильные менструации бывают у подростков, матери которых воспринимают такое явление с настоящей паникой и подвергают своих дочерей необоснованному выскабливанию полости матки и приему контрацептивов. А эти явления — результат гиперплазии эндометрия из-за отсутствия овуляции. Также необходимо помнить, что очаги атипической гиперплазии эндометрия могут быть на фоне нормального эндометрия, в том числе нормальной толщины эндометрия. Не всегда в таких случаях у женщины будут жалобы. Случаи рака эндометрия часто диагностируются только из-за жалоб на появление кровянистых выделений у женщин в климактерическом периоде, хотя на УЗИ толщина эндометрия может быть в норме. Небольшое утолщение патологического участка эндометрия при раке эндометрия на ранних стадиях этого заболевания в большинстве случаев выявить с помощью УЗИ не удается. Семейная история, перенесенные заболевания, количество беременностей и родов — все это учитывается при постановке правильного диагноза.10.6.3. Необходимо ли лечить гиперплазию эндометрия?
В большинстве случаев простой железистой гиперплазии эндометрия женщины в лечении не нуждаются: ни в выскабливании, ни в гормональной контрацепции и прогестероне. Всегда важно понять причину усиленного роста эндометрия. Если это подростковый возраст, послеродовый лактационный период, задержка менструального цикла из-за резких колебаний веса, следствие перенесенных заболеваний, — необходимо объяснить женщине, что гиперплазия эндометрия является физиологической реакцией эндометрия и лечения не требует. Если у женщины имеются постоянные ановуляторные циклы, тогда необходимо найти причину ановуляции, а не «садить» женщину на контрацептивы, стараясь добиться регулярных искусственных менструаций. Если у женщины есть заболевания других органов или систем органов, например, нарушение функции щитовидной железы, необходимо провести лечение этого заболевания. И таких состояний, и заболеваний, из-за которых в эндометрии может появляться гиперплазия, множество. Эндометрий матки — это всего лишь ткань-мишень, растущая под влиянием эстрогенов, поэтому необходимо не подавлять этот рост искусственно, а выяснить причину такого влияния эстрогенов (причину истинной или относительной гиперэстрогении). Если прогестерон подавляет рост эндометрия, то его применение, в том числе в виде прогестинов, может помочь в лечении гиперплазии эндометрия. Сама по себе железистая гиперплазия неопасна, но так как она может сопровождаться кровянистыми выделениями и кровотечением, именно эти жалобы вынуждают женщин принимать лечение. Если у женщины нет менструации в течение трех циклов, для предотвращения кровомазанья и внезапного кровотечения используют прогестерон, которым вызывают искусственное кровотечение, но обычно оно меньше по продолжительности и обильности. Механизм возникновения менструального кровотечения обсуждался в других главах. Для искусственного создания кровотечения прогестерон обычно принимают в течение 5 дней, а после его отмены через несколько дней возникает кровотечение отмены. При наличии гиперплазии эндометрия и отсутствии жалоб назначение прогестерона не рекомендуется. Месячные вызывают искусственно только при наличии трех месяцев задержки менструации, если женщина не беременна и не климактерического возраста. Но после этого требуется обследование и поиск правильного диагноза. Простые атипические гиперплазии тоже чаще всего не требуют лечения, особенно если проведено выскабливание или гистероскопия. Часто женщинам рекомендуют прием гестагенов, в том числе в виде внутриматочной гормональной системы, содержащей прогестин (Мирена). Реже используется влагалищный крем с синтетическим прогестероном. При наличии комплексной атипической гиперплазии часто рекомендуют удаление матки.10.7. Прогестерон и лейомиома
Все опухоли гладких мышц матки можно разделить на доброкачественные и злокачественные. Доброкачественные опухоли матки — это самые распространенные охули репродуктивной системы женщин, и к ним относят лейомиомы (фибромиомы), которые находят у 40 % женщин старше 35 лет. В 50-летнем возрасте опухоли матки находят почти у 70 % белых женщин. Лейомиосаркома — это злокачественная опухоль матки, редкое заболевание, которое встречается в 1.3 % случаев всех злокачественных новообразований матки. Существует также еще один вид опухолей гладких мышц матки — опухоль неизвестной злокачественной потенции. Этот вид опухолей опасен тем, что прогнозировать исход заболевания при наличии такой опухоли практически невозможно, но и диагностировать этот тип опухоли без хирургического вмешательства не так просто.10.7.1. Причины возникновения лейомиом
Причины возникновения опухолей миометрия матки неизвестны, хотя существует множество гипотез и теорий. Считается, что маточные лейомиомы являются моноклональными опухолями, то есть возникают всего из одной клетки путем многократного деления. Что провоцирует рост и деление этой клетки, неизвестно. Предполагается, что на уровне клетки имеется или происходит изменение (мутация), не позволяющее контролировать влияние местных гормонов роста и стероидных гормонов. Традиционно в росте лейомиом обвиняли эстроген. Однако многолетние наблюдения применения прогестероновых препаратов показали, что прогестерон и прогестины тоже влияют на деление клеток миом. Наличие прогестероновых рецепторов в опухолях также подтверждает факт усвоения этого гормона тканью миомы. Исследования на животных моделях показали, что прогестерон играет не меньшую роль в росте опухолей матки, чем эстрадиол. Ошибочным является разграничение взаимосвязи в воздействии эстрогенов и прогестерона на возникновение фибромиомы матки, а также ряда других гормонально зависимых опухолей: рака эндометрия, рака молочной железы, эндометриоза. Такое разграничение приводит к ложному восприятию эстрогена как «плохого гормона», а прогестерона как «хорошего гормона». Большинство этих заболеваний сопровождается определенной гипоэстрогенией, когда уровни эстрогенов понижены. Прогестерон контролирует использование эстрогена клетками. Если имеется нехватка прогестерона или же клетки становятся нечувствительными к прогестерону из-за недостаточности прогестероновых рецепторов или нарушения их функции, эстроген, даже в незначительных количествах, становится триггером роста патологических клеток. Однако для клеток и тканей, богатых прогестероновыми рецепторами, прогестерон является пролиферативным и канцерогенным агентом, способствующим росту клеток путем пролиферации и других изменений внутри клеток. Ключ к контролю за таким влиянием прогестерона — создание баланса между использованием прогестерона стромальными и эпителиальными клетками органов-мишеней. В норме стромальные клетки имеют большое количество прогестероновых рецепторов, которые улавливают прогестерон и таким образом предохраняют эпителий от чрезмерной пролиферации и канцерогенной трансформации. Эпителиальные клетки молочных желез и лейомиоматозных узлов имеют нехватку хорошо организованного стромального компонента, компенсирующего влияние прогестерона. Всех женщин, у которых возникают лейомиомы, можно разделить на две возрастные группы. У молодой группы женщин (20–35 лет) фибромиомы возникают редко, и в их рост обычно втянут генетический (наследственный) фактор. Обнаружены два гена HMGIC и HMGI (Y), причастных к возникновению лейомиомы. Часто у таких женщин наблюдаются множественные фиброматозные узлы, но небольших размеров, которые на репродуктивную функцию женщины обычно не влияют. Заметим, что гормональные уровни у женщин этой возрастной группы в преимущественном большинстве случаев в прекрасной норме, поэтому теория «гиперэстрогении-гипопрогестеронемии» не может объяснить рост узлов у таких женщин. Интересно, что беременность, когда рост прогестерона увеличивается, часто вызывает увеличение узлов, которые частично регрессируют после родов. Использование гормональных препаратов у части таких женщин может провоцировать рост лейомиом. Другая возрастная категория женщин — это женщины предклимактерического периода. Особенность этого периода в том, что с одновременным постепенным понижением половых гормонов и прогестерона, наблюдаются гормональные всплески — резкие кратковременные повышения уровней гормонов. Именно такие скачки, особенно эстрогенов, нарушают пропорцию гормональных уровней и провоцируют рост лейомиом. Обычно с наступлением менопаузы узлы прекращают рост и постепенно регрессируют. В увеличении миоматозных узлов также играют роль факторы роста (фактор роста из тромбоцитов, гепарин-связывающий эпидермальный фактор роста, фактор роста из гепатомы, основной фибробластический фактор роста и др.) и трансформирующий фактор роста бета.10.7.2. Виды лейомиом
Миомы могут кардинально отличаться друг от друга по своему микроскопическому строению, наличию некроза, атипичных клеток, делящихся (митотических) клеток и по другим признакам. Поэтому могут проявляться по-разному, а значит, быть безобидными «находками» и, наоборот, потенциальными «врагами», требующими лечения — от медикаментозного до хирургического. Но даже среди доброкачественных миом имеются три вида, которые по микроскопическому строению могут напоминать раковый процесс, что затрудняет постановку точного диагноза. К ним относятся атипичные, митотически активные и клеточные лейомиомы. Поэтому врачей всегда интересовал и до сих пор интересует вопрос, существуют ли какие-то маркеры опухолей матки, по которым можно было бы определить ее злокачественность и доброкачественность. Точная диагностика важна не только для прогноза заболевания, но и для выбора правильного лечения. Оказалось, что неплохим прогностическим маркером в определении вида лейомиомы является количество прогестероновых рецепторов и паттерн их распределения. По изучению этого паттерна можно установить видовую принадлежность лейомиом. Также было обнаружено, что большинство злокачественных опухолей гладких мышц матки не имеет прогестероновых рецепторов. Определение прогестероновых рецепторов в узлах лейомиом все еще не применяется в медицине широко, а находится в процессе клинического экспериментирования.10.7.3. Лечение лейомимом
Лечение лейомиом должно быть индивидуальным и основанным на симптоматике, размерах и скорости роста опухоли, размещении узла (узлов), желании женщины беременеть и ряде других факторов. У большинства женщин лейомиома матки не сопровождается симптомами и не влияет на функционирование женщины, поэтому лечения не требуется. Лечение лейомиом рационально всегда начинать с консервативных методов. Традиционно для лечения фиброматозных узлов используют гормональные контрацептивы. Современные гормональные контрацептивы, содержащие небольшое количество синтетических эстрогенов и прогестеронов, не оказывают влияния на рост фиброматозных узлов. Низко дозированные оральные контрацептивы не уменьшают размеры фиброматозных узлов, но улучшают регулярность менструальных циклов, уменьшая при этом длительность кровотечений и количество теряемой крови. Использование прогестерона и прогестинов для лечения фиброматозных узлов является противоречивым. Сторонники прогестинов утверждают, что эти вещества понижают рост фибромиом. Противники такого лечения приводят убедительные факты ускорения роста лейомиом при использовании прогестинов, в том числе популярной «Мирены». Действительно, влияние прогестерона и прогестинов на лейомиомы у каждой женщины индивидуальное и непредсказуемое Другие гормональные препараты могут уменьшить размеры фиброматозных узлов, однако эти препараты рассчитаны на кратковременный прием, и после их отмены рост фиброматозных узлов возобновляется. Так, например, агонисты гонадотропин-рилизинг гормона могут привести к уменьшению размеров фиброматозных узлов наполовину в течение трехмесячной терапии. Даназол, синтетический андроген, уменьшает размеры фиброматозных узлов до 25 %. Эти препараты не могут быть использованы женщинами, планирующих беременность. Они нашли применение в предоперационной подготовке женщин, когда планируется лапароскопическое или гистероскопическое удаление узлов. Современные методы лечения также направлены на блокировку действия факторов роста рядом лекарственных веществ: RG13577 (подобное гепарину вещество) и галофугинон могут подавлять синтез ДНК в клетках мышц и лейомиомы без токсического эффекта на организм. Пирфенидон, который используется для подавления роста фиброзной ткани, проходит испытание в лечении фиброматозных узлов. Изучается также α-интерферон, который может подавлять факторы роста. Использование этих и других препаратов может кардинально снизить количество случаев хирургического вмешательства в виде удаления фиброматозных узлов и матки или эмболизации (закупорки) маточных сосудов.10.8. Прогестерон и эндометриоз
Под эндометриозом понимают наличие видимых очагов эндометриоидной ткани (имплантатов) вне матки. Традиционно считается, что это заболевание является эстроген-зависимым, потому что пролиферация эндометрия внутри матки или за ее пределами наблюдается под влиянием эстрогенов. С уменьшением уровня эстрогенов наблюдается регресс роста эндометриоидных очагов, например, при менопаузе, искусственной или натуральной. На этом основано существующее медикаментозное лечение эндометриоза, которое не избавляет женщину от болезни, а создает временный эффект подавлением роста эндометриоидной ткани и эндометрия путем подавления выработки эстрогенов. После прекращения лечения симптомы эндометриоза возвращаются. Хирургическое лечение эндометриоза также имеет много ограничений, оказывает временный эффект и сопровождается большим количеством осложнений, поэтому проводится редко. Многие современные врачи не соглашаются с приведенным определением эндометриоза, потому что оно слишком «упрощает» понимание этого заболевания. Как показывают исследования, эндометриоидные очаги в разных частях репродуктивной системы и за ее пределами могут иметь разное воздействие на прилегающие ткани, в том числе на их гормональную чувствительность. Кроме того, известно, что реакция эндометрия на прогестерон в середине лютеиновой фазы у женщин, страдающих эндометриозом, и здоровых женщин разная. У первых отмечается «прогестероновая резистентность», то есть нечувствительность к прогестерону. Таким образом, эндометриоз — это не только эстроген-чувствительное, но и прогестерон-нечувствительное состояние, а значит, речь идет о гормональном дисбалансе, который проявляется на генном уровне, то есть нарушается регуляция генов, отвечающих за дифференциацию эндометрия.10.8.1. Механизм возникновения эндометриоза
Распространенность эндометриоза не изучена полностью. Чаще всего к врачам с жалобами на боли внизу живота, а также бесплодие, обращаются женщины репродуктивного возраста. Считается, что от 5 до 10 % таких женщин страдают эндометриозом. Почему на фоне якобы полнейшего здоровья у одних женщин возникает эндометриоз, в то время как у других, при наличии отклонений в гормональном фоне или органах репродуктивной системы, эндометриоз никогда не возникает? Этот вопрос несет в себе некую тайну возникновения и развития эндометриоза, до сих пор остающуюся вне понимания врачами, учеными, исследователями. Эндометриоз — довольно загадочное заболевание, несмотря на распространенность и пристальное внимание врачей и ученых. Существует много теорий и гипотез, объясняющих возникновение эндометриоза, но все чаще врачи склоняются к трем ведущим теориям. Согласно первой теории (теория ретроградной менструации), ткань эндометрия с кровью распространяется во время менструации ретроградно в маточные трубы или же через зияющие кровеносные сосуды и лимфатические протоки матки (теория имплантации). Во время менструации у 90 % женщин находят кровь в брюшной полости (в дугласовом пространстве). Вторая теория, теория целомической метаплазии, объясняет возникновение эндометриоидных очагов изменениями клеток покровных тканей брюшной полости (брюшины) под воздействием неблагоприятных факторов. Третья распространенная теория объясняет возникновение эндометриоза неспособностью защитных сил организма разрушать эктопические очаги клеток эндометрия и абнормальной дифференциации эндометриоидной ткани. При этом повышается выработка эстрогенов и прогестерона, но наблюдается устойчивость к усвоению прогестерона тканями. Все теории подтверждены научными фактами, но в полной мере объяснить механизм возникновения этого заболевания не могут. Существует несколько животных моделей, на которых изучался механизм развития эндометриоза, в том числе на молекулярном уровне. Нарушенная ответная реакция на прогестерон в эндометриоидных очагах была обнаружена и у животных. Логически напрашивался вывод, что нечувствительность к прогестерону возникала на фоне хронического воспалительного процесса в малом тазу, поскольку воспалительная реакция способна подавлять активность рецепторов прогестерона несколькими путями. Также, ряд веществ, возникающих при воспалении, могут нарушать активность и других стероидных рецепторов. Некоторые противовоспалительные факторы могут связываться с прогестероновыми рецепторами, блокируя их. Свободные радикалы, которые возникают при окислительном стрессе, тоже способны нарушать кодирование в передаче сигналов прогестероновыми рецепторами. Прогестерон усиливает инвазивности стромальных клеток эндометрия, что может способствовать образованию эктопических очагов эндометриоза при попадании менструальной крови ретроградно в брюшную полость.10.8.2. Резистентность к прогестерону
Казалось бы, эстроген-зависимость и прогестерон-резистентность — почти одно и то же явление, названное по-разному. Однако речь идет о разных фазах менструального цикла, где доминирует воздействие разных гормонов. Понятие «прогестероновой резистентности» основано на исследованиях, которые показали, что у женщин, страдающих эндометриозом, наблюдается нарушение регуляции прогестерон-зависимых генов (более 200) в эндометриоидных очагах, а также в эндометрии матки. Очевидно, это явление играет роль в возникновении трубной и яичниковой дисфункции у женщин с эндометриозом. Исследования также показали, что нарушение регуляции генов происходит в течение всего цикла, но наибольшие отклонения обнаружены в начале лютеиновой фазы. Это приводит к тому, что пролиферация эндометрия у таких женщин затягивается и не подавляется прогестероном. Результаты клинических исследований говорят о том, что эндометриоз встречается в 3–10 раз чаще среди родственников первой степени по женской линии, однако нередко у таких женщин имеются пороки развития половых органов с нарушением оттока менструальной крови. Прогестероновой резистентностью, казалось бы, можно объяснить механизм возникновения бесплодия у некоторых женщин, страдающих эндометриозом. А значит, дополнительное введение прогестерона, по идее, должно помочь в возникновении беременности. Однако все не так просто. Гены, гормональная регуляция которых нарушена, нечувствительны к экзогенному прогестерону. Одно из исследований показало, что экспрессия 245 генов эндометриоидной ткани у больных эндометриозом отличалась от таковой у здоровых женщин при наличии нормального уровня прогестерона. В отличие от нормальной ткани эндометрия эндометриоидная ткань имеет меньшую чувствительность к прогестерону независимо от того, где размещены очаги эндометриоза — вне маткиили в матке (эктопически или эутопически). Оказалось, в эндометриоидных очагах прослеживается не только диспропорция эстрогенных и прогестероновых рецепторов, но также уменьшено отношение ПР-В/ПР-А, что может объяснить устойчивость этих тканей к прогестерону. Некоторые врачи считают, что дефицит прогестероновых рецепторов ПР-В — ключ к пониманию развития эндометриоза, поэтому необходим поиск лекарств, которые активировали бы такие рецепторы, что может оказаться наиболее эффективным методом лечения эндометриоза. Прогестеронная резистентность отмечается и при ряде других заболеваний, в частности при синдроме поликистозных яичников.10.8.3. Прогестерон для лечения эндометриоза
Взгляды на лечение эндометриоза поменялись значительно за последние десять лет в результате многочисленных клинических исследований, позволивших сравнить результаты (эффективность) лечения этого заболевания разными методами. Так как эндометриоз неизлечим, медикаментозная терапия является самой безопасной, а поэтому желательной, и в то же время эффективной для женщин любой возрастной категории, за исключением случаев, когда женщина планирует беременность. Эндометриоз необходимо лечить только при наличии болевого синдрома и/или бесплодия. Если у женщин нет жалоб, лечение эндометриоза не проводится. О свойствах прогестерона подавлять рост эндометрия знали еще несколько столетий тому назад. Правда, в те далекие времена о самом прогестероне как веществе ничего не знали, но знахари, и врачи использовали вытяжку из яичников животных для создания искусственной менопаузы у женщин с сильными болями, особенно во время месячных. Описание таких клинических случаев полностью совпадает с картиной эндометриоза. Несмотря на то, что имеются объяснения возникновения прогестероновой резистентности, до сих пор не найдено адекватного медикаментозного лечения, которое бы не только подавляло пролиферацию эндометрия в эндометриоидных очагах, но и восстанавливало бы нормальную чувствительность тканей к стероидным гормонам. Помимо нарушения экспрессии прогестерон-зависимых генов в эндометриоидных очагах, в развитии прогестероновой резистентности играет роль тот факт, что прогестероновые рецепторы при эндометриозе имеют определенный дефект. Поэтому корректировка этого состояния дополнительным приемом прогестерона не оказывает лечебного эффекта. Основная цель в лечении эндометриоза — это устранение фазности циклов, то есть овуляции. Поэтому применение КОК и прогестинов, которые подавляют овуляцию, может частично улучшить состояние женщины. Нередко врачи назначают КОК в непрерывном режиме, чтобы избежать возникновения кровотечений отмены при 7-дневном перерыве приема гормонов, так как считается, что при менструации (искусственно созданном кровотечении отмены) незначительная порция крови может попадать в брюшную полость и вызывать боль в малом тазу. Прогестины хотя и оказывают лечебное действие, но в отношении боли они проявляют кратковременный эффект, а около 9 % женщин нечувствительны к такому лечению. В Европе и США все большей популярностью пользуются ацетат норэтиндрона, ацетат медроксипрогестерона и другие прогестины. Ацетат норэтиндрона весьма эффективен в лечении дисменореи и хронической боли и может применяться продолжительный период для лечения эндометриоза. Диеногест может использоваться в комбинации с агонистами гонадотропин-рилизинг гормонов, однако данные последние исследований показали, что этот препарат эффективен и без агонистов GnRH и вызывает меньше побочных эффектов. Так как диеногест обладает противоэстрогенными свойствами, основные жалобы, связанные с приемом препарата, вызваны проявлением гипоэстрогении. Депо-прогестиновая терапия широко применяется с контрацептивной целью. Для лечения эндометриоза используют депо ацетата медроксипрогестерона (DMPA, ДМПА). Этот вид лечения становится популярным среди женщин, так как он не только экономически выгодный (дешевле), но и не требует ежедневного приема препарата, а также предохраняет от беременности. Самая неприятная побочная сторона лечения депо-прогестинами — это прорывные кровотечения, которые могут быть обильными и длительными. Такой вид лечения не назначается женщинам, планирующим беременность, так как он может заблокировать репродуктивную систему женщины надолго, нарушив созревание яйцеклеток и регулярность менструального цикла. Длительный прием депо-прогестинов требует дополнительного приема препаратов кальция для профилактики остеопороза. Внутриматочная система «Мирена», которая содержит левоноргестрел, оказывает противоэстрогенное действие на эндометрий, поэтому подавляет рост эндометрия, вызывает нередко аменорею (отсутствие менструации) и, таким образом, устраняет болевые ощущения у половины женщин, страдающих эндометриозом. Овуляция при использовании «Мирены» подавляется далеко не у всех женщин. Преимущество этого метода лечения состоит в том, что внутриматочная система с левоноргестрелом может находиться в полости матки до 5 лет, оказывая свое лечебное действие. Так как овуляция при этом методе не угнетается полностью, риск возникновения эндометриом (шоколадных кист) повышается. В 5 % случаев внутриматочная система само удаляется. Даназол является производным мужских половых гормонов и поэтому вызывает искусственную менопаузу. Он широко применялся для лечения эндометриоза около 20 лет тому назад и до сих пор применяется в ряде стран. Этот препарат оказывает ряд побочных эффектов, таких как появление акне, гирсутизм, увеличение веса тела, атрофия молочных желез и др. Имеются данные, что длительный прием даназола повышает риск развития рака яичников. Агонисты гонадотропин-рилизинг гормона — это новая группа препаратов, которые применяются при неэффективности других препаратов, или, реже, в комбинации с ними. Препараты этой группы не должны применяться без дополнительной фоновой (заместительной) гормональной терапии. На рынке существует несколько агонистов GnRH: бусерелин, гозерелин, лейпрорелин, нафарелин, трипторелин, диеногест и другие. Так как эта группа препаратов обладает выраженным противоэстрогенным действием, основным серьезным побочным эффектом является состояние эстрогенной недостаточности (гипоэстрогения), которая может сопровождаться горячими приливами, сухостью влагалища, бессонницей, понижением либидо, а также уменьшением плотности костей и потерей кальция организмом (не всегда возвратными). Поэтому часто при лечении этими препаратами назначается заместительная гормональная терапия (комбинация эстрогенов и прогестерона), как это принято для лечения состояния гипоэстрогении у женщин в климактерическом периоде. Данные препараты вызывают длительную стойкую аменорею, которая редко сопровождается прорывными кровотечениями. Они не могут применяться женщинами, планирующими беременность. В ряде стран проходят клиническое испытание ингибиторы ароматаз для лечения эндометриоза. Их действие основано на подавлении фермента — ароматазы, которая используется эндометриоидными очагами для выработки собственного эстрогена. Эти препараты могут комбинироваться с другими лекарствами не только для лечения болевого синдрома при эндометриозе, но и для предотвращения образования кист после применения или отмены других видов лечения.10.8.4. Хирургическое лечение эндометриоза
Врачи часто злоупотребляют хирургическим лечением эндометриоза, в частности лапароскопией. Они проводят ее у большинства женщин с хронической болью в малом тазу. Однако лечение хронической боли, особенно случаев альгодисменореи, может быть начато и без хирургического вмешательства — назначением лекарственных препаратов. Если медикаментозное лечение оказывается неэффективным, тогда лапароскопия может быть проведена не только с целью диагностики, но и как хирургический метод лечения. Современные рекомендации хирургического лечения эндометриоза включают только две группы больных: • Больные с болью в малом тазу: А) медикаментозное лечение которых оказалось неэффективным Б) имеют противопоказания к медикаментозному лечению В) отказались от медикаментозного лечения Г) оказались в состоянии, когда необходимо оказать экстренную помощь (разрыв кисты яичника, перекрут кисты на ножке и др.) Д) страдающие инвазивной формой эндометриоза с поражением кишечника, мочевого пузыря, мочеточников, нервов малого таза. • Больные, у которых находят или подозревают эндометриому яичника: А) при наличии опухоли яичника неясной природы Б) страдающие бесплодием и хронической болью в малом тазу. Женщины, у которых очаги эндометриоза выявлены во время хирургического вмешательства случайно (например, при аппендэктомии), в лечении эндометриоза не нуждаются. Исследования показывают, что удаление очагов эндометриоза у женщин, страдающих бесплодием, уровень фертильности не повышает, поэтому лапароскопия не рекомендуется в большинстве случаев женщинам, планирующим беременность.11. ПРОГЕСТЕРОН И БЕРЕМЕННОСТЬ
Представить беременность без прогестерона невозможно. Прогестерон во многих источниках информации называют «прогестационным гормоном», то есть гормоном, предшествующим и способствующим гестации, или беременности. Несомненно, беременность — это состояние прогестеронизации, если так можно выразиться. Это царство прогестерона. Однако роль прогестерона для процесса зачатия часто искажена и представлена неправильно, а отсюда вытекает злоупотребление этим гормоном для корректировки разных «погрешностей» беременности. В предыдущих главах обсуждалось значение прогестерона для созревания половых клеток и процесса овуляции, что происходит в первую фазу менструального цикла. Беременность возникает в результате зачатия, то есть оплодотворения женской половой клетки (яйцеклетки) мужской половой клеткой (сперматозоидом). Но само по себе зачатие еще не определяет успешное возникновение беременности, которая характеризуется надежным прикреплением и развитием плодного яйца в полости матки и которую можно диагностировать клинически рядом методов диагностики. Далеко не каждое зачатие завершится беременностью, а если быть точным, около 80 % случаев оплодотворения не будут успешными и не завершатся рождением ребенка. В последующих главах рассматривается роль прогестерона в оплодотворении и возникновении беременности, ее протекании и завершении родами. Также обсуждается вопрос о пресловутой лютеиновой недостаточности — диагнозе, которым серьезно злоупотребляют в постсоветских странах, что приводит к необоснованному применению прогестерона и прогестинов.11.1. Прогестерон и сперматозоиды
Процесс зачатия ребенка — это сложный многоступенчатый последовательный процесс, в который вовлечено взаимодействие двух чужеродных организмов — мужского и женского. Даже небольшая поломка незначительного, казалось бы, звена может привести к неудачному дефектному зачатию или вообще бесплодию. Обычно старая школа врачей уделяла большее внимание женскому организму, считая, что мужчина всего лишь донор спермы и что любая сперма может привести к зачатию, потому что яйцеклетку оплодотворяет всего лишь один сперматозоид. Традиционное выражение таких врачей звучало так: «И с такой спермой беременеют». По отношению к мужчине создавалась презумпция невиновности. А раз мужчина не виноват, то «во всем виновата женщина» — и такой подход в диагностике семейного бесплодия доминирует в постсоветских странах до сих пор. Это ошибочное мнение, так как мужское бесплодие по всему миру наблюдается примерно в 50 % случаев бесплодия семейных пар. Мужчины постсоветских стран — не исключение. К тому же, доказано, что оплодотворяющая способность здоровой спермы такая же, как и здоровых яйцеклеток — 23–24 %.11.1.1. Изменения спермы во влагалище
Сперма, попадая во влагалище женщины, должна быть не просто качественной, но и должна пройти через ряд изменений (таким изменениям подвергается также сперма всех млекопитающих при попадании во влагалище самки). Это процесс созревания, капацитации, продвижения через канал шейки матки, полость матки в маточные трубы. После полового акта основная масса спермы накапливается в заднем своде влагалища, которое в силу своей растяжки и увеличения размеров (но только при хорошем возбуждении женщины) становится своеобразным мешотчатым резервуаром для спермы. Именно здесь все ингредиенты спермы равномерно смешиваются, в считанные минуты она сжижается под влиянием ферментов и обретает желатиноподобную структуру, фактически концентрируя сперматозоиды вместе, не позволяя им «теряться» во влагалище. Одновременно ферменты из сока простаты начинают обратный процесс — процесс разжижения спермы, или ее декоагуляции. Этот процесс тоже занимает несколько минут, но чаще всего не больше 15 минут. Капацитация — это обретение сперматозоидами свойств, которые позволят им оплодотворить яйцеклетку: сперматозоиды становятся подвижнее, обретают шаровидную форму, их оболочка теряет ряд веществ, препятствующих соединению сперматозоидов с яйцеклеткой. Во всем эякуляте здорового мужчины (а значит, здоровой спермы) только 10 % сперматозоидов активируются, что позволяет им обрести оплодотворяющие качества — остальные сперматозоиды оплодотворяющей активностью не обладают. Другая особенность капацитации — измененные сперматозоиды живут недолго (1–4 часа в лабораторных условиях, внутри маточных труб — неизвестно, хотя старые данные предполагали наличие оплодотворяющих способностей до 3 дней). Только небольшое количество сперматозоидов достигает маточных труб. До капацитации сперматозоиды движутся прямолинейно, после нее их движения (гиперактивная подвижность) становятся непрямолинейными, колебательными, чем-то напоминающие колебания маятника.11.1.2. Термотаксис и хемотаксис
По трубам сперматозоиды движутся под «руководством» двух важных механизмов — термотаксиса и хемотаксиса. Термотаксис подразумевает направленное движение сперматозоидов в зону оптимальной температуры, а хемотаксис — это перемещение в направлении оптимальных концентраций определенных веществ. Маточная полость и маточные трубы всегда содержат определенное количество жидкости с рядом органических веществ. Фолликулярная жидкость тоже богата гормонами. За последние 20 лет проведено детальное изучение хемотаксиса сперматозоидов. Только те сперматозоиды, которые прошли капацитацию (10 % от общего количества), являются хемотаксическими, то есть могут передвигаться в направлении концентрации определенных биологически активных веществ. Дальше, в ампулярной части трубы, происходит проникновение сперматозоида под оболочки яйцеклетки, его прикрепление через так называемую акросомную реакцию и потом проникновение уже непосредственно в ооцит. На словах весь этот процесс зачатия кажется простым, но в реальности (в жизни) он сопровождается выработкой многих веществ, созданием многочисленных взаимосвязей, образованием большого количества сигналов на разных уровнях взаимоотношения мужского и женского начал.11.1.3. Роль прогестерона в активации сперматозоидов
Итак, попав в матку и оказавшись у входа в маточные трубы, сперматозоиды нуждаются в некоем путеводителе по маточным трубам, чтобы найти яйцеклетку, вышедшую из яичника, для осуществления зачатия. Оказалось, что таким маяком служит прогестерон, который является временным хемопритягательным градиентом. Интересно, что фолликулярная жидкость, полученная из фолликулов одних видов животных, может привлечь сперматозоиды других видов животных — такой феномен не зависит от вида животного. Подчеркнем, что целенаправленное движение сперматозоидов наблюдается только тогда, когда произошла овуляция и в одной из маточных труб имеется живая женская половая клетка — яйцеклетка. Непосредственно перед разрывом в доминантном фолликуле наблюдается высокая концентрация прогестерона — намного выше, чем в крови женщины. Когда фолликул лопается, из него выходит не только зрелая яйцеклетка, но и жидкость, содержащая прогестерон. Маточные трубы со стороны яичника расширены, напоминают воронку лейки и содержат специальные отростки — фимбрии и реснички, покрывающие внутреннюю стенку маточной трубы. Так как маточные трубы прилегают к яичникам (почти вплотную), после овуляции яйцеклетка вместе с большей частью содержимого пузырька попадает в воронку маточной трубы. Таким образом, в одной трубе концентрация прогестерона будет намного выше, чем в другой (очень редко овуляция может быть в двух яичниках одновременно, и чаще всего такой феномен наблюдается после искусственной индукции овуляции). При этом, чем ближе к яйцеклетке, тем больше концентрация прогестерона. Молекулы прогестерона влияют на кальциевые канальцы сперматозоидов молниеносно, повышая концентрацию кальция внутри половых клеток, особенно в его хвостике, от движения которого зависит подвижность сперматозоида. Причем этот процесс проходит вне всякой генной регуляции, потому что зрелые половые клетки несут половинный набор хромосом, а значит, генов. Если стимулировать только хвостики, отделенные от головок, эффект будет таким же — гиперактивация движений. Хвостики, в отличие от головок, нечувствительны к эстрогенам (эстрадиолу). Не все сперматозоиды реагируют на прогестерон одинаково. Реакция половых клеток зависит от количества рецепторов, размещенных на оболочке сперматозоида. Поэтому даже на повышение концентрации прогестерона мужские половые клетки будут реагировать по-разному: слабым ответом в виде незначительной активации, сильным ответом в виде гиперактивации и чрезмерно выраженным ответом, когда возникает остановка колебательных движений (арест). Так как ответная реакция сперматозоидов на прогестерон может зависеть от концентрации прогестерона и от времени воздействия, то говорят о пространственном градиенте и временном градиенте. Оказалось, что гиперактивацию вызывает временной градиент, в то время как пространственный понижает ее. Логично предположить, что чем выше концентрация прогестерона, тем активнее должны быть сперматозоиды. Но при постоянной стимуляции меньшими дозами прогестерона (временном градиенте) наблюдаются две фазы: сначала происходит задержка активации, а потом ее гиперактивация. При стимуляции высокими дозами отмечают задержку активации. Такая реакция определяется чувствительностью спермы к прогестерону. Гиперактивация сперматозоидов вызывается резким увеличением уровня концентрации ионов кальция в клетках сперматозоидов за счет массированного транспорта кальция через кальциевые каналы внутрь сперматозоида, что ускоряет акросомную реакцию. Эти каналы называются CatSper Ca2+-каналами, они были обнаружены только у самцов млекопитающих и являются специфическими для половых клеток, поэтому важны для процесса зачатия. По своему строению они состоят из четырех видов белков. Реакция прогестерона с кальциевыми каналами половых клеток значительно отличается от других реакций прогестерона, то есть с другими видами рецепторов.11.1.4. Акросомная реакция
Передняя часть головки сперматозоида имеет особое покрытие, состоящее из специальных маленьких структур-органелл, что-то наподобие колпака или шапки, и оно называется акросомой. Акросома содержит большое количество ферментов (энзимов). Акросома играет очень важную роль в проникновении сперматозоида внутрь женской половой клетки, и этот процесс проникновения называют акросомной реакцией. При контакте с яйцеклеткой сперматозоид «приклеивается» к ней благодаря акромосе, которая потом разрушается, выделяя огромное количество ферментов. Ферменты разрушают-расщепляют клеточные слои оболочки, открывая дорогу к продвижению головки сперматозоида. Часто в процессе разрушения оболочки принимают участие и другие сперматозоиды, но только одному удается добраться «до финиша», однако ферменты других мужских половых клеток помогают в продвижении «счастливчика». Акросомная реакция зависит от наличия прогестерона, эстрадиола и ряда других важных веществ, и акросома содержит прогестероновые рецепторы. Но эти рецепторы отличаются от кальциевых каналов-рецепторов, которые имеются в хвостике. Также в акросомную реакцию вовлечена протеинкиназа-А, особое вещество, регулирующее реакцию с прогестероном. Прогестероновые рецепторы хвостика в этом отношении имеют автономность. В природе зачатия должна быть определенная гармония-синхронизация во всем: и по времени, и по количеству, и по пропорции, в том числе по времени продвижения сперматозоидов, по их количеству и по их качеству. Ошибочно полагалось, что чем больше сперматозоидов, тем выше шанс зачатия. Наоборот, мужчины с большим количеством спермы и сперматозоидов страдают бесплодием. Это объясняется тем, что, атакуя половую яйцеклетку, стараясь попасть в нее, сперматозоиды могут повредить и даже разрушить ее, выделяя слишком большое количество ферментов из акросомного участка головок. В результате яйцеклетка гибнет или же происходит дефектное зачатие, приводящее впоследствии к ряду осложнений (пустое плодное яйцо, гибель эмбриона, внематочная беременность).11.2. Прогестерон и оплодотворение яйцеклетки
Процесс зачатия, как упоминалось раньше, является многоступенчатым, поэтапным процессом. С акросомной реакции и проникновения сперматозоида в цитоплазму яйцеклетки фактически начинается новый этап — возникновение зачатка. Длина головки сперматозоида составляет 5 мкм, ширина — 3,5 мкм, высота — 2,5 мкм, средний участок и хвостик — соответственно 4,5 и 45–50 мкм в длину. Диаметр яйцеклетки составляет приблизительно 120–170 мкм (меньше 1 мм). Таким образом, по размерам женская половая клетка приблизительно в 35–40 раз больше мужской половой клетки (без хвостика). На рисунке представлена примерная пропорция размеров сперматозоида и яйцеклетки. Помимо того, что женская половая клетка большая, ее оболочка по сравнению с таковой у сперматозоида очень толстая и прочная (вспомните куриное яйцо для сравнения). Снаружи она окружена блестящей оболочкой, состоящей из мукополисахаридов, и покрыта лучистым венцом, или фолликулярной оболочкой, которая представляет собой микроворсинки фолликулярных клеток. По толщине такая оболочка больше размеров сперматозоидов, поэтому чтобы проникнуть внутрь яйцеклетки, сперматозоид должен «пробурить» отверстие-тоннель. К слову, в репродуктивной медицине при проведении ЭКО врачи нередко используют лазерное «сверление» отверстий в оболочке яйцеклеток, что не всегда удается проделать из-за большой ее толщины. Вхождение сперматозоида в яйцеклетку является кратковременным процессом, как и процесс овуляции, хотя ему предшествуют многие другие этапы зачатия.
11.2.1. Продвижение плодного яйца по маточным трубам
Оплодотворенная яйцеклетка движется по маточной трубе к матке, проходя при этом несколько делений, — так возникает зародыш. Процесс этого передвижения занимает от 4 до 6 дней. Приблизительно через 30 часов после оплодотворения яйцеклетки сперматозоидом происходит ее первое деление, от которого во многом будет зависеть протекание и всей беременности. Ученые, занимающиеся вопросами репродуктивных технологий, позволяющих создавать эмбрионы искусственно, выяснили, что если самое первое деление произошло с осложнениями, неравномерно, то плодное яйцо может быть некачественным. Это приведет к его плохой имплантации, а значит, такая беременность в большинстве случаев закончится ее естественным (природным) прерыванием. Поэтому неудивительно, что большая часть зачатого материала (продуктов концепции) отсеивается из-за брака. Клетки, которые возникают при делении оплодотворенной яйцеклетки, называются бластомерами, а сам эмбрион в таком состоянии — зиготой. Сначала деление происходит без роста этих клеток, то есть размеры эмбриона сохраняются теми же. Когда зародыш достиг 16-клеточного строения, происходит дифференциация его клеток и их увеличение в размерах. На этом этапе деления плодное яйцо называется морулой, и в таком состоянии оно входит в полость матки. Деление продолжается, и как только появляется жидкость внутри морулы, эмбрион называется бластоцистой. Бластоциста содержит примитивные ворсины — хорион (отсюда и название гормона — «хорионический гонадотропин»), с помощью которых начинается процесс имплантации.11.2.2. Гибель эмбрионов после зачатия
Почему большинство зачатий все же не приводит к возникновению беременности? Что вызывает гибель эмбрионов? Почему не происходит имплантация плодных яиц? Эти и многие другие вопросы интересуют как врачей, так и женщин, пытающихся зачать потомство. Необходимо понять важный факт, что высокие потери эмбрионов на ранних сроках беременности наблюдаются не только у людей, но и в животном мире — это часть процесса жизни, и управлять этим процессом невозможно. Остается только принять этот факт, который многим может показаться неприятным. Фертильность животных сельского хозяйства изучена намного детальнее, то есть репродуктивные технологии по улучшению плодовитости сельскохозяйственных животных начали применяться лет на 30 лет раньше, чем у людей. Известно, например, что более 60 % потерь беременностей на ранних сроках наблюдается у коров, причем до 80 % этих потерь выпадают на первые дни развития эмбриона и имплантации (между 8-м и 16-м днем после зачатия). Практически такие же показатели наблюдаются и у людей. Интересно, что в ветеринарии и репродуктивной медицине животных существует понятие эмбриональной смертности, которое характеризует гибель эмбрионов от момента зачатия и до окончания дифференциации. Высокие потери эмбрионов и низкая фертильность животных в определенных условиях их содержания приводят к постоянному поиску факторов и способов, повышающих плодовитость животных и выживание зачатого потомства. И благодаря этому интенсивному поиску в ветеринарии репродуктивная медицина людей имеет развитие тех технологий и методов лечения бесплодия, которые применяются в современных гинекологии и акушерстве. Проблема существует в том, что многие врачи до сих пор не ознакомлены с достижениями репродуктивных технологий в животноводстве, потому что мало кто из врачей интересуется вопросами ветеринарии. Между публикациями ученых-животноводов и ученых-врачей существует большая пропасть из-за отсутствия своевременного обмена информацией. Что влияет на гибель плода? Это в первую очередь генетические, физиологические, эндогенные факторы и факторы внешней среды (экзогенные), причем генетический играет первостепенную роль — при наличии поломки на генетическом или хромосомном уровне развитие нормального, здорового потомства невозможно. Высокий уровень генетически-хромосомных дефектов наблюдается у всех животных, а также у человека. Законы природы одинаковы на любом уровне животного мира — отбрасывается то, что непригодно для нормального развития. Ошибочно ставить человека на какой-то более высокий уровень развития в отношении продолжительности рода. Наоборот, у человека появилось немало ограничений в создании потомства — уровень фертильности по сравнению с животными меньше, многоплодная беременность стала патологической беременностью, а не нормой, из-за особенностей протекания беременности у людей. Увеличение размеров мозга, а значит, головы, привели к тому, что рождение ребенка проходит с большими трудностями и большим количеством осложнений. Возраст — это враг № 1 нормального зачатия. О том, что с возрастом уровень плодовитости (фертильности) понижается, люди знали всегда, поэтому браки создавались в раннем возрасте, фактически в период полового созревания или сразу же после его завершения. В 1895 году американский врач Др. Дункан опубликовал труд, посвященный вопросам зачатия, бесплодия и их взаимосвязи с возрастом женщин. За последние пятьдесят лет возраст женщин, когда они начинают планировать потомство, значительно постарел и достиг 30–37 лет во многих странах. К этому времени у многих женщин появляются признаки возрастной яичниковой недостаточности, когда функция этих важных органов постепенно угасает и резерв фолликулов значительно уменьшается. Качество половых клеток также кардинально ухудшается, что сказывается не только на процессе зачатия, но и последующих этапах жизни оплодотворенной клетки — ее делении и способности имплантироваться. И очень часто врачи, вместо объяснения влияния возрастного фактора на процесс зачатия и анализа ситуации, назначают прогестерон (дюфастон, утрожестан) то для регуляции менструальных циклов, то для лечения «прогестероновой недостаточности», то для «улучшения имплантации», что всегда неэффективно, а период бесплодия растягивается на месяцы и годы. Исследования на животных показали, что удаление яичников в первые дни или недели беременности приводит к нарушению беременности — замедленному продвижению эмбрионов по маточным трубам, их гибели, нарушению имплантации. Однако оказалось, что эстрадиол играет куда большую роль (в два раза больше) в продвижении плодного яйца, чем прогестерон. Назначение эстрадиола у животных после удаления яичников нормализует продвижение зачатков по маточным трубам, но не повышает их живучести в полости матки даже при корректировке прогестероном. Этот женский половой гормон принимает также участие в трансформации морулы в бластоцисту, на стадии которой начинается имплантация. Прогестерон тоже принимает участие в продвижении плодного яйца по маточным трубам. При отсутствии эстрогенов после удаления яичников он улучшает продвижение эмбрионов в полость матки, а также дифференциацию бластоциста. Однако ни один из гормонов (ни эстрадиол, ни прогестерон) не имеют преимущества друг перед другом в отношении возникновения нормальной беременности через нормальную имплантацию плодного яйца. Наоборот, исследования подтвердили факт, что в природе важно взаимодействие этих двух гормонов, иначе беременность не возникнет. Влияет ли прогестерон непосредственно на эмбрион? Чтобы гормон был усвоен, считается, что ткани должны иметь рецепторы прогестерона. Такие рецепторы не найдены у эмбрионов многих животных на очень ранних стадиях развития эмбриона, однако у бластоцист ряда животных прогестероновые рецепторы были обнаружены. Это натолкнуло на мысль, что в первые дни после зачатия влияния прогестерона на эмбрион, скорее всего, не наблюдается, а его воздействие на эмбрион происходит непрямым путем — через женский генитальный тракт и реакцию организма матери на плодное яйцо. Независимо от того какой имеется уровень эстрадиола, прогестерон значительно влияет на исход менструального цикла. В то же время эстрадиол может негативно повлиять на эмбрион, и меньше — на эндометрий, тогда как прогестерон, наоборот, больше влияет на эндометрий, чем эмбрион. Исследования на сельскохозяйственных животных подтвердили тот факт, что низкий уровень прогестерона в цикле до имплантации сопровождается большей гибелью эмбрионов и нарушением их имплантации. Однако применение экзогенного прогестерона вызывало разный эффект в зависимости от дня цикла и путей введения прогестерона. Например, внутримышечное введение прогестерона показало незначительный подъем уровня фертильности у коров, Использование внутриматочных гормональных средств (спиралей), содержащих прогестерон, улучшало уровень беременностей у самок крупного рогатого скота, но оказывало контрацептивный эффект у женщин. Назначение прогестерона со второй половины лютеиновой фазы у животных (с 14-го или 17-го дня по 21-й день цикла у коров) не повышало уровень возникновения беременностей и вынашивание беременности у животных с нормальным уровнем гормона. У животных с незначительным понижением уровня прогестерона (минимальная норма) назначение экзогенного прогестерона улучшало уровень фертильности. Но у самок с низким уровнем этого гормона экзогенный прогестерон эффекта не оказывал и уровень фертильности не повышал. Взаимодействие эстрогенов и прогестерона необходимо для прогресса беременности. Оно объясняется тем, что эти гормоны могут воздействовать непосредственно на эмбрион и на генитальный тракт, и при излишке или нехватке одного из них, когда нарушается здоровая пропорция — баланс гормонов, беременность не возникает и прерывается (из-за гибели эмбриона или неподготовленности репродуктивных органов). Никто из врачей до сих пор не знает, какими должны быть «здоровые» пропорции этих двух разных гормонов, то есть как определяется баланс между эстрадиолом и прогестероном. Уровни этих гормонов в крови женщины абсолютно не отражают такого баланса, так как показывают количественное определение гормонов, и, к тому же, эти уровни могут меняться не только по дням, но и по часам — по законам природы, неизвестным врачам. То, что в природе является «балансом гормонов», может не вписываться в понятие баланса врачами, и наоборот, то, что врачи называют нормой, может быть отклонением для конкретной женщины, конкретной беременности. Многочисленные исследования на животных и людях, которые проводятся более 60 лет, как раз и показывают, что многие теоретические гипотезы в отношении значения половых гормонов и прогестерона оказались ложными, но почему-то ими до сих пор пользуются многие врачи в своей практической деятельности.11.3. Прогестерон и имплантация
Процесс прикрепления плодного яйца к внутренней стенке матки называется имплантацией. Имплантация эмбриона остается одной из самых сложных загадок природы, несмотря на объемный научно-исследовательский поиск в этом направлении. Это также непредсказуемый процесс — даже при самом отличном здоровье матери, при хорошей подготовке эндометрия матки, при качественных эмбрионах прогноз возникновения беременности и ее прогресса всегда неизвестен. Тем не менее, и при таких «белых пятнах» в понимании процесса имплантации врачи стараются изучить и понять действие всех тех негативных факторов, которые приводят к нарушению имплантации. И здесь уже получено очень много интересных и важных данных. Успешность имплантации зависит в первую очередь от трех важных факторов: (1) качества эмбриона, (2) морфологического качества эндометрия матки, то есть состояния клеток выстилки матки, и (3) биохимического качества эндометрия, или наличия в тканях матки необходимых гормональных и других веществ. На процесс имплантации могут влиять и многие дополнительные факторы. Качество эмбриона определяется генетическими и хромосомными факторами, а также процессом деления эмбриона, и медицина здесь совершенно бессильна. Морфологические, то есть клеточные, изменения эндометрия также во многом зависят от генетических факторов и особенностей реакции эндометрия как ткани-мишени на гормоны яичников. Работа яичников и выработка ими достаточного количества гормонов определяют не только морфологическое качество эндометрия, но и, в первую очередь, биохимическое. Изменения на клеточном и биохимическом уровнях внутренней выстилки матки проходят одновременно и зависимы друг от друга.11.3.1. Децидуальная ткань
Прикрепление плодного яйца — не кратковременный процесс, он занимает определенный промежуток времени и имеет строгую стадийность. И пока оплодотворенная яйцеклетка движется по маточной трубе, в матке происходят изменения, способствующие в дальнейшем нормальной имплантации. Одно из таких изменений — это децидуализация эндометрия, о которой уже упоминалось выше. Процесс децидуализации у большинства млекопитающих начинается только после получения сигналов от эмбриона в месте имплантации плодного яйца. При отсутствии беременности истинная децидуализация наблюдается очень редко, в основном только у людей и ряда менструирующих видов животных. Некоторые врачи считают, что между децидуальной реакцией эндометрия и децидуализацией существует разница. Децидуальная реакция наблюдается в каждом овуляторном цикле во вторую фазу и проявляется изменениями клеток эндометрия при подготовке к беременности. По одним данным, этот процесс обратимый, если не произошла беременность. По другим данным, процесс необратим и именно поэтому для подготовки к новому циклу и будущей беременности такая ткань должна быть отторгнута маткой. Отторжением децидуального измененного эндометрия объясняют возникновение менструации. Под децидуализацией часто понимают изменения эндометрия при беременности с образованием особой клеточной прослойки эндометрия, которая называется децидуальной тканью. При возникновении беременности децидуальные изменения в эндометрии проходят интенсивнее: клетки накапливают гликоген и жиры, увеличиваются в размерах. В эндометрии усиливается рост сосудов. Децидуализация имеет интересное воздействие на клетки эндометрия, фактически блокируя их смерть через апоптоз, который возникает после отмены прогестерона. Кроме того, она повышает устойчивость эндометрия к повреждению клетки в результате окислительного стресса. Роль децидуальной ткани до сих пор не изучена до конца, но считается, что эта ткань контролирует глубокое и повреждающее внедрение плодного яйца в стенку матки, являясь своеобразной прослойкой между трофобластом, а потом и плацентой, и стенкой матки. Децидуальная реакция является неотъемлемой частью имплантации.11.3.2. Пиноподы
Изменяется не только «внешний вид» внутренней полости эндометрия, но и сами клетки эндометрия. В период окна имплантации ядра клеток передвигаются ближе к базальной мембране (прячутся внутрь), чтобы не быть поврежденными хорионом. Цитоплазма с вакуолями перемещается к краю, то есть ближе к полости матки. Рост уровня прогестерона приводит также и к тому, что в эндометрии появляются специальные формирования — пиноподы, которые чем-то напоминают щупальца (пальцы). В нормальном менструальном цикле пиноподы возникают почти у 80 % женщин с 5-го дня после овуляции (19-й день цикла) и регрессируют на 8-й день после овуляции (22-й день цикла при 28-дневном цикле).
Пиноподы возникают также при искусственно вызванных и контролируемых циклах, и их появление и регрессия зависят от продолжительности приема прогестерона. Появление пиноподов приводит к тому, что матка уменьшается в размерах, как бы сжимается за счет этих выступов вовнутрь, а сама полость тоже уменьшается в размерах, приближая стенки матки к плавающему в ней плодному яйцу — природа уменьшает дистанцию между маткой и плодным яйцом для успешного его прикрепления. Пока плодное яйцо не прикреплено к матке, источником его питания становится внутриматочная жидкость, выделяемая клетками эндометрия под влиянием высокого уровня прогестерона. Строение пиноподов, их появление и исчезновение в зависимости от уровня прогестерона изучалось многими исследователями. Гистологическое исследование образцов эндометрия, взятого в разные дни цикла и после введения гонадотропинов для стимуляции овуляции, показывает, что преждевременная лютенизация зависит от дня введения гонадотропинов.
11.3.3. Окно имплантации
Несмотря на то что секреторные изменения в эндометрии в лютеиновую фазу проходят после овуляции в постоянном режиме до момента регрессии желтого тела, не каждый день второй фазы является оптимальным для успешной имплантации. В репродуктивной медицине существует понятие окна имплантации, которое подразумевает период наиболее оптимальных изменений в эндометрии, когда имплантация возможна. Вне этого окна прикрепление плодного яйца невозможно. До сих пор нет четких данных о том, сколько длится окно имплантации у людей. По одним данным, оно возникает с 5-го по 7-й день после овуляции (неполных 3 дня). По другим данным, оно длится 3.5 дня. По третьим данным, продолжительность рецептивной фазы — 7 дней. В репродуктивной медицине менструальный цикл часто создается и контролируется искусственно, поэтому считается, что самыми оптимальными для принятия 4–12-клеточных эмбрионов являются 17–19-е дни искусственно созданного цикла, когда прием прогестерона начат на 15-й день цикла. Исследования также показали, что окно имплантации при искусственно созданных циклах зависит от стадии развития плодного яйца и от видов и режимов гормонов, используемых при проведении ЭКО.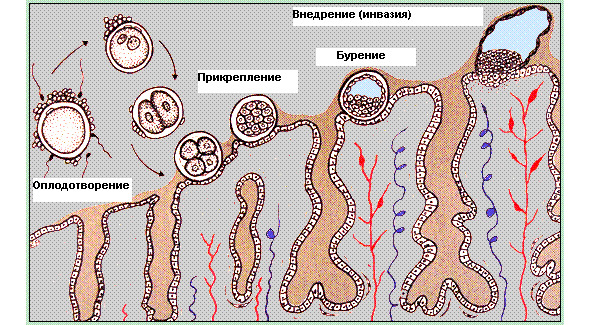
Известно, что имплантация плодного яйца имеет три стадии: прикрепление (приклеивание, или адгезия) к эндометрию, бурение (пенетрация) эпителия и внедрение (инвазия) в стенку матки для питания через материнские кровеносные сосуды. Первый этап прикрепления начинается на 21–22-й день менструального цикла и не сопровождается кровотечением. Второй этап бурения теоретически может сопровождаться кровотечением, но практически данные о кровотечении на 23–25-й день менструального цикла отсутствуют. Кровянистые выделения на 27–31-й день цикла отмечаются чаще всего. Не исключено, что это кровотечение имплантации, так как в этот период сосуды матки частично повреждаются в процессе становления «взаимоотношений» с плодным яйцом.
11.3.4. Эндометриальный пролактин
Между пролактином, эндометрием и возникновением беременности существует тесная взаимосвязь. Активность эндометриального пролактина и рецепторов пролактина важны в передаче сигналов в период децидуализации эндометрия и имплантации.Нехватка эндометриального пролактина в период имплантации наблюдается у женщин, страдающих бесплодием и повторными спонтанными выкидышами. Такие же результаты получены при изучении роли пролактина эндометрия на животных моделях. У женщин, страдающих эндометриозом, тоже наблюдается нарушение усвоения пролактина. Достоверных данных о том, что эндометриоз повышает риск спонтанных абортов, все же не существует. У старших женщин (после 39 лет), а также страдающих эндометриозом, может наблюдаться нечувствительность к прогестерону (повышенная резистентность). Вопрос о назначении им поддерживающей терапии прогестероном перед имплантацией и в первые дни беременности спорный, и большинство врачей не рекомендует применение прогестерона хотя бы потому, что такая терапия не гарантирует лучшего усвоения гормона.11.3.5. Прогестерон и иммунологическая реакция на беременность
Так как плодное яйцо (эмбрион) является инородным телом для женщины, реакция ее организма на беременность основана на иммунологическом ответе, что доказано многочисленными исследованиями. При беременности доминирует гуморальный иммунитет, поэтому увеличивается выработка антител, в то время как клеточный иммунитет, когда специальные клетки (белые клетки крови) уничтожают попавшие в организм инородные тела, в том числе продукты зачатия, значительно понижается, что предотвращает реакцию отторжения плодного яйца. В главах, посвященных менструальному циклу, упоминалось о значении воспалительной реакции, насыщенности эндометрия разными иммунологическими факторами, в том числе лимфоцитами. Два важных вида лимфоцитов имеются в эндометрии, а также циркулируют в крови женщины. Т-хелперы 1 (Th1) отвечают за клеточный иммунитет, выделяя специальное вещество — цитокинин гамма-интерферон. Т-хелперы 2 (Th2) отвечают за гуморальный иммунитет и выработку антител. Беременность называют Th2-феноменом, потому что при нормальной имплантации при беременности происходит сдвиг из Th1-состояния, доминирующего до беременности, в Th2-состояние. Считается, что прогестерон играет роль иммуномодулятора, контролирующего трансформацию доминирования клеточного в гуморальный иммунитет при беременности. Прогестерон также понижает активность других клеток иммунной защиты на клеточном уровне и стимулирует выработку так называемых ассиметричных антител. Ассиметричные антитела принадлежат к IgG классу антител. Здоровая беременность сопровождается наличием почти 30 % ассиметричных антител по сравнению с патологической беременностью или у небеременных женщин. Особенность этих антител в том, что они маскируют клеточные элементы плода (плодного яйца и эмбриона), не позволяя защитной системе матери включить другие механизмы защиты, то есть предотвращают реакцию полной иммунной защиты от инородных тел. Во время беременности активированные лимфоциты в присутствии прогестерона начинают вырабатывать белок — прогестерон-индуцированный блокирующий фактор (PIBF), который влияет на иммуномодулирующий эффект прогестерона. Этот фактор вызывает Th1/Th2 сдвиг. При нормальной беременности уровень прогестерон-индуцированного блокирующего фактора растет вплоть до 37 недель беременности.11.3.6. Влияние экзогенного прогестерона на имплантацию
Уровень прогестерона колеблется в течение всего менструального цикла. Но колебания этого гормона также зависят и от вмешательства врачей. Еще в 90-х годах врачи репродуктивной медицины заметили, что имплантация зависит не только от уровня прогестерона в лютеиновую фазу, но и от его уровня в фолликулярную фазу. При проведении индукции овуляции для получения ооцитов и потом эмбрионов было замечено повышение уровня прогестерона в конце фолликулярной фазы, то есть перед овуляцией. Оказалось, что, если уровень этого гормона в сыворотке крови превышает 1.5 нг/мл, значительно нарушается имплантация эмбрионов. Причину такого явления объясняли негативным влиянием прогестерона на яйцеклетки, полученные путем стимуляции яичников. Сравнительный анализ качества яйцеклеток и уровня имплантации у женщин-доноров яйцеклеток и женщин, которые пользовались собственными ооцитами, опроверг это предположение и показал, что при использовании донорских яйцеклеток уровень имплантации не понижается. Это натолкнуло ученых на мысль, что повышение уровня прогестерона перед овуляцией у женщин, использовавших индукцию овуляции, влияет не на качество яйцеклеток и эмбрионов, а непосредственно на эндометрий матки. Дальнейшие исследования показали, что после подъема уровня прогестерона перед овуляцией у женщин происходило ускоренное созревание эндометрия, что кардинально меняло чувствительность прогестероновых рецепторов. Такие изменения чаще всего наблюдались после применения гонадотропинов для стимуляции овуляции буквально на следующий день, и они соответствовали первому дню лютеиновой фазы, хотя овуляция еще не наступила. Другими словами, на момент подсадки эмбрионов эндометрий был уже старым и некачественным, хотя уровень прогестерона в крови был в норме. Фактически окно имплантации в таких циклах было потеряно. Было также обнаружено, что низкий уровень прогестерона действуют на уровне генов эндометрия, нарушая активность 140 генов из 340, что в два раза больше, чем при нормальном уровне гормона. Репродуктивные технологии всегда имеют две стороны: одна позволяет получить яйцеклетки для их оплодотворения и дать возможность женщине иметь потомство, другая — негативное влияние комбинации различных лекарств на качество яйцеклеток, эндометрий и организм женщины в целом. Целью современной репродуктивной медицины является максимальное приближение процесса искусственного оплодотворения и подсадки эмбрионов к естественным процессам, происходящим в женском организме при возникновении беременности.11.4. Желтое тело беременности
Желтое тело беременности — это не что иное, как желтое тело яичника, возникшее после овуляции. До момента имплантации желтое тело вырабатывает прогестерон независимо от наличия плодного яйца. Но с получением первых сигналов о беременности через несколько возможных механизмов передачи таких сигналов, в том числе в результате выработки определенных веществ, желтое тело продолжает функционировать. Оно функционирует до тех пор, пока не произойдет лютео-плацентарный сдвиг и плацента (трофобласт с хорионом) не начнет вырабатывать собственный прогестерон. То, что прогестерон является основным гормоном, вырабатываемым яичниками, было известно более шестидесяти лет тому назад, когда удалось получить его чистую кристаллическую форму. Однако длительное время правильное понимание роли желтого тела было затруднено. Вытяжку желтого тела чаще всего получали из яичников животных, начиная от мелких (мыши, крысы) и заканчивая крупным рогатым скотом. У беременных коров желтое тело больших размеров в виде кисты — лютеомы. Именно из яичников коров был получен прогестерон в твердой форме. Однако в те далекие времена врачи, а тем более ученые-биохимики, не знали, что прогестерон вырабатывается у беременных самок разных животных по-разному, то есть у одних основным источником является желтое тело во время беременности, а у других — плод и плацента. У коров успешное протекание беременности полностью зависит от прогестерона желтого тела. У свиней беременность зависит от уровня прогестерона, вырабатываемого желтым телом в яичниках и плацентой. У овец первая половина беременности зависит от выработки прогестерона желтым телом, но после 122 дней беременности 90 % всего прогестерона вырабатывается плодом и плацентой. Таким образом, у каждого вида млекопитающих источники прогестерона во время беременности разные, как и роль прогестерона тоже. Моделирование беременности у человека по типу беременности у коров привело к возникновению ложных выводов. Ранние эксперименты на разных моделях животных в 20–30-е годы прошлого столетия показали, что удаление яичников на ранних сроках беременности приводит к потере беременности, поэтому ученые-врачи предположили, что именно вещество желтого тела ответственно за возникновение и развитие беременности. Первые исследования о значении желтого тела проводились на животных более 60 лет тому назад, а с участием женщин — более 40 лет тому назад — на заре возникновения репродуктивной медицины. И результаты этих старых исследований легли в основу тридцатилетней практики использования прогестерона после ЭКО и ряда других АРТ. Но вопрос продолжительности назначения прогестерона оставался открытым и вызывал немало споров и обсуждений среди врачей. Исследования 70–80-х годов показали, что удаление желтого тела в период до 7 недель беременности приводит к понижению уровня прогестерона и потере беременности. А удаление желтого тела в 8 недель и позже на уровне прогестерона не отражается и к потере беременности не приводит. Уровни лютеинового прогестерона подтверждают активность желтого тела только до 7–8 недель беременности. Назначение прогестерона до 7 недель беременности после лютеоэктомии (удаления желтого тела) позволяет предотвратить потерю беременности при условии, что яйцо — плодное. Намного позже, с развитием репродуктивной медицины, оказалось, что прогестерон желтого тела играет роль в поддержке беременности у женщин только до 4–5 недель беременности (первые три недели после зачатия), а к 7–8 неделям основным источником прогестерона становится плацента.11.4.1. А не подавляет ли рост ХГЧ функцию желтого тела?
Во всех без исключения публикациях, особенно старых, во всех учебниках, и даже в моих публикациях, в том числе на страницах этой книги, не раз упоминается, что ХГЧ поддерживает функцию желтого тела беременности. Фактически это догма, в которую верят все врачи и женщины, за редким исключением. Это своеобразная врачебная привычка, выработанная в связи с принятием данных исследований полувековой давности. Но насколько такое утверждение достоверно? Ведь до сих пор не найдена, как и не доказана, зависимость выработки ХГЧ от выработки прогестерона и, наоборот, зависимость выработки прогестерона от выработки ХГЧ. Давайте посмотрим на графики уровней прогестерона, лютеинового и плацентарного, и ХГЧ в зависимости от срока беременности.В предыдущей главе упоминалось, что пик функции желтого тела отмечается в 4–5 недель, а к 7–8 неделям эта функция прекращается. Плацентарный прогестерон начинает вырабатываться с началом имплантации плодного яйца, как и ХГЧ в целом.

Пик ХГЧ наблюдается до 9–10-й недели, а дальше его уровень быстро понижается и, достигнув уровня 6 недель, практически не поднимается всю беременность, за исключением коротких периодов во второй половине беременности. Одновременно рост плацентарного прогестерона сильно повышается, несмотря на падение уровня ХГЧ. А не подавляет ли на самом деле растущий уровень ХГЧ выработку прогестерона желтым телом беременности? Если бы он стимулировал выработку лютеинового прогестерона, то дополнительное введение ХГЧ помогало бы сохранять беременности, потому что оно воздействовало бы на имплантацию и стимулировало бы желтое тело. Но, согласно данным многочисленных экспериментов, этого не происходит. Если внимательно проследить за выработкой прогестерона желтым телом беременности, то пик выработки обнаруживается как раз во время имплантации — 3–5 недель беременности. Известно, что имплантация длится две недели, и первые 7 дней играют важную роль в процессе прикрепления плодного яйца. Если не возникла биохимическая беременность, которая характеризуется гибелью эмбриона в первые 7 дней имплантации, прикрепление продолжается еще неделю, а уже потом развитие плаценты происходит вплоть до 20 недель. Лютеиновый прогестерон принимает непосредственное участие в имплантации, но только первые 2–3 недели, и об этом знают врачи, занимающиеся репродуктивной медициной. Важно понимать, что с 5-й недели беременности лютеиновый прогестерон начинает понижаться, в то время как ХГЧ начинает интенсивно расти, практически удваиваясь с 4–5-й недели. Значит, в стимуляции желтого тела важную роль играет далеко не ХГЧ. Тогда что же? Очевидно, эмбрион, путешествующий по маточной трубе в полость матки и ожидающий сигнала для имплантации (этот процесс занимает обычно 7 дней), выделяет какие-то особые вещества, которые поддерживают работу желтого тела и продукцию лютеинового прогестерона. Это может быть тау-интерферон, это может быть шаперонин 10, это может быть специфический белок раннего фактора беременности, это может быть вещество, которое ученые пока что не обнаружили. Но уровень ХГЧ начинает расти только с появлением хориона, и он все еще очень низкий в первую неделю после зачатия, в то время как функция желтого тела не меняется в этот период. И, наоборот, как только ХГЧ начинает интенсивно расти, производство лютеинового прогестерона начинает понижаться, и к 7 неделям его уровень обычно падает значительно, в то время как начинает расти уровень плацентарного прогестерона. Несмотря на то что с ростом ХГЧ наблюдается рост плацентарного прогестерона, это все же два независимых процесса. Связь между уровнями ХГЧ и плацентарного прогестерона не найдена. Ведь после пика выработки ХГЧ понижается до очень низких уровней, в то время как выработка прогестерона плацентой продолжается в определенной прогрессии. Таким образом, догма о том, что ХГЧ стимулирует функцию желтого тела беременности, вызывает сомнение у все большего количества врачей, в том числе и у меня, и, скорее всего, это утверждение является ошибочным.
11.5. Влияние прогестерона на другие гормоны
Так как уровни прогестерона при беременности повышаются, автоматически повышаются уровни его производных — половых гормонов, особенно женских половых гормонов. Прогестерон стимулирует выработку гормона роста, который вырабатывается в гипофизе матери и плода. Интенсивный рост плода зависит от достаточного уровня этого гормона. Два других важных гормона, которые очень близки по строению гормону роста, также стимулируют рост тканей: в организме женщин — это пролактин, в плаценте — это плацентарный лактоген. При беременности количество этих гормонов значительно повышается. Молочные железы у беременных женщин начинают расти, увеличиваясь в размерах и готовя женщину к обеспечению ее функции не только вынашивания потомства, но и обеспечения этого потомства необходимыми питательными веществами в первый год жизни за счет грудного кормления. Прогестерон и пролактин, как брат и сестра, стимулируют этот рост. Плацентарный лактоген называют хорионическим соматотропином, или хорионическим гормоном роста, подчеркивая его тесную связь с человеческим гормоном роста, хотя по силе воздействия на клетки этот гормон в 100 раз слабее гормона роста. Название «лактоген» также говорит о том, что по действию этот гормон близок к действию пролактина. Таким образом, плацентарный лактоген является еще одним стимулирующим гормоном для молочных желез женщины. Плацентарный лактоген, как и прогестерон, влияет на уровень сахара в крови матери — кровь у беременных женщин, особенно в состоянии стресса, становится более «засахаренной», что является важным звеном в обеспечении растущего плода необходимой энергией и питательными веществами. Рост уровней прогестерона повышает количество многих важных гормонов во время беременности, чем и обусловливается нормальный рост плода. Бояться повышения роста этих гормонов не следует, а тем более применять какие-то лекарственные препараты с целью их «коррекции». Вмешательство в этот сложный процесс взаимоотношений гормональных веществ в организме матери и плода может закончиться прерыванием беременности.11.6. Прогестерон — гормон защиты
Известно, что все стероидные гормоны, в том числе прогестерон, влияют на иммунную систему человеческого организма. Прогестерон нужен плоду не только для синтеза собственных гормонов, но и как гормон защиты. В экспериментах на разных животных моделях ученые определяли уровень прогестерона у потомства, но такие опыты на эмбрионах животных не проводились. Также мало изучен обмен прогестерона у плода человека, как и наличие прогестероновых рецепторов у эмбриона и плода. Прогестероновые рецепторы на стадии бластоцисты (до 5-го деления клеток) и раннего органогенеза у человека не были обнаружены. Но в позднем эмбриональном периоде (10–12 недель) были найдены ПР, в основном ПР-В, во многих тканях и органах — в сердце, печени, почках, селезенке, поджелудочной железе, кишечнике, щитовидной железе, надпочечниках, яичниках, матке. На более поздних сроках развития плода ПР находили только в репродуктивной системе, поджелудочной железе и ряде клеток. Большое количество мембранных прогестероновых рецепторов имеется у плодов-девочек, в основном в репродуктивных органах. Прогестерон метаболизируется не только органами-мишенями (маткой и молочными железами), но также клетками мозга. Мозг содержит высокие концентрации прогестерона. Этот гормон метаболизируется также клетками крови, участвующими в защитных реакциях. Полиморфноядерные лейкоциты и моноциты, количество которых повышается при воспалительных заболеваниях, стрессовых ситуациях, используют прогестерон, превращая его в три продукта обмена. Так как беременность сопровождается повышенным уровнем лейкоцитов (лейкоцитозом), прогестерон помогает в становлении баланса между иммуноподавляющими и иммуностимулирующими процессами. Тимус, или вилочковая железа, которая является ключевым моментом иммунологической системы, вырабатывает Т-лимфоциты, но, оказывается, ее работа тоже зависит от нормального уровня прогестерона. Иммунная система при беременности «нормальная» только относительно. Ведь для принятия плодного яйца защитные силы должны быть подавлены. Эту функцию выполняет не только ХГЧ, вырабатываемый хорионом, но и прогестерон — он действует в первую очередь на местном уровне, то есть на уровне матки, блокируя лимфоциты Т-хелперы и стимулируя выработку супрессорных клеток для предотвращения отторжения плодного яйца.11.7. Прогестерон и потери беременности
Самые распространенные потери беременности, которые существуют в жизни людей, это биохимические беременности и спонтанные аборты (или выкидыши). Если учесть стадийность беременности, то почти 80 % оплодотворенных яйцеклеток гибнут до появления клинических признаков беременности: в результате дефектного деления, по пути в полость матки по маточным трубам первые пять дней, в течение последующих почти двух дней нахождения в полости матки и в первую неделю имплантации до появления задержки менструации и клинической беременности.11.7.1. Биохимическая беременность
Беременности, которые теряются в результате нарушения прикрепления в первые 7 дней имплантации, называются биохимическими беременностями. Обычно менструальное кровотечение опаздывает на 1–3 дня. Из всех потерь зачатых беременностей, биохимические беременности составляют 25 % (по другим данным, эти показатели выше). Биохимические беременности можно выявить, определяя повышение уровня ХГЧ, обычно с 7-го дня после овуляции, когда начинается имплантация. Многие женщины идут в лабораторию еще до задержки менструации или в первые дни задержки, чтобы знать, беременны они или нет. И каково же их разочарование, если при положительном уровне ХГЧ (и этот уровень обычно невысокий) вдруг появляется кровотечение, ничем не отличающееся от месячных. Что испытывают многие женщины в таких случаях? Настоящую панику, считая, что у них якобы «выкидыш». Печально, что многие врачи назначают таким женщинам супердозы прогестерона якобы для сохранения беременности или же проводят выскабливание полости матки.11.7.2. Спонтанный выкидыш
Спонтанными абортами, или выкидышами, называют потери клинических беременностей, то есть подтвержденных задержкой менструации, высоким уровнем ХГЧ и нередко УЗИ, до 20 недель беременности (в некоторых странах до 24 недель беременности). Если потеря беременности произошла на ранних сроках (до 12 недель), то обычно говорят о выкидыше. Но чем больше срок, тем больше путаницы в определении самопроизвольного аборта. Например, под мертворождением считают рождение ребенка после 20 недель и/или с весом в 500 г. Но, если происходит задержка развития плода и вес ребенка меньше или, наоборот, срок беременности определен неправильно, меньше 20 недель, и вес больше 500 г, опять же в истории болезни чаще звучит диагноз — самопроизвольный аборт. Такая неразбериха в постановке диагноза прервавшейся беременности зависит от определенной «политической игры» — лечебное учреждение всегда отчитывается перед вышестоящими инстанциями по мертворождению и практически никогда — по спонтанным выкидышам. Уровень мертворождаемости кардинально меняет статус не только учреждения, но и города, района, области и всей страны. Поэтому преждевременные роды даже на большем сроке (до 26 недель), особенно при рождении ребенка с задержкой роста и маленьким весом, часто обозначаются как самопроизвольные аборты. Точный срок беременности имеет для женщины очень важное прогностическое значение в отношении последующих беременностей, а также для постановки правильного диагноза потери беременности. Если потеря произошла в первом триместре, нередко врачи запугивают женщин тем, что проблема была в нехватке прогестерона и именно из-за этого беременность прервалась. Из всех тех беременностей, которые подтверждены клинически, 5–20 % заканчиваются самопроизвольным прерыванием до 20 недель. Здесь речь идет о тех беременностях, которые не будут прерваны искусственно по желанию женщин (в постсоветских странах до 80 % беременностей прерываются по желанию женщины как незапланированные беременности, и Россия является лидером по количеству абортов во всем мире). Около 40 % замерших беременностей на ранних сроках связаны с анэмбрионической беременностью, то есть беременностью без развивающегося эмбриона внутри плодного яйца — пустое яйцо. Существует также еще один феномен — чаще всего прерываются первые беременности (около половины). Потеря первой беременности для женщины обычно неожиданный, непредсказуемый случай. Но отношение к беременности у женщин бывших постсоветских стран и всех других стран мира совершенно разное. Наши женщины планируют беременность в постоянном страхе ее потери задолго до ее появления, и как только беременность появляется, страхи усиливаются еще больше. Наши женщины не думают о рождении ребенка — их сознание полностью забито мыслями о внематочной беременности, угрозе потери беременности, разных «гипертонусах», о «спасении» и «сохранении» беременности. Поэтому потеря беременности после «агрессивной борьбы с угрозой» (а фактически с самой беременностью) вызывает у женщин шок. Многие женщины после такой потери морально не готовы беременеть повторно и откладывают этот момент на годы. Дополняется негативное состояние обвинениями врачей, что «во всем виновата женщина», у которой они найдут массу причин потери. Нелепые мифы настолько доминируют среди постсоветских людей, что найти трезво мыслящего человека, особенно врача, а тем более прогрессивного, знающего «чем дышит» остальной мир, практически невозможно. Влагалищное кровотечение и боль внизу живота являются двумя признаками, которых очень боятся беременные женщины, особенно на ранних сроках беременности, потому что это могут быть симптомы самопроизвольного аборта (выкидыша) или внематочной беременности. Эти признаки наблюдаются у одной трети беременных женщин на ранних сроках. 10–20 % беременностей заканчиваются спонтанными выкидышами, 1–2 % — внематочными беременностями, однако у трети женщин, обратившихся к врачу с жалобами на боли и/или кровянистые выделения из влагалища, при первом осмотре обнаружить локализацию плодного яйца с помощью УЗИ не удается. Такой поход к врачу не только окажется холостым, но и внесет еще больше стресса в жизнь женщины.11.7.3. Почему бывают выкидыши?
Нормальное объяснение самопроизвольного выкидыша будет звучать так: более 90 % беременностей на ранних сроках теряются по закону природного отбора из-за дефекта плодного яйца, то есть дефекта зачатия; также половина первых беременностей теряется из-за погрешностей в становлении взаимосвязи между плодным яйцом и матерью, для которой оно является инородным телом. Построение этой взаимосвязи имеет определенные этапы и требует времени, поэтому первые беременности теряются чаще, чем последующие. Нормальные рекомендации будут звучать так: начать или продолжить прием фолиевой кислоты и с восстановлением физиологического менструального цикла (то есть без всяких контрацептивов) пробовать беременеть снова. Только в небольшом количестве случаев врач может рекомендовать обследование — подход всегда индивидуальный, и потребность в обследовании определяется жалобами женщины, ее историей и наличием клинических симптомов. Отношение врачей разных стран и постсоветских врачей к потере первой беременности тоже кардинально разное. После выскабливания полости матки (и нередко его повторяют, даже если плодное яйцо не обнаружено) женщине назначают длительный курс антибиотиков, кровеостанавливающих средств, гормональных контрацептивов. Грубым вмешательством является так называемый «лаваж матки», когда в полость матки вводится масса лекарственных веществ (одна такая варварская процедура может привести к пожизненному бесплодию). Женщину также посылают на обследование в поисках «скрытых инфекций», прогестероновой недостаточности, антифосфолипидного синдрома, эндометрита, эндометриоза и ряда других заболеваний. Список тестов доходит до абсурда. И начинается запугивание антиспермальными антителами, антипрогестероновыми антителами, низким антимюллеровым гормоном, наличием генов тромбофилии, какой-то там несовместимости с партнером, плохим уровнем гомоцистеина и т. д. После получения результатов длительное агрессивное лечение продолжается. Женщину обычно «садят» на контрацептивы, минимум на 3–6 месяцев, запрещая ей беременеть, пока «не выяснят причины потери беременности». После контрацептивов назначают прогестерон или прогестины (дюфастон, утрожестан), но чаще всего по той же контрацептивной схеме, о чем женщина даже не догадывается, но не беременеет месяцами и годами. Лапароскопия и гистероскопия — давно уже не диагностические методы на территории бывших республик СССР, а убедительное средство обогащения: почему-то проверяют проходимость труб и якобы рассекают спайки до любых попыток женщины планирования беременности — бессмысленная профилактика, вызывающая на самом деле спаечный процесс. Агрессивность врачебного вмешательства не вписывается ни в какие каноны современной медицины, и такое отношение начали активно обсуждать прогрессивные врачи всего мира. В итоге женщины не просто боятся беременеть. Даже если они забеременеют на фоне этого грубого контроля их жизни и желания быть матерью, очередная волна переживаний, вплоть до паники и истерии, заглушает любое чувство радости — и все идет по тому же сценарию. Уровни потерь беременностей постсоветских женщин намного выше потерь в развитых странах, и даже во многих развивающихся странах, хотя там факторы, вовлеченные в потерю беременности совершенно другие (плохое питание, антисанитария, отсутствие медицинской помощи и т. д.). Повторные спонтанные потери беременности для большинства женщин сопровождаются большим стрессом. Привыкнуть к потере беременности невозможно — это всегда негативные эмоции и чувства. Хотя есть немало женщин, которые теряют беременности часто, иногда до 7–8, но они отличаются силой духа и упорством, верой в себя как будущую мать. Эти женщины продолжают планировать беременности, несмотря на многочисленные потери, которые могут быть по разным причинам. Современное акушерство позволяет многим таким женщинам получить желаемое потомство, даже после многих неудачных попыток невынашивания. С наступлением беременности многих женщин и врачей интересует вопрос, как определить угрозу потери беременности, ее прогресс или регресс. Врачи постоянно ищут маркеры «нормальной» или «патологической» беременности. Перепробовано немало тестов, исследовано немало веществ, появляющихся при беременности, но положительный ответ так и не получен, потому что каждый метод обследования имеет свои ограничения, низкую чувствительность и низкое прогностическое значение.11.7.4. Разница между иммунологическим абортом и абортом из-за хромосомных аномалий
В разных публикациях, как научных, так и популярных, среди причин потерь беременностей (в том числе повторных) на ранних сроках наиболее часто звучат хромосомные аномалии (нарушение кариотипа) и иммунологические причины. В отношении хромосомных аномалий всё понятно — неполноценный набор хромосом по каким-то причинам. По разным данным около 80–90 % потерь на ранних сроках бывает как раз из-за нарушений кариотипа. И мы, врачи, привыкли к этим данным, хотя между причинами потери первой беременности и последующих беременностей все же существует разница. Известно, что почти половина первых беременностей прерывается. Виноваты ли в этом хромосомные аномалии? Является ли такое зачатие дефектным? Оказывается, при потере первых беременностей иммунологический фактор играет большую роль, чем все другие. Часто кариотипирование эмбриона и продуктов зачатия показывает нормальный набор хромосом. Причина иммунологического аборта кроется в агрессивном отношении защитных сил материнского организма по отношению к плодному яйцу. Проще говоря, материнский организм учится принимать эмбрион, который всегда является инородным телом для матери, и не всегда первый урок бывает успешным. Не всегда бывает успешным и второй урок (вторая попытка беременности). У ряда женщин теряется несколько беременностей на ранних сроках в виде иммунологического выкидыша. Механизм потери беременности из-за хромосомных аномалий и из-за иммунологического фактора разный. При наличии дефекта в хромосомах между сосудами плодного яйца и материнскими мост (взаимосвязь), как основа успешной имплантации, не возникает в силу того, что дефектное плодное яйцо не в состоянии создать здоровые сосуды. При иммунологическом аборте взаимосвязь (мостик) между материнскими и плодными сосудами возникает успешно. Однако дальше материнским организмом активируется иммунологическая реакция (похожая на реакцию, которая происходит при пересадке органов и их отторжении). При этом начинается местная воспалительная реакция эндометрия в месте прикрепления хориона в виде васкулита (воспаления сосудов), что сопровождается формированием микротромбов и закупоркой сосудов. В результате доставка необходимых питательных веществ к эмбриону прекращается, возникает реакция отторжения плодного яйца — аборт. В случае хромосомных аномалий прогестерон не участвует в механизме ни имплантации, ни удаления дефектных плодных яиц. Прогестерон может только играть определенную роль в механизме иммунологического аборта, но контролировать эту роль введением дополнительного экзогенного прогестерона и других лекарственных препаратов невозможно.11.7.5. Прогестерон и прогноз исхода беременности
Итак, чем пользуются врачи для определения прогноза в отношении прогресса беременности? Чаще всего такой вопрос актуален в репродуктивной медицине, после ЭКО и других вспомогательных репродуктивных технологий, так как они все очень дорогостоящие, и вопрос успешности врачебной помощи в получении потомства очень важен. Разработано большое количество протоколов контроля прогресса беременности, но ни один из них не обладает преимуществом, а также не является высокочувствительным методом, который можно повсеместно рекомендовать для применения на практике. Одним из первых тестов для определения исхода беременности было определение уровня прогестерона до беременности во второй фазе цикла и в 4–8 недель беременности. Однако оказалось, что такой тест является недостоверным. Почему? • Уровни прогестерона колеблются в течение всего менструального цикла • Уровень лютеинового прогестерона может быть низким в нормальных менструальных циклах и не влиять на зачатие и имплантацию • Менструальные циклы у здоровых женщин могут сопровождаться совершенно разными уровнями лютеинового прогестерона — от низкого до высокого • Желтое тело беременности и выработка прогестерона регулируется рядом факторов беременности и сигналами, поступающими из здорового плодного яйца. Это означает, что при патологическом зачатии и нарушении процесса имплантации дополнительное назначение прогестерона ситуацию в лучшую сторону не меняет. • Желтое тело беременности достигает максимальной активности к 4–5-й неделе, когда первый этап имплантации завершился, и после этого функция желтого тела в яичнике начинает угасать, а хорион и в дальнейшем плацента берут на себя функцию выработки прогестерона беременности. • Полный лютеоплацентарный сдвиг наблюдается в 7–8 недель. Уровень лютеинового прогестерона к этому времени падает, а уровень плацентарного прогестерона растет. • Регуляция выработки плацентарного прогестерона не зависит от организма женщины, а является прерогативой плаценты. Он также не зависит от плода, потому что это автономный процесс. • Дополнительное введение экзогенного прогестерона не влияет на уровень плацентарного прогестерона и не используется плацентой и плодом. Таким образом, определение уровня прогестерона до возникновения беременности и с возникновением беременности имеет низкое прогностическое значение. Если имплантация нарушена, естественно, желтое тело и плацента будут вырабатывать меньше прогестерона. Но нарушение имплантации не бывает без причины, и чаще всего эта причина кроется в плохом плодном яйце. Для многоплодных беременностей определение уровня прогестерона на ранних сроках беременности с целью прогнозирования исхода беременности тоже оказалось неэффективным, так как до 7–8 недель беременности в крови женщины доминирует лютеиновый прогестерон, поэтому количество хорионов и плодов не играет роли в выработке прогестерона желтым телом. До 10 недель беременности разницы в выработке лютеинового и плацентарного прогестерона для беременности одним плодом или при многоплодной беременности не наблюдается. После 10 недель уровни прогестерона могут быть разными у разных женщин, поэтому его определение теряет практическую ценность, тем более, что большинство спонтанных потерь беременности, в том числе и многоплодной, наблюдается до 8 недель беременности.11.7.6. Прогестерон и прогноз беременности при наличии кровянистых выделений
Если определение уровня прогестерона не позволяет прогнозировать беременность при отсутствии кровянистых выделений и/или боли, может ли определение его уровня быть практически полезным для женщин, жалующихся на кровотечение, что часто называют угрожающим абортом? Можно ли с помощью уровня прогестерона в таких случаях определить внематочную беременность? Анализ многочисленных клинических исследований показывает, что за нормальные показатели прогестерона до 14 недель беременности большинством врачей приняты уровни от 3.2 до 11 нг/мл (10–35 нмоль/л), но часто минимальным нормальным показателем считают уровень 5 нг/мл (16 нмоль/л). Оказалось, что, если показатели прогестерона у женщин с кровянистыми выделениями, болезненными ощущениями и неточным УЗИ (когда локализацию плодного яйца или наличие живого эмбриона определить невозможно) меньше 3.2 нг/мл, вероятность наличия замершей беременности составляла 99 %, а больше 6 нг/мл — 44 %. В целом, при показателях прогестерона меньше 6 нг/мл, вероятность наличия замершей беременности составляет около 74–75 %. Однако в отношении диагностики внематочной беременности определение показателей уровня прогестерона оказалось безуспешным. У беременных женщин, которые жаловались на кровянистые выделения или на боль, а УЗИ показало наличие внутриматочной беременности, за средний минимальный нормальный показатель уровня прогестерона был принят уровень в 10 нг/мл. Оказалось, что почти у 97 % женщин с прогестероном ниже 10 нг/мл была обнаружена замершая беременность, и у 37 % — больше 10 нг/мл. Каждый тест имеет чувствительность и специфичность, и обычно при высокой чувствительности страдает специфичность, и наоборот. Поэтому, чем выше уровень прогестерона, тем труднее предсказать, развивается беременность или замерла. И чем меньше уровень прогестерона, тем труднее его определить точно, но также тем большая вероятность отсутствия беременности, в том числе из-за гибели плодного яйца. И хотя были построены многочисленные графики, отображающие зависимость живой или мертвой беременности от уровня прогестерона, они не нашли практического применения из-за слишком больших различий в чувствительности и специфичности, а также погрешностей в измерении уровней прогестерона (общий, свободный, связанный, в плазме, в сыворотке). Таким образом, анализ проведенных клинических исследований показал, что одноразовое определение уровня прогестерона может иметь практическое значение только в диагностике замершей беременности при кровянистых выделениях и боли внизу живота и «непонятных» результатах УЗИ. Однако это определение оказалось совершенно неэффективным (недостоверным) в диагнозе внематочной беременности, нормальной беременности и спонтанного выкидыша. У женщин с жалобами (кровянистые выделения и боль), но без УЗИ, определение уровня прогестерона для подтверждения живой нормальной или замершей беременности не является надежным методом диагностики, поэтому не рекомендуется большинством врачей.11.7.7. Определение уровней ХГЧ и прогестерона для прогноза беременности
Очень многие врачи приняли за стандарт удвоение уровня ХГЧ каждые два дня как индикатор развивающейся беременности. Оказалось, что удвоение может быть и медленнее, а рост ХГЧ в 1.4 раза каждый второй день тоже является нормальным показателем. К тому же, такая прогрессия в росте гормона наблюдается только в первые недели (4–5) беременности. У 85 % беременных женщин удвоение уровня ХГЧ происходит каждые 48–72 часа. Достигнув максимальных уровней в 9–10 недель, выработка ХГЧ снижается и после 16 недель остается на уровне показателей 6–7 недель беременности. Во второй половине беременности уровень этого гормона составляет всего 10 % от максимальных показателей в 10 недель. Ошибочно врачи определяют уровень ХГЧ для определения срока беременности. Но уровни гормона у разных женщин колеблются в таком большом диапазоне, что определить истинный срок беременности по ХГЧ невозможно: от 23 до 4653 мМЕ/мл в 4 недели и от 114 до 45 800 мМЕ/мл в 5 недель. У одной и той же женщины уровень ХГЧ при каждой новой беременности может иметь совершено разные показатели. К тому же, ряд состояний беременности и многоплодная беременность могут сопровождаться повышенными уровнями ХГЧ. С практической точки зрения точный срок беременности должен быть известен до определения уровня ХГЧ. Исследования показали, что у половины женщин с «непонятными» результатами УЗИ, которое проводилось на ранних сроках беременности, уровень ХГЧ спонтанно понизился до уровней, предшествующих беременности, в 27 % случаев был обнаружен живой плод в полости матки и у 14 % — внематочная беременность. Преимущественное большинство внематочных беременностей завершилось трубным абортом, который не привел к повреждению маточной трубы. Определение уровня β-ХГЧ может быть полезным диагностическим методом в отношении спонтанных выкидышей и внематочной беременности, но недостаточным для прогнозирования исхода беременности при наличии живого плода в полости матки. Поэтому врачи до сих пор ищут другие «показатели» прогресса ранней беременности, другие маркеры, то есть вещества, которые можно было бы определить в крови или выделениях беременной женщины. Хотя уровни ХГЧ и прогестерона взаимосвязаны, их определение для прогноза беременности тоже оказалось малоинформативным. Несмотря на неточность в прогнозе исхода беременности, определение уровней прогестерона или ХГЧ, или обоих гормонов до сих пор применяется на практике, так как других надежных прогностических методов не существует.11.7.8. Можно ли сохранить беременность, если она прерывается?
Ошибочно вот уже более четырех десятков лет в постсоветском акушерстве доминирует миф о сохраняющей терапии на ранних сроках беременности. Поначалу в эту «сохраняющую терапию» входили прогестерон (нередко его синтетические формы, например, туринал), папаверин, дибазол, витамин Е, викасол, чуть позже врачи ввели но-шпу, вибуркол. Современные постсоветские врачи начали вводить стероидные препараты (дексаметазон и ему подобные), что стало чуть ли не обязательным назначением для всех женщин, аспирин, магне В6, метазин, метформин и нередко капельницы раствора сульфата магния. Вместо туринала используют другой синтетический прогестерон (прогестин) — дюфастон. В последнее время врачи начали добавлять множество кровеостанавливающих препаратов и тех, которые повышают или понижают свертываемость крови. Хуже всего, что назначают эти две группы препаратов с противоположным действием нередко одновременно. Беременная женщина принимает до 10–12 различных медикаментозных препаратов на ранних сроках беременности, когда идет закладка органов и систем органовразвивающегося эмбриона. В течение всей беременности постсоветская женщина принимает до 20 наименований лекарственных средств, а в некоторых случаях и больше! В 1953 году были опубликованы первые данные по применению прогестерона для профилактики и лечения повторных спонтанных абортов (привычного выкидыша). Разницы в количестве абортов и живых новорожденных не отмечалась, то есть прогестерон не сохранял беременности и исход беременности не улучшал. Исследование 1987 года показало, что назначение прогестерона для лечения влагалищных кровянистых выделений на ранних сроках беременности не дает положительного эффекта и исход беременности не улучшает. Более поздние исследования тоже не подтвердили «сохраняющий» эффект прогестерона. Акушерство во всех без исключения странах мира, за исключением постсоветских стран, утверждает: сохраняющей терапии на ранних сроках беременности НЕ существует. Все выше перечисленные лекарственные препараты не рекомендуются современными прогрессивными врачами, потому что они не только неэффективны, но могут навредить женщине и эмбриону. Глюкокортикоиды, аспирин, прогестерон используются в лечении и профилактике некоторых состояний, но до их назначения необходимо поставить правильный диагноз.11.7.9. Восстановление гормонального фона после потери беременности на ранних сроках
Потеря беременности на ранних сроках может сказаться на гормональном фоне женщине, но в большинстве случаев гормональные уровни восстанавливаются очень быстро. В более ранних публикациях утверждалось, что уровень эстрогена растет медленнее, это может проявляться запоздалой овуляцией, а поэтому затяжным первым циклом после аборта. Другие публикации утверждали, что, наоборот, уровень прогестерона понижается из-за низкого роста ЛГ перед овуляцией, поэтому первые менструальные циклы после прерывания беременности на ранних сроках короче из-за короткой лютеиновой фазы. Проблема всех этих публикаций заключалась в том, что их данные не учитывали виды прерываний беременности — спонтанный выкидыш, замирание беременности или искусственное прерывание (аборт). Последние исследования показали, что независимо от того, каким путем произошла потеря беременности на ранних сроках, действительно наблюдалось незначительное укорочение второй фазы в последующем менструальном цикле. Тем не менее, женщина может забеременеть в первом же цикле после аборта или выкидыша. Врачи старой школы обычно запугивают женщин, что слишком ранняя беременность после аборта/выкидыша опасна повторным прерыванием и невынашиванием, что организм женщины не готов к беременности, поэтому необходимо прервать ее, однако все эти утверждения оказались ложными. Если у женщины произошла овуляция, а после нее зачатие и имплантация, это говорит о полной готовности женского организма к следующей беременности. Абсурдными звучат объяснения врачей о так называемой «памяти матки» в отношении потери беременности. Не существует никакой памяти матки. Современные рекомендации в гинекологии и акушерстве не поощряют контрацептивные схемы после аборта или выкидыша, если сама женщина не заинтересована в предохранении от беременности. После спонтанной потери одной беременности женщина с вероятностью 80 % может иметь успешную последующую беременность. После потери двух беременностей на ранних сроках шанс успешной следующей беременности составляет 70 %, после 3 потерь подряд — около 60 %. Каждые беременности, завершившиеся родами, после потери предыдущей беременности снова повышают шанс успешного вынашивания беременности на 10–20 %. Тема угрозы прерывания беременности на ранних сроках и использование прогестерона в таких случаях обсуждается в главах, посвященных прогестероновой недостаточности. Хотя прогестерон может задерживать срок выкидыша (срок эвакуации плодного яйца), однако его назначение не улучшает исход беременности рождением живого ребенка.11.7.10. Прогестерон и повторные спонтанные выкидыши
Под повторными спонтанными выкидышами в современной медицине понимают потерю 3 или больше беременностей сроком до 20 недель. Повторные потери беременности встречаются в 0.5–2 % случаев, однако в 50 % случаев причину потерь выяснить не удается, и такие потери называются идиопатическими повторными выкидышами. В эту группу входят также повторные потери беременности из-за хромосомных аномалий. При идиопатических повторных выкидышах обнаружено, что в 70 % случаев первой потери беременности имеются хромосомные аномалии, а в целом все потери сопровождаются изменениями в кариотипе в 50 % случаев. Почему возникают такие хромосомные аномалии при совершенно нормальных кариотипах родителей, неизвестно, поэтому такие повторные потери беременности отнесли к группе идиопатических. Обследование женщин в большинстве случаев проводят только после трех потерь беременности, потому что чаще всего между двумя потерями беременности на ранних сроках причинной связи не существует. Почему обследование женщин не проводят после двух потерь беременности на ранних сроках? Считается, что существует феномен de novo возникшей хромосомной аномалии, то есть случайных повторных дефектов зачатия хромосомной природы, когда материнский фактор со стороны эндометрия или желтого тела отсутствует. Так как повторные спонтанные выкидыши являются комплексными по количеству всевозможных причин, обследование обычно чрезвычайно объемно и изнурительно для женщины как морально, так и финансово. Специальных алгоритмов обследования таких женщин, хотя бы с целью уменьшения стресса от проведения большого количества анализов и инвазивных процедур, не существует. Но всегда важно учитывать историю беременностей и их потерь, наличие других заболеваний, семейную историю, результаты осмотра. Исследования включают спермограмму, кариотипирование мужчины и женщины, гистероскопию, диагностику хламидийной инфекции и ряда других, изучение гормонального статуса. Необходимо исключить или подтвердить анатомические дефекты матки и шейки матки, особенно наличие перегородки в полости матки, антифосфолипидный синдром, разные виды врожденной тромбофилии, хромосомные аномалии, нарушение работы щитовидной железы и других эндокринных органов, целый ряд аутоиммунных заболеваний, синдром поликистозных яичников, а также вредные привычки (курение, алкоголь, наркотики), интенсивные занятия спортом. Наличие стрессов в жизни женщины, в том числе вызванных разными видами злоупотреблений и насилия со стороны полового партнера и других людей, расстройства психики — все это тоже может быть причиной повторных спонтанных выкидышей, поэтому требует анализа.11.7.11. Применение прогестерона для лечения повторных спонтанных выкидышей
Еще в недавние прошлые женщины с повторными спонтанными выкидышами назначали препараты прогестерона, потому что существовало ошибочное мнение, что у всех этих женщин имеется лютеиновая недостаточность. В некоторых публикациях упоминается, что недостаточность желтого тела находили у 35 % женщин с повторными спонтанными выкидышами. Однако вплоть до недавнего времени врачи не знали, что желтое тело беременности функционирует активно только до 4–5 недель беременности, когда наблюдается пик выработки прогестерона, а к 7–8 неделям его функция угасает. Если плодное яйцо дефектное или имплантация не прошла удачно, уровень прогестерона закономерно понизится. Поэтому большинство современных врачей считает, что понижение уровня прогестерона в случаях спонтанных выкидышей является результатом завершения беременности, а не причиной потери беременности. Из всех исследований, которые проводились на тему «сохраняющей» или «поддерживающей» терапии прогестероном при повторных спонтанных выкидышах (с 1953 года по 2009), в большинстве из них принимало участие слишком маленькое количество женщин (6–111, в среднем 25–28), что автоматически не позволяет получить статистически значимых данных. Возраст всех участниц исследований был настолько пестрым, даже в одном и том же исследовании, что невозможно сравнивать уровни спонтанных выкидышей у женщин 20–25 лет и старше 35 лет. Так как многие исследования проводились не по правилам доказательной медицины, после анализа опубликованных данных выяснилось, что во многих случаях диагноз повторных спонтанных выкидышей вообще не был подтвержден или был установлен неправильно. Такие разногласия в диагностике связаны с тем, что врачи пользовались, и до сих пор пользуются, разными определениями повторных спонтанных выкидышей. В некоторых исследованиях потеря беременности у женщин происходила после 20 недель, когда такие потери классифицируются как мертворождение или неонатальная смерть. Особенность повторных спонтанных выкидышей в том, что у одной женщины они обычно происходят по одному и тому же паттерну. Если выкидыши происходят в разные сроки, при разных обстоятельствах, то обычно это не повторные спонтанные выкидыши, а спонтанные случайные потери беременности, причина которых может быть совершенно разной. В большинстве исследований такая особенность не учитывалась. Чаще всего кариотипирование абортированного материала после потери первой беременности не проводится, да и после второй потери тоже, особенно если между сроками потерь существует разница. Но если женщина постоянно теряет беременности на одном и том же сроке, что как раз и наблюдается при повторных спонтанных выкидышах, кариотип эмбрионов или продуктов концепции часто бывает одинаковым. Проблема практически всех исследований также была и в том, что такие причины как хромосомные аномалии и нарушения закладки эмбриона, в том числе пороки развития, не определялись. Поэтому истинную причину потерь беременности никто не знал. Многие исследования проводились без всякой стандартизации в лечебных протоколах, начиная от дозы препаратов и заканчивая продолжительностью лечения. Другими словами, большинство исследователей импровизировали схемы лечения и могли менять их даже в ходе исследования. Такая терапия обычно назначалась только тогда, когда беременность уже была подтверждена с помощью УЗИ или тестами на беременность (по моче). Это срок, когда самые важные первые две недели имплантации завершены, поэтому поддержка прогестероном уже не так важна. В отношении применяемых препаратов тоже были различия. Одни исследователи использовали медроксипрогестерон, другие — 17-ОН прогестерон. И что самое главное, далеко не все имели контрольную плацебо-группу. Из-за вышеперечисленных погрешностей данные всех без исключения исследований оказались недостоверными. На чем же основываются доводы сторонников прогестерона, которые назначают этот гормон с целью лечения повторных спонтанных выкидышей? Я упоминала в начале книги о роли прогестерона в имплантации, в частности о прогестерон-индуцированном блокирующем факторе (PIBF), который модулирует действие прогестерона. У женщин с повторными спонтанными выкидышами и преждевременными родами уровень этого фактора низкий. Также у таких женщин низкие уровни ассиметричных антител (3 % по сравнению с 30 % при здоровой беременности). Одно из исследований, проведенное в 2005 году, показало, что дополнительный прием прогестерона незначительно повышает уровень зачатия и вынашивания беременности при повторных спонтанных выкидышах. В более поздних работах отмечалось, что моральная поддержка женщин, страдающих повторными спонтанными выкидышами, играет куда большую роль, чем назначение лекарственной терапии, особенно если причина таких выкидышей неизвестна и препараты назначают вслепую, руководствуясь чисто теоретическими предположениями. Известно, что стресс может нарушать Th1/Th2 сдвиг и приводить к потере беременности. Устранение стресса и моральная поддержка уже сами по себе улучшают исход беременности. Подытоживая сказанное, важно принять во внимание факт, что среди 50 % повторных выкидышей, причина которых определена, назначение прогестерона в преимущественном большинстве случаев не рационально, потому что недостаточность желтого тела — очень редкий диагноз в таких случаях (о прогестероновой недостаточности читайте дальше). Так как причин повторных спонтанных выкидышей может быть много, лечение будет зависеть от результатов обследования и диагноза.11.7.12. Назначение прогестерона при идиопатических повторных выкидышах
Если прогестерон практически неэффективен при лечении повторных выкидышей, причина которых известна, может ли он помочь тогда, когда причина потерь беременности неизвестна? Проблема заключается в том, что назначение прогестерона в таких случаях проводится из чисто теоретических предположений, поэтому не поддерживается большинством врачей. Повторные выкидыши по неизвестной причине сопровождаются большим психологическим и эмоциональным стрессом из-за неопределенности в отношении будущего семейной пары и вынашивания беременностей. Поэтому психологическое консультирование и моральная поддержка становятся первоочередными до назначения любого лечения. Хотя в медицинской литературе имеется несколько публикаций о том, что назначение прогестерона при идиопатических повторных выкидышах значительно улучшает исход беременностей, детальный анализ этих работ опроверг их достоверность. Последние данные науки говорят о том, что прогестероновая терапия, независимо от формы и путей введения прогестерона, является совершенно неэффективной в лечении повторных выкидышей по неизвестным причинам. Эффект плацебо! Может ли прогестерон помочь в лечении идиопатических повторных выкидышей, возникающих по типу иммунологического аборта? Иммунологические аборты, в том числе повторные, в отличие от хромосомных, возникают на более поздних сроках первого триместра, потому что сосудистая связь между плодным яйцом и маткой уже сформирована, а на процесс отторжения по типу иммунологического воспаления требуется все же определенное время. Такие повторные потери часто называют аутоиммунной фетоматеринской несовместимостью. Диагностика таких видов абортов чрезвычайно сложная, потому что, когда происходит отторжение и появляется кровотечение или же беременность замирает, гистологическое исследование абортированного материала покажет только завершившийся этап отторжения — обычно воспалительную реакцию эндометрия, которая характерна для любого вида аборта. Другими словами, разница между механизмами хромосомных абортов, иммунологических абортов или других видов абортов (по другим причинам) может быть заметна только на начальных этапах потери беременности (что можно назвать условно угрозой потери беременности). Но с прогрессом гибели эмбриона или его отторжения такие различия становятся незаметными, и матка готовится к изгнанию плодного яйца. Теоретически при аутоиммунной фетоматеринской несовместимости дополнительный прием прогестерона, который является иммуномодулятором в ходе имплантации, мог бы предотвратить потерю беременности. Но в данном направлении исследования не проводились.11.8. Прогестероновая недостаточность
Миф о прогестероновой недостаточности возник на основании мифа о сохраняющей терапии прогестероном. В странах Европы и США свойства прогестерона были изучены объемно, как и его неэффективность в сохранении беременностей. Также была изучена связь прогестерона с возникновением пороков развития, которая вызывает немало противоречий среди врачей до сих пор. С электронизацией многих источников информации, в том числе многочисленных изданий и библиотек, врачам и ученым стали доступны многие публикации прошлых лет, так же, как и результаты разных исследований. Но складывается впечатление, что не важно, что думают врачи мира о прогестероне, что показывают опубликованные результаты многочисленных исследований, проведенных по требованиям доказательной медицины, — у постсоветских врачей свое собственное мнение о всемогуществе прогестерона. Итак, что такое прогестероновая недостаточность? По определению, это состояние нехватки прогестерона. Но когда именно, в какой день цикла? Все врачи знают, что в первую фазу цикла уровень прогестерона низкий, и в этой фазе прогестерон не принимает участия в имплантации плодного яйца. Получается, что нормальный уровень прогестерона важен во второй фазе, то есть в лютеиновой фазе, поэтому прогестероновую недостаточность часто называют лютеиновой недостаточностью. Значит, мы говорим о двух фазах цикла. Напомню читателям, что две фазы определяются наличием овуляции. Где вырабатывается прогестерон во вторую фазу? Основной ресурс прогестерона во вторую фазу — это желтое тело яичника. Таким образом, прогестероновая недостаточность чаще всего связана с нарушением функции желтого тела, а поэтому называется нередко недостаточностью желтого тела. До этого момента все объяснения рациональны и правильны, не так ли? Поэтому с таким определением недостаточности лютеиновой фазы согласятся практически все здравомыслящие люди, в том числе и врачи. Но что получается в реальной жизни? Приходит женщина к врачу с жалобами, что у нее циклы по 35–40 дней, а то и больше, что задержки могут быть и по 1–2 месяца, что она пытается забеременеть, но с такими циклами у нее ничего не получается. Женщина удивлена тем, что на фоне приема гормональных контрацептивов у нее было все идеально — менструации шли ровно через 28 дней, а когда она не принимает контрацептивы, то у нее сразу же все нарушается. Обычно врачей не интересует вопрос наличия в жизни этой женщины стресса, диет (а поэтому резких колебаний веса), никто не взвешивает женщину и не измеряет ее рост (а зачастую это высокие худые женщины), никто не проверяет функцию щитовидной железы. Многие даже не обращают внимания на то, что это может быть юная женщина, 19–21 года. Такую женщину сразу пошлют на объемное лабораторное обследование, результаты которого чаще всего будут в норме, кроме уровня прогестерона, который определяли строго на 21-й день цикла. А если у женщины нет менструации длительный период времени? Ей определят уровень прогестерона по традиции вместе с другими гормонами, и, конечно же, он будет низким. На УЗИ обнаружат отсутствие доминантного фолликула, а значит, сделают выводы, что у женщины ановуляторные циклы. А почему ановуляторные? Да якобы все из-за нехватки этого самого прогестерона. Вот не хватает его, поэтому женщина и не беременеет. А дальше традиционная схема лечения: прогестерон (дюфастон, утрожестан), если не с 5-го дня, то с 14–16-го дня цикла. На прогестероне цикл становится 28–30 дней у большинства женщин, только беременность все равно не наступает. Мало кому из женщин приходит мысль о том, что их «посадили» на контрацептивную схему. Но об ошибках постановки диагноза прогестероновой недостаточности мы продолжим разговор чуть позже. Итак, важно понять такую истину: о недостаточности лютеиновой фазы можно говорить только тогда, когда эта вторая фаза имеется. Это означает, что цикл должен быть овуляторным — один из важных диагностических критериев постановки диагноза лютеиновой недостаточности. Недостаточность прогестероновой фазы — чрезвычайно редкий диагноз, и не признается многими прогрессивными врачами. Такое отношение врачей объясняется тем, что если первая фаза проходит естественным путем и заканчивается овуляцией, то маловероятно, что вторая фаза будет протекать с нарушениями. Ведь вторая фаза значительно зависит от качества первой фазы. О недостаточности лютеиновой фазы, или желтого тела, чаще всего говорят в контексте яичниковой недостаточности, первичной или вторичной, когда менструальные циклы и созревание половых клеток нарушено. В изолированном варианте, когда происходит нарушение лютеинизации фолликула и желтое тело становится неполноценным, прогестероновая недостаточность встречается крайне редко. Также совершенно неправильно оценивается функция желтого тела беременности. Особенность функционирования желтого тела беременности состоит в том, что при нормальной имплантации, которая возможна при наличии здорового плодного яйца, сигналы из эмбриона и ХГЧ (традиционный взгляд) стимулируют выработку прогестерона желтым телом. Если плодное яйцо дефектное, имплантация нарушается, автоматически заглушается работа желтого тела. Частота лютеиновой недостаточности среди женщин репродуктивного возраста неизвестна, а имеющиеся данные неточны и противоречивы. Это связано с тем, что достоверных методов диагностики для постановки такого диагноза не существует — врачи могут пользоваться разными методами диагностики, которые все без исключения, как показали клинические исследования, оказались неточными, недостоверными из-за больших вариаций норм и отклонений (читайте об этом дальше). Но в целом, согласно обобщенным данным после анализа многочисленных публикаций, недостаточность лютеиновой фазы наблюдается у 1–3 % овулирующих женщин, а также у 3–4 % женщин, страдающих бесплодием.11.8.1. Причины прогестероновой недостаточности
Если произошла овуляция, то есть созревание яйцеклетки, то это чаще всего говорит в пользу нормальной первой фазы (иначе овуляция не произошла бы). Нарушения овуляции встречаются чаще, чем нарушения формирования желтого тела, поскольку желтое тело — это все тот же созревший фолликул, проходящий через новые стадии развития (качественного изменения). Предполагается, что причина нарушения формирования желтого тела и его недостаточности кроется в нарушении здоровой пропорции между фолликулостимулирующим гормоном (ФСГ) и лютеотропным гормоном (ЛГ), которые участвуют в регуляции работы желтого тела. Эта диспропорция может быть вызвана не только нарушением выработки ФСГ или ЛГ, но и негативным влиянием других гормонов — пролактина, гормонов щитовидной железы, реже других. Резкое повышение ЛГ перед овуляцией является важным сигналом будущей трансформации фолликула в желтое тело. Недостаточность лютеиновой фазы может наблюдаться у женщин совершенно здоровых, но ведущих такой образ жизни, который кардинально влияет на их репродуктивную функцию. Так, например, у женщин, занимающихся бегом и пробегающих 35–50 км за неделю, наблюдается недостаточность лютеиновой фазы, которая будет проявляться нормальным уровнем прогестерона и даже нормальной продолжительностью второй фазы в большинстве случаев. Исследования показали, что у женщин, занимающихся интенсивными видами спорта, возникает два вида лютеиновой недостаточности, один из которых связан с нарушением усвоения прогестерона, а другой с нарушением взаимосвязи между ЛГ и выработкой прогестерона. У кормящих женщин часто наблюдается недостаточность лютеиновой фазы, проявляющаяся короткими менструальными циклами, что частично связано с действием пролактина, а также нарушением ЛГ-прогестероновой взаимосвязи. Состояние, когда имеется повышенный уровень эстрогенов, а поэтому пониженный уровень прогестерона, является чрезвычайно редким явлением среди женщин репродуктивного возраста. Но существует еще одна причина возникновения лютеиновой недостаточности, которая не имеет отношения к функции желтого тела (и она может быть нормальной) — это поломка на уровне эндометрия: нехватка эстрогенных и прогестероновых рецепторов, или диспропорция в их количестве, или же дефект рецепторов, что может иметь разную, но нередко врожденную природу возникновения (поломка на уровне генов). Такой механизм возникновения прогестероновой недостаточности часто наблюдается при повторных спонтанных выкидышах, которые возникают из-за неадекватной подготовки эндометрия к принятию плодного яйца. Еще один механизм развития лютеиновой недостаточности объясняется повышенным уровнем окислительных процессов в тканях матки, то есть состоянием внутриклеточного стресса (оксидативного стресса). Известно, что при повышенном уровне окисления вырабатывается большое количество свободных радикалов — частиц веществ, в основном в состоянии ионов, которые являются агрессивно активными из-за нехватки электронов. Поэтому такие ионы могут атаковать другие молекулы, забирая у них электрон (ы) и фактически переводя эти молекулы в состояние свободного радикала. Так возникает определенная цепная реакция, которая, с одной стороны, может иметь положительный эффект на ткани (и она часто наблюдается при восстановлении и заживлении тканей), а, с другой стороны, может наблюдаться отрицательный эффект — еще большая поломка клеток и тканей, что часто происходит при воспалительных процессах. Недостаточность лютеиновой фазы при наличии гормональных нарушений со стороны щитовидной железы тоже возникает у ряда женщин, и такой вид нарушения функции желтого тела не может быть компенсирован только прогестероном.11.8.2. Симптомы прогестероновой недостаточности
Проблемы с зачатием ребенка или невынашиванием беременности в ранние сроки (с 7–8 недель беременность не нуждается в желтом теле) являются только косвенными признаками прогестероновой недостаточности. У женщин с первичной лютеиновой недостаточностью, которая связана с работой желтого тела, всегда есть овуляция, то есть созревание половой клетки. При ановуляторных циклах уровень прогестерона всегда одинаков, хотя и низкий для второй фазы, но так как при ановуляторных циклах нет фаз, диагноз прогестероновой недостаточности в таких случаях не ставится. Если учесть, что понижение прогестерона во второй фазе нормального цикла, после его пика на 7-й день после овуляции, приводит к появлению менструации, то нехватка прогестерона, то есть его низкий уровень, приведет к тому, что кровянистые выделения появятся раньше 28-и дней. При нарушении функции желтого тела менструальные циклы всегда короткие, а вторая фаза обычно не превышает 9–12 дней. Хотя для многих женщин менструальные циклы в 21 день могут быть их физиологической нормой и не отражаться на плодовитости (способности зачинать и вынашивать детей), у женщин, страдающих бесплодием или повторными спонтанными выкидышами, короткий менструальный цикл должен всегда настораживать в отношении прогестероновой недостаточности. Других видимых признаков прогестероновой недостаточности не существует. Поэтому часто диагноз такого состояния требует проведения лабораторного и другого диагностического обследования.11.8.3. Критерии определения лютеиновой недостаточности
Несмотря на ряд противоречий в постановке диагноза прогестероновой недостаточности, все же существуют следующие диагностические критерии, которых придерживается большинство врачей мира: 1. Наличие овуляции и двух фаз цикла. 2. Короткая вторая фаза цикла (меньше 12 дней). 3. Низкий уровень прогестерона на 6–8-й день после овуляции. 4. Отсутствие пульсирующей выработки прогестерона. 5. Отсутствие нормальной реакции эндометрия на смену гормонального уровня и фазности цикла. Как правильно проводить диагностику лютеиновой недостаточности? Когда ее проводить лучше всего для получения достоверных результатов? Какому методу диагностики отдать предпочтение? Эти и другие вопросы до сих пор не имеют четких ответов, потому что причин прогестероновой недостаточности может быть много — от поломки на уровне его выработки до момента его усвоения тканями и выведением из организма. Это длинный период биохимических реакций, в которые вовлечены сотни других веществ и структурных единиц, в том числе гены. Даже если в цепочке «выработка-усвоение-переработка-выведение» нет поломки, на этот процесс могут влиять другие факторы, как внутренние, так и наружные. И важно не просто «придраться» к показателю уровня прогестерона в крови (который определен чаще всего неправильно), а проанализировать каждый конкретный случай без предвзятости и преждевременных выводов. Измерение базальной температуры тела для постановки диагноза лютеиновой недостаточности считается устаревшим, неточным и недостоверным методом, поэтому в современном акушерстве и гинекологии не используется. Наличие спонтанных выкидышей в прошлом не является критерием для постановки этого диагноза, но учитывается как важный дополнительный фактор.11.8.4. Определение уровня прогестерона
Какие минимальные уровни прогестерона приняты за норму? В каждой лаборатории имеются свои референтные значения. Конечно же, самые низкие показатели прогестерона в первую фазу цикла, что является естественным, поэтому измерение уровня прогестерона до овуляции практического значения не имеет и проводится редко по некоторым показаниям. Определение уровня прогестерона во вторую фазу имеет практическое значение, но важно помнить, что уровень этого гормона колеблется после овуляции от низкого до пика, и снова до низкого перед менструацией. Поймать пик прогестерона одним измерением не просто, и даже невозможно. Это как из фильма выбрать один кадр и пытаться судить, о чем этот фильм, как он начинается и чем заканчивается. За минимальный уровень прогестерона в середине лютеиновый фазы принят уровень в 2.5–5 нг/мл, но не все врачи соглашаются с такими показателями. Многие считают, что необходимо определять уровень прогестерона вместе с уровнем ЛГ, чтобы обнаружить резкое повышение ЛГ перед овуляцией, и потом его второй подъем в середине второй фазы. В норме лютеиновая фаза может длиться от 11 до 16 дней, поэтому середина лютеиновой фазы и пики гормонов не всегда могут совпадать. Другие врачи предлагают измерять уровень прогестерона в середине второй фазы минимум три раза через день и потом вычислять средний показатель. За норму принято 15 нг/мл. Некоторые специалисты предлагают проводить такие серийные определения уровня прогестерона в слюне, так как это более дешевый способ и не требует забора крови. Однако, как показали исследования, это самый ненадежный метод определения уровня прогестерона в организме женщины.11.8.5. Особенности колебаний уровней прогестерона в течение суток и разного периода времени
Очень многие врачи при определении лютеиновой недостаточности забывают, что прогестерон вырабатывается не в постоянном режиме, а в пульсирующем (как отражение выработки ЛГ). Это значит, что разница между низким и высоким уровнями постоянно колеблется в течение всего цикла и особенно в лютеиновую фазу. Выработка лютеотропного гормона, регулирующего выработку прогестерона, зависит от гипоталамо-гипофизарной активности, и в течение дня, как и всего менструального цикла, пульсация ЛГ может быть в разных режимах: • пульсация с высокой амплитудой (выброс большого количества ЛГ без четких временных промежутков), • апульсация (выработка ЛГ незначительная), • пульсация в состоянии сна (почти хаотичная по частоте и амплитуде выработка ЛГ) • регулярная 90-минутная равномерная пульсация. На рисунке представлены графики колебания уровней ЛГ в течение суток в разные дни менструального цикла, при разной активности женщины.
Все эти режимы являются нормальными и могут чередоваться у здоровой женщины. Но от режима пульсации ЛГ будет также зависеть и режим выработки прогестерона. 90-минутная равномерная пульсация, или классическая, о которой написано в учебниках, не является постоянным видом выброса ЛГ, но чаще наблюдается во время максимальной выработки прогестерона. Кроме того, существует зависимость пульсирующего выброса ЛГ от возраста, стрессового состояния, переутомления, больших физических нагрузок, наличия ряда эндокринных заболеваний. Паттерн такой пульсации весьма разнообразен, как и смена режимов пульсации, которая может быть частой и непредсказуемой под влиянием внешних и внутренних факторов. Поэтому единичное определение уровня прогестерона в крови женщины практически никогда не будет отражать истинное состояние дел и может привести к ложным диагнозам. Такие колебания выработки прогестерона привели к понятию «интегрального прогестерона», когда измерения уровня прогестерона проводят каждый день во второй половине менструального цикла в одно и то же время, потому что такие измерения позволяют построить кривую уровней прогестерона. К тому же, такой метод позволяет вычислить общее количество выработанного прогестерона и, следовательно, оценить количество гормона, которое вызывает изменения в эндометрии женщины. Но применение этого метода диагностики ограничено, потому что не каждая женщина сможет, да и захочет, приходить в лабораторию в одно и то же время для сдачи венозной крови на прогестерон в течение 10–14 или чуть меньше дней после овуляции.
11.8.6. Особенности колебания уровней прогестерона в течение менструального цикла
Как ставят диагноз лютеиновой недостаточности большинство врачей? Обычно к врачам обращаются женщины с нерегулярными длинными циклами (потому что многие худые и высокие, сидящие на диетах, нервничают и переживают по любому пустяку), а поэтому чаще с ановуляторными циклами, чем с овуляторными. Или же овуляция у многих проходит намного позже, чем при 28-дневном цикле, что является нормой. Другими словами, в большинстве случаев это вполне здоровые молодые женщины, которым просто никто не объяснил, что низкий вес, слишком молодой возраст и стресс являются чаще всего причинами нерегулярного цикла. Таких женщин посылают на проверку гормонального фона и требуют сдать кровь на одни гормоны в начале цикла, а на прогестерон — на 21-й день цикла. Эта цифра «21» чуть ли не магическая. Почему именно на 21-й день цикла? Потому что так принято? Чем другие дни не подходят для сдачи анализов на гормоны? Они подходят; любой день подходит, особенно когда нет овуляции. При ановуляторном цикле нет ни первой фазы, ни второй, поэтому анализы можно сдавать в любой день, тем более что женщины чаще всего и не знают, когда у них наступит очередная менструация — через неделю, две, месяц, три месяца. Так почему же все так «зациклены» на 21-м дне (реже на 22-м или 23-м)? Потому что при нормальном 28-дневном овуляторном цикле здоровых женщин в этот день наблюдается пик прогестерона. Однако нормальным также считается цикл и в 21 день, и в 26 дней, и в 30 дней, и даже в 35 дней, а у некоторых женщин и в 40 дней, если он сопровождается овуляцией. У женщин с циклами больше классических 28 дней разрыв фолликула возникает не на «традиционный» 14-й день цикла, а намного позже. Это не «запоздалая» овуляция, это их (женщин) нормальная овуляция. При 28-дневном цикле подъем уровня прогестерона наблюдается на 7-й день после овуляции, что и есть 21-й день цикла. А если у женщины овуляция раньше или позже, не на 14-й день, то, когда же ожидать повышения уровня прогестерона? Все на тот же 7-й день после овуляции. Какой это будет день цикла — важно научиться правильно считать. Поэтому, если у женщины овуляция на 21-й день при 35–36-дневном цикле, то подъем прогестерона будет наблюдаться на 21+7=28-й день цикла. К сожалению, большинство женщин об этой специфике подъема прогестерона не знают, но прискорбно, что врачи не знают тоже. Вот и получается, что посылают женщину на проверку гормонов. Обычно эстрогены в прекрасной норме, а прогестерон на 21-й день цикла «низковат». И по такому единичному результату анализа сразу же выдается диагноз — недостаточность лютеиновой фазы.11.8.7. Определение реакции эндометрия на прогестерон
Идеальным в диагностике лютеиновой недостаточности было бы сравнение уровней прогестерона в разные дни второй фазы с изменениями эндометрия, потому что логически напрашивается вывод: если уровень прогестерона низкий, значит, секреторные изменения в эндометрии будут нарушенными (слабо выраженными) тоже. Но каково было разочарование, когда большое количество врачей, изучавших гистологическое строение эндометрия, полученного биопсией в разные дни лютеиновой фазы, сравнили результаты. Оказалось, что при низком уровне прогестерона отмечается и нормальное развитие эндометрия и, наоборот, при нормальном уровне прогестерона — плохой эндометрий. Также оказалось, что у здоровых женщин прогестерон может быть низким, но они будут беременеть и вынашивать беременность без проблем. Не влияет на репродукцию и то, что в одних циклах уровень прогестерона низкий, а в других — нормальный. В одних циклах здоровой женщины может быть хороший эндометрий, а в других — плохой. Все это физиологические нормы. Таким образом, определение уровня прогестерона, даже в его динамике, и биопсия эндометрия, даже в разных циклах, не являются достоверными методами диагностики недостаточности лютеиновой фазы. Некоторые врачи считают, что хронологическая биопсия эндометрия, то есть проведение нескольких заборов эндометрия в течение не только одного цикла, а минимум двух-трех, может быть достовернее в получении точных результатов и постановки диагноза. Но как много женщин решится на 6–7 биопсий в месяц в течение даже 2 месяцев подряд, учитывая, что это все же дорогостоящий метод обследования, а кроме того, может сопровождаться серьезными осложнениями? Другими словами, такой метод диагностики использовать на практике не так просто.11.8.8. Современный взгляд на лютеиновую недостаточность
Подведем итоги вышесказанного, формулируя современный взгляд прогрессивных врачей на состояние прогестероновой недостаточности. 1. Первичная недостаточность лютеиновой фазы проявляется как нарушение выработки прогестерона желтым телом или неадекватной реакцией эндометрия на прогестерон. 2. Недостаточность лютеиновой фазы проявляется укорочением второй фазы цикла, а не ее удлинением. В норме продолжительность лютеиновой фазы составляет 12–16 дней (в среднем 14 дней). При недостаточности лютеиновой фазы ее продолжительность составляет от 3 до 10 дней (в среднем 9 дней). 3. в большинстве случаев низкий уровень прогестерона при ановуляторных циклах является закономерным проявлением нарушения процесса овуляции и недостаточности первой фазы. Менструальные циклы при этом чаще всего длинные (более 35–40 дней). 4. Ановуляторные циклы не имеют фазности, поэтому диагноз недостаточности лютеиновой фазы в таких случаях не ставится. 5. У женщин с низким весом (худых) первая фаза удлиненная, часто циклы ановуляторные, обычно больше 35–40 дней, что является физиологической реакцией на низкий вес тела и нехватку жировой ткани, участвующей в усвоении и обмене половых гормонов. У таких женщин уровень кислородного и энергетического голодания тканей (энергетический стресс), в том числе яичников, выше по сравнению с женщинами с нормальным весом тела. 6. Хотя нормальный уровень прогестерона важен для развития беременности, чаще всего прерывание беременности происходит не из-за нехватки прогестерона, а по следующим причинам: дефектное зачатие (дефектное плодное яйцо), поздняя имплантация (тоже нередко из-за дефекта плодного яйца). 7. Недостаточность лютеиновой фазы, когда уровень прогестерона ниже нормальных показателей, наблюдается как физиологическая реакция самозащиты, препятствующая процессам размножения (а поэтому и имплантации возможного продукта зачатия) при следующих состояниях женщины: голодание, анорексия, булимия, расстройства питания, быстрая потеря веса, интенсивные занятия спортом, большие физические нагрузки, стресс, ожирение, старение (старший возраст), в послеродовом периоде. 8. Периодически недостаточность лютеиновой фазы может наблюдаться в нормальных менструальных циклах. 9. Недостаточность лютеиновой фазы наблюдается как вторичный признак при следующих заболеваниях: синдром поликистозных яичников, эндометриоз, гиперпролактинемия, заболевания щитовидной железы, после стимуляции и индукции овуляции, при ряде нарушений обменных процессов. Такой вид недостаточности связан не так с нарушениями количества выработки прогестерона, как с нарушениями его усвоения (например, прогестероновая резистентность). 10. Лютеиновая недостаточность может проявляться укорочением второй фазы, кровомазаньем перед менструацией, повторными спонтанными выкидышами, бесплодием. Подчеркнем, что как изолированный диагноз лютеиновая недостаточность встречается чрезвычайно редко. В постановке диагноза необходимо подтвердить или исключить все вышеперечисленные состояния, которые могут быть причастны к появлению недостаточности желтого тела.11.8.9. Противоречия в постановке диагноза лютеиновой недостаточности
Прогестерон у небеременных женщин вырабатывается в пульсирующем режиме, отражая пульсирующую выработку ЛГ. Его уровень колеблется каждые 90 минут и может увеличиться в 8 раз по сравнению с минимальным уровнем. Поэтому одноразовое определение прогестерона не отражает истинную картину уровня прогестерона. Если процесс выработки прогестерона у небеременных женщин изучен детально, о процессе выработки прогестерона у беременных женщин желтым телом беременности известно мало. Не существует также стандартных характеристик для определения функции желтого тела у женщин, страдающих бесплодием и невынашиванием, и, наоборот, не страдающих бесплодием. Как показывают исследования, у женщин с нормальной репродуктивной функцией имеются большие колебания в выработке прогестерона от цикла к циклу, и концентрация в сыворотке крови в разные циклы бывает совершенно разной. Поэтому случайное единичное измерение уровня прогестерона в одном менструальном цикле не имеет практического значения. Для постановки диагноза лютеиновой недостаточности серийные уровни прогестерона должны определяться не менее чем в трех менструальных циклах с учетом других признаков этого состояния. Обычно колебания прогестерона отмечают в видепостроения графиков уровня этого гормона в течение всего менструального цикла. Для определения нехватки прогестерона многие врачи проводят забор тканей эндометрия (аспирацию) и изучают изменения в нем под влиянием изменений уровней гормонов, о чем упоминалось выше. Фактически биопсия эндометрия, а не определение уровня прогестерона, считалась еще не так давно «золотым стандартом» для постановки диагноза лютеиновой недостаточности (под «золотым стандартом» врачи понимают диагностический тест с наибольшим уровнем достоверности). Запаздывание созревания эндометрия в гистологических образцах является признаком лютеиновой недостаточности. Однако у 25–35 % здоровых женщин без нарушения фертильности (плодовитости) наблюдается периодическая задержка созревания эндометрия на фоне нормального уровня прогестерона, что не отражается на репродуктивной функции женщин. И напротив, даже при очень низких показателях прогестерона у здоровых женщин наблюдается нормальное созревание эндометрия. Поэтому все больше врачей придерживаются мнения, что биопсия эндометрия тоже не может быть достоверным диагностическим методом постановки диагноза лютеиновой недостаточности. Тем более что у беременных женщин биопсию эндометрия не проводят. В эндометрии содержится большое количество других веществ, которые в репродуктивной медицине называют маркерами, и определением этих маркеров нередко пользуются для выяснения причины бесплодия и прогнозирования исхода беременности после ЭКО и применения других репродуктивных технологий. Ни один из известной науки маркеров не является признаком лютеиновой недостаточности.11.8.10. А существует ли диагноз лютеиновой недостаточности?
Несмотря на то что во многих источниках, как медицинских, так и популярных, упоминается диагноз лютеиновой недостаточности, современные врачи считают, что как самостоятельный диагноз «лютеиновая недостаточность» не существует или же встречается очень редко. На чем основано такое мнение? На том, что на сегодняшний момент не существует практических стандартов (репродуктивных, физиологических, лабораторных) для постановки такого диагноза, хотя существуют диагностические критерии, с которыми не соглашаются многие врачи. Ни определение уровня лютеинового прогестерона, ни биопсия эндометрия не зарекомендовали себя как достоверные методы диагностики лютеиновой недостаточности как самостоятельного диагноза, который подлежит корректировке, то есть лечению. Отсутствие данных о норме и отклонениях от нормы уровней прогестерона фертильной группы женщин и беременных женщин на ранних сроках, как и отсутствие таких данных в отношении бесплодных женщин, и, наоборот, наличие огромного количества различий в уровнях прогестерона у женщин репродуктивного возраста, в том числе и беременных женщин, привело современных врачей к мысли, что желтое тело, как и прогестерон, не являются первичными факторами, определяющими прогноз беременности. И клинические исследования по использованию прогестерона после ЭКО подтвердили эти предположения (читайте главу о прогестероне после ЭКО). Подсадка здоровых эмбрионов может быть успешно проведена у женщин без наличия яичников и желтого тела, но при соответствующей гормональной подготовке матки.11.8.11. Нужно ли повышать низкие уровни прогестерона?
Если диагноз лютеиновой недостаточности не существует или противоречив, то возникает вопрос, насколько рационально принимать прогестерон до беременности и в первые недели беременности? Ведь этим увлечены почти все постсоветские женщины и врачи уже как минимум двух поколений. Для заграничных врачей вопрос лечения лютеиновой недостаточности затрагивает этическую сторону больше, чем практическую: насколько этично назначать прогестерон в тех ситуациях, когда лютеиновая недостаточность является результатом других заболеваний, которые необходимо лечить, или состояний, которые необходимо корректировать? Например, если у женщины низкий вес и из-за этого длинные менструальные циклы, нередко с нарушенной овуляцией, — насколько этично назначать ей прогестерон или прогестины (дюфастон) якобы для лечения лютеиновой недостаточности, — не лучше ли объяснить женщине важность жировой ткани в участии обмена половых гормонов, зачатии и вынашивании потомства? Насколько этично назначать прогестерон женщинам, нервничающим по любому пустяку и не понимающим, что стресс усугубляет их проблемы с зачатием и вынашиванием ребенка, — вместо того чтобы рекомендовать консультации психотерапевта или антистрессовую программу? Насколько этично назначать прогестерон при повышенном уровне пролактина, не выяснив причины гиперпролактинемии и не определив наличие или отсутствие овуляции? Другими словами, многие состояния и заболевания, при которых может наблюдаться лютеиновая недостаточность, требуют корректировки и лечения, а не назначения прогестерона и, таким образом, «отфутболивания» женщины и создания у нее ложного убеждения, что назначенный прогестерон поможет ей забеременеть и выносить беременность. Клинические исследования показали, что при натурально (естественно) возникшей беременности, даже если женщине ставился диагноз лютеиновой недостаточности, дополнительное назначение прогестерона не улучшает исход беременности. Нормальная беременность не требует экзогенного (внешнего) прогестерона. Исход патологической беременности на ранних сроках определяется многочисленными факторами, среди которых доминирует природный отбор. Поэтому назначение прогестерона не улучшает исход таких беременностей, но может осложнить процесс естественного избавления женского организма от продуктов дефектного зачатия. Обычно прогестерон задерживает эвакуацию дефектного или мертвого плодного яйца на три недели (20–21 день), вводя в заблуждение женщину, что ее беременность якобы сохраняется. Применение прогестерона заканчивается более частым инструментальным удалением плодного яйца (чисткой). Необходимость лечения лютеиновой недостаточности возникает чаще всего у женщин, страдающих бесплодием или невынашиванием беременности. У одних недостаточность вызвана искусственно (например, после индукции овуляции кломидом), у других — это результат действия определенных факторов, влияющих на выработку и усвоение прогестерона, у третьих — генетического происхождения. Если врач ставит такой диагноз каждой второй женщине, обратившейся к нему за помощью, в том числе из-за нерегулярных циклов, и назначает женщине препараты прогестерона, то достоверность такого диагноза, как и компетентность врача, сводится к нулю.11.8.12. Применения прогестерона для лечения лютеиновой недостаточности
Из всех схем лечения, которые применяются в медицине, наиболее популярные — это назначение гонадотропинов, особенно после индукции овуляции, и препаратов прогестерона, чаще всего в виде влагалищных суппозиториев или внутримышечных инъекций после овуляции. Таблетированные препараты прогестерона используются реже. Как показывают результаты многочисленных клинических исследований, которые были проведены за последние 50 лет, эффективность лечения лютеиновой недостаточности препаратами прогестерона невысока. Лечение синтетическими прогестинами (в том числе дюфастоном) вообще неэффективно. Неэффективность лечения препаратами прогестерона можно объяснить следующим образом: (1) при наличии факторов, которые приводят к развитию лютеиновой недостаточности, гормональное лечение прогестероном будет неэффективным, поэтому в первую очередь всегда необходимо устранить влияние этих факторов; (2) при прогестероновой недостаточности, связанной с нарушением его усвоения тканями-мишенями, дополнительное введение прогестерона к улучшению ситуации тоже не приведет, потому что ткани нечувствительны к любым видам прогестерона.11.8.13. Оптимальная лечебная доза прогестерона
В течение длительного времени между врачами не было, да и до сих пор нет согласия в вопросе, какой должна быть лечебная доза прогестерона для лечения ряда состояний, особенно недостаточности лютеиновой фазы. А можно ли по уровню прогестерона в крови определить индивидуальную дозу прогестерона? Проведенные исследования породили еще больше хаоса, потому что оказалось, что независимо от дозы уровень прогестерона в крови женщин после его введения колеблется в таком широком диапазоне, даже у одной и той же женщины, что подобрать индивидуальную дозу невозможно. Точно такой же широкий диапазон уровней прогестерона наблюдается и в нормальном натуральном цикле. Такие большие колебания имеют строгую зависимость не от дозы прогестерона, а от индивидуальных особенностей усвояемости гормона и его обмена у каждой женщины, в том числе ее индекса массы тела. Помимо индивидуальных особенностей обмена прогестерона, его усвояемость и выведение зависят от вида потребляемой пищи. Таким образом, лечебная доза прогестерона не найдена до сих пор, как и не найдена оптимальная продолжительность назначения прогестерона. В разных публикациях можно найти разное количество дней лечения — от 5 до 14, что не имеет научных клинических фактов, подтверждающих эффективность такой продолжительности.11.8.14. Кровотечение отмены
Исследования, как на животных, так и на людях, показали, что реакция на отмену прогестерона и его метаболитов может быть разной, но чаще всего после прекращения его приема у женщин наблюдается кровотечение отмены. Продолжительность и интенсивность этого кровотечения не зависят от дозы и продолжительности применения прогестерона, а зависят от индивидуальной реакции женщины на прогестерон и его метаболиты, хотя такое кровотечение чаще возникает после применения высоких доз прогестерона. А как быть в ситуации, если женщина планирует беременность? Ведь многие врачи назначают прогестерон (дюфастон) совершенно необоснованно, просто «на всякий случай», потому что все так делают. Часто это назначение настолько неадекватно, что нарушается овуляция и такое лечение становится контрацептивной схемой применения прогестерона. Многие принимают прогестерон с 14–16-го дня цикла до 25-го (обычно в старых публикациях продолжительность лечения недостаточности лютеиновой фазы составляла 10 дней). Но на 25-й день цикла у женщины может быть плодное яйцо в матке, если она не предохраняется и ей удалось забеременеть (но не благодаря прогестерону). Отмена прогестерона в этот день может кардинально повлиять на процесс имплантации, вызывая кровотечение отмены. Диагностировать беременность по уровню ХГЧ можно будет намного позже. Продолжение приема прогестерона тоже нерационально — цикл будет продлен, что ошибочно может быть принято за беременность и нарушит гормональный фон женщины.11.8.15. Роль витамина С в лечении лютеиновой недостаточности
Оказалось, что у женщин, страдающих первичной недостаточностью лютеиновой фазы, в сыворотке крови повышен уровень веществ, связанных с окислением жиров (липопероксидацией), в то время как уровни витамина С (аскорбиновой кислоты), витамина Е (α-токоферола) и эритроцитарного глютатиона, известных своими антиокислительными свойствами, — понижены. Основное действие аскорбиновой кислоты в организме человека осуществляется в трех направлениях: биосинтез коллагена, биосинтез стероидных и белковых гормонов, понижение или устранение окисления молекул (антиокислительный эффект). Известно, что яичники являются органами, накапливающими аскорбиновую кислоту, чаще всего в тека-клетках и гранулезных клетках. В процессе роста фолликула концентрация витамина С в его жидкости увеличивается и становится больше концентрации в сыворотке крови. Поэтому ряд ученых-врачей предположили, что назначение дополнительной дозы витамина С может улучшить состояние лютеиновой недостаточности. Однако исследования в этом направлении показали, что несмотря на то что аскорбиновая кислота незначительно повышает уровни эстрадиола и прогестерона у женщин с лютеиновой недостаточностью, ее применение не приводит к улучшению уровня зачатий и вынашивания беременности. Таким образом, подводя итоги прогестероновой недостаточности, следует помнить, что у большинства женщин, которым выставляют этот диагноз, такого состояния нет, а назначение прогестерона является совершенно необоснованным и ошибочным.11.9. Прогестерон и беременность после 40 лет
Вступая в предклимактерический период, многие женщины сталкиваются с нерегулярностью менструальных циклов. Естественно и нормально, что циклы могут быть длиннее, выпадать и сопровождаться большим кровотечением, являющимся результатом гиперплазии эндометрия. Но для очень многих женщин «неудобством» становятся не сама нерегулярность месячных, а страх забеременеть, несмотря на возраст. Женщины не знают, что этот шанс чрезвычайно низкий, потому что с возрастом созревает все меньше и меньше полноценных яйцеклеток, и даже если произошло зачатие, чаще всего оно дефектное, поэтому к беременности не приводит. К тому же, большинство женщин по достижении этого возраста не ведут регулярную половую жизнь. Но в этой возрастной категории женщин в последнее время появляется все больше таких, для которых беременность является желанной, особенно если до этого своих детей не было. Причины, по которым женщины откладывают детородную функцию, много. Очень часто просто не учитывается временной фактор: время летит быстрее, чем люди это замечают, постоянно имеются какие-то отговорки для откладывания зачатия детей. С возрастом, особенно после 37–38 лет, шанс зачатия ребенка понижается ускоренными темпами. Тем не менее, при почти нулевом шансе забеременеть наблюдаются единичные случаи беременности и после 45 лет. И новости о таких поздних зачатиях распространяются быстрее, чем другая полезная информация, вызывая или страх, или желание стать «одной из них» у многих женщин. Обычно у женщин после 40 лет, обратившихся к врачу то ли с целью осмотра перед планированием беременности, то ли из-за того, что забеременеть не удается, находят определенные отклонения в работе репродуктивных органов. И нередко для восстановления регулярных кровотечений женщинам в предклимактерическом периоде назначают прогестерон, чаще всего по контрацептивной схеме. Еще реже прогестерон назначают для восстановления фертильности, обычно для поддержки лютеиновой фазы. К сожалению, «борьба» с нерегулярностью цикла у таких женщин заканчивается потерей драгоценного времени и еще большим угасанием функции яичников. В большинстве случаев такие женщины нуждаются в помощи репродуктивных технологий, а не в применении прогестерона.11.10. Прогестерон после репродуктивных технологий
Современные репродуктивные технологии позволяют иметь детей в тех случаях, которые еще десятилетие тому назад считались безнадежными. Эти технологии могут быть простыми и сложными, от стимуляции овуляции до применения донорских яйцеклеток и сперматозоидов. Эра замораживания половых клеток и эмбрионов на несколько месяцев и даже лет меняется на эру подсадки эмбрионов, полученных и подсаженных в одном менструальном цикле — процесс ЭКО стараются приблизить по максимуму к естественному зачатию. Объемные многомесячные протоколы меняются на короткие с минимальным применением лекарственных средств, потому что «много» всегда означает «не лучше». Все репродуктивные технологии можно разделить на те, когда образуется желтое тело в яичниках, и когда желтого тела нет. Это деление кардинально меняет понимание процессов, происходящих в организме женщины, и определяет потребность назначения экзогенного прогестерона. У женщин старше 40 лет чаще всего проводят ЭКО с помощью донорских яйцеклеток, взятых у молодой категории женщин. И клинические эксперименты, когда женщины в старшем возрасте рожали детей после ЭКО, подтверждают один важный факт: для успешного развития беременности важно в первую очередь качество плодного яйца, а не состояние женщины в целом и ее возраст.11.10.1. Прогестерон и гиперстимуляция яичников
Все технологии экстракорпорального оплодотворения требуют получения эмбриона in vitro, то есть в лабораторных условиях, поэтому часто ЭКО называют ин-витро фертилизацией. Такой вид зачатия успешен, если используется несколько яйцеклеток. Не все яйцеклетки, как и полученные эмбрионы, будут качественными, поэтому успех зависит и от количества полового материала. В таких репродуктивных технологиях пользуются особым видом индукции овуляции, которая называется гиперстимуляцией яичников, когда получают не просто один или два зрелых фолликула, но несколько в каждом яичнике (8–12). Так как при гиперстимуляции созревает много фолликулов, такое состояние сопровождается повышенным уровнем эстрадиола и прогестерона, что может привести к преждевременной лютеинизации фолликулов. Обычно для предупреждения преждевременной лютеинизации вводят гонадотропины (ХГЧ и другие). В последние тридцать лет развития репродуктивной медицины основное внимание уделялось фолликулярной фазе для получения качественных половых клеток с целью улучшения фертильности женщины или проведения ЭКО. Лютеиновая фаза, наоборот, оставалась в стороне, хотя традиционно почти все врачи назначали препараты прогестерона внутримышечно или вагинально для поддержки лютеиновой фазы. Назначение прогестерона было основано скорее на теоретических гипотезах, чем на практических доказательствах, и эти гипотезы возникли как результат анализа развития беременности после удаления желтого тела или яичников у животных и людей. Большинство исследователей и врачей считали, а некоторые считают до сих пор, что чем выше уровень эстрадиола при стимуляции яичников, тем больше качественных ооцитов можно получить. Но оказалось, что от большего количества яйцеклеток на фоне большего уровня эстрогена не удается получить более качественные не только яйцеклетки, но и эмбрионы, и тем самым улучшить исход ЭКО. Оказалось, эстрадиол имеет свои ограничения во влиянии на качество и количество ооцитов, особенно живых, поэтому по измерению его уровня невозможно знать, сколько качественных живых эмбрионов можно получить после такой стимуляции овуляции. Ученых заинтересовал вопрос, как можно предсказать получение качественных живых эмбрионов при проведении гиперстимуляции яичников с помощью других маркеров крови. После поиска и оценки разных видов веществ оказалось, что уровень прогестерона в день забора яйцеклеток является лучшим прогностическим фактором качества ооцитов, как и прогноза такой стимуляции, чем эстрадиол и другие гормоны и вещества. Если в день получения яйцеклеток уровень прогестерона больше 11.7 нг/мл, такая стимуляция позволяет получить в среднем 4 качественных живых эмбриона, подсадка которых завершится возникновением беременности в 50 % случаев. Чувствительность такого метода составляет 80 %. Традиционно считалось, что экстракорпоральное оплодотворение не сопровождается образованием желтого тела беременности, поэтому требует дополнительного приема прогестерона. Это мнение было сформировано на постулате «без желтого тела беременность прогрессировать не может», возникшего более 70 лет тому назад. У женщин с удаленными яичниками после ЭКО повышение уровня прогестерона можно обнаружить уже через 3 недели после подсадки эмбриона (5 недель беременности). Действительно, чаще всего таким женщинам необходима поддержка прогестероном. Удаление желтого тела до 8 недель тоже может закончиться потерей беременности, однако неизвестно, насколько само хирургическое вмешательство не нарушает протекания беременности на ранних сроках. Довольно часто женщины, проходящие ЭКО, овулируют, и поэтому у них есть желтое тело (например, при трубном факторе бесплодия). Стимуляция овуляции для получения яйцеклеток тоже сопровождается образованием желтого тела, и порой не одного. Фактически многие женщины после гиперстимуляции яичников страдают синдромом гиперстимурированных яичников (и прогестерон при этом тоже значительно повышен) и нередко таким женщинам необходимы наблюдение и лечение в стационаре. Желтое тело может отсутствовать только у женщин, страдающих ановуляторными циклами, когда используются донорские половые клетки или полученные в прошлом и сохраненные собственные половые клетки.11.10.2. Необходим ли прогестерон после ЭКО при наличии желтого тела?
Современные ЭКО-технологии проводятся чаще всего в менструальном цикле, когда получены яйцеклетки, чтобы приблизить процесс искусственного зачатия и имплантации эмбриона к натуральному процессу и по времени, и по условиям, даже при наличии синдрома гиперстимулированных яичников. Конечно, многих женщин готовят к ЭКО введением ряда препаратов. Но если сравнить протоколы постсоветских стран с протоколами других стран, можно увидеть, что они отличаются слишком большой агрессивностью и введением слишком большого количества лекарственных препаратов. Это не только не улучшает исход ЭКО, но и вызывает в организме женщины много нарушений обмена веществ и других побочных эффектов. Таким образом, довольно часто в цикле, когда проводят ЭКО, образуется желтое тело или несколько тел. Необходимо ли в таком случае вводить дополнительно прогестерон? Показания для дополнительного введения прогестерона были основаны на теоретической гипотезе, что после любого ЭКО нет своего желтого тела, потому что искусственное оплодотворение исключает из жизни женщины тот начальный период от сигнализации о зачатии и до появления эмбриона в полости матки. Тем не менее, оказалось, что здоровое плодное яйцо имплантируется в стенку матки после ЭКО даже если исключен период передвижения плодного яйца по маточным трубам. Многие врачи считают, что у овулирующих женщин, которым проводилось ЭКО, назначение прогестерона нецелесообразно. Другими словами, речь идет о назначении прогестерона в тех случаях, когда у женщины не появляется свое желтое тело. Но традиционно прогестерон все же назначается. Здесь играет роль еще один важный факт: еще не так давно, а во многих странах до сих пор, для стимуляции овуляции использовали кломифена цитрат (клостилбегит, кломид), который серьезно нарушал качество эндометрия, создавая искусственно маточный фактор бесплодия. Кломид также нарушал качество шеечной слизи. Поэтому уровни зачатия и успешной имплантации после применения кломида все же значительно страдают. Почему кломид используют до сих пор? Этот вид стимуляции и индукции овуляции является одним из самых дешевых и непродолжительных и сопровождается меньшим количеством осложнений в виде синдрома гиперстимулированных яичников. Кроме того, применение этого лекарственного вещества позволяет получить один-два полноценных овулирующих фолликула, что необходимо при лечении ряда заболеваний без вовлечения других репродуктивных технологий (например, бесплодие по неизвестным причинам). Исследования показали, что дозы и режимы приема кломифена цитрата влияют одинаково на уровень зачатия, что дает врачам определенную свободу в выборе того режима, к которому они привыкли и применяют на практике чаще всего. Тамоксифен, который начали использовать некоторые врачи для индукции овуляции, не имеет преимуществ перед кломидом по эффективности, хотя дает больше побочных эффектов и стоит дороже. Для мультифолликулярного развития, то есть получения нескольких полноценных фолликулов (гиперстимуляции), требуются другие препараты, и золотое правило, которое существует в современной репродуктивной медицине, гласит: врач должен выбрать тот протокол стимуляции яичников, который вызывает меньше осложнений и побочных эффектов. Агрессивность по отношению к яичникам, которая была частью репродуктивных технологий еще несколько лет тому назад, сменилась бережным отношением к этим важным органам. Яйцеклетки ведь не восстанавливаются, а любая стимуляция и индукция овуляции истощает яичниковый запас ускоренными темпами. Использование репродуктивных технологий — это как игра с огнем: в одних случаях она может помочь, в других — приведет к непоправимым негативным последствиям. Важно попасть в руки к специалисту, который понимает и знает свое дело. Гонадотропинам до сих пор отдается предпочтение при получении яйцеклеток для ЭКО. В заграничных клиниках по бесплодию доза лекарственных препаратов зависит в первую очередь от возраста женщины и ее веса. Короткие протоколы применяют для более молодых женщин, продолжительные комплексные — для старших женщин. Длительные протоколы являются более дорогостоящими, поэтому не каждая женщина сможет ими воспользоваться. Заметим, что 22 крупных рандомизированных исследований показали преимущество коротких протоколов в уровне зачатий по сравнению с длинными и объемными. В последнее время вместо гонадотропинов или вместе с ними начали использовать агонисты гонадотропин-рилизинг гормонов. Оказалось, что уровень зачатий незначительно выше, но продолжительность протокола сокращается. Несмотря на разнообразие протоколов и препаратов, используемых в репродуктивной медицине, назначение прогестерона для поддержки лютеиновой фазы до сих пор основано чаще на старых традиционных взглядах, чем на рациональном подходе и понимании необходимости применения прогестерона или прогестинов. Важно понимать, что в организме женщины, а тем более беременной, существует строгая пропорция между уровнями гормонов, и именно эта пропорция определяет положительное влияние на имплантацию. Мнение, что чем больше прогестерона, тем лучше, является не просто ложным, а опасным, и современные репродуктологи знают об этом. Назначение «лишнего» прогестерона понижает уровень возникновения беременности после любых репродуктивных технологий. Исследования показали, что высокие уровни прогестерона приводят к понижению чувствительности к нему эндометрия (блокируют рецепторы эндометрия), что нарушает процесс имплантации. У женщин с низким уровнем прогестерона уровень беременностей ниже по сравнению с теми, у кого уровень прогестерона в норме. Но у женщин, у которых уровень прогестерона повышен, в том числе за счет экзогенного прогестерона, уровень возникновения беременности и ее прогресса тоже значительно понижается.11.10.3. Как долго необходим прогестерон после ЭКО?
Раньше после ЭКО назначали прогестерон до 16 недель беременности женщинам, которым вводили донорские эмбрионы. Обоснование такого длительного приема прогестерона или прогестинов отсутствовало — большинство врачей очень мало знали об истинной роли желтого тела в сохранении беременности. Вскоре период «лютеиновой поддержки» сократился до 12 недель. С прогрессом понимания процессов имплантации и развития беременности прогестерон начали назначать только до 5–6 недель беременности. Современные рекомендации гласят, что дополнительный прогестерон необходим только первые две недели после проведения ЭКО. Исследования подтвердили, что при ЭКО с использованием протоколов по применению антагонистов и агонистов гонадотропин-рилизинг гормонов поддержка прогестероном достаточна до 4 недель беременности (фактически только первые две недели беременности). Последние клинические исследования показывают, что назначение прогестерона в течение 3–5 дней после введения эмбриона обеспечивает такой же исход беременности, как и применение прогестерона более длительный период времени. Большинство же врачей традиционно назначает после ЭКО прогестерон до 8–10 недель беременности. Прогноз вынашивания беременности после ЭКО мало зависит от прогестерона. В реальности данных о том, что при уровне прогестерона больше 10 нг/мл прогноз ЭКО положительный, очень мало. Наоборот, все эксперты в репродуктивной медицине пришли к консенсусу, что уровень прогестерона в крови не имеет связи с исходом беременности после ЭКО. Может ли беременность развиваться после вспомогательных репродуктивных технологий без поддержки лютеиновой фазы? Оказалось, что может, и это доказано клиническими исследованиями. Почему же многие врачи до сих пор назначают экзогенный прогестерон до 12, а порой 14–16 недель беременности? Только из-за перестраховки и «по привычке».11.10.4. Когда необходимо прекращать прием прогестерона?
Так, когда же необходимо прекратить прием прогестерона после использования репродуктивных технологий, если его все же назначили? Мнения заграничных врачей делятся на три точки зрения: (1) прием прогестерона должен быть прекращен после получения первого положительного уровня β-ХГЧ, (2) после первого УЗД в 6–7 недель, (3) после 8 недель беременности. Отмена прогестерона через два дня после получения положительного β-ХГЧ тоже не повышает риск потери беременности. Исследования также показали, что в мониторинге развития беременности после применения репродуктивных технологий играет роль не определение уровня прогестерона и назначение его дополнительно, а контроль уровня ЛГ и его пульсирующей выработки. Поэтому некоторые врачи используют дополнительное введение гонадотропинов, например, ХГЧ или ЛГ, после овуляции и получения ооцитов для ЭКО. Это объясняется тем, что гонадотропины имеют большее влияние на выработку прогестерона желтым телом и могут предотвратить преждевременную лютенизацию эндометрия после стимуляции яичников, а значит, расширить окно имплантации. Такие беременности прогрессируют без всякого дополнительного введения прогестерона. Все больше врачей считают, что прогестероновая поддержка лютеиновой фазы со временем перестанет быть актуальной и останется в прошлом. Передовые репродуктивные центры Европы, Северной Америки и Австралии рекомендуют минимальное применение любых лекарственных веществ, в том числе прогестерона, на ранних сроках беременности, и эти рекомендации основаны на принципе «не навреди» с учетом всех современных знаний, опыта и достижений в репродуктивной медицине. Будущее за направлением этой отрасли медицины — индивидуальным подходом в наблюдении каждой женщины после ЭКО.11.10.5. Какие формы прогестерона лучше применять после ЭКО?
Прогестерон применяют орально (таблетки), влагалищно (суппозитории и влагалищные таблетки) и внутримышечно (инъекции). Таблетированные формы прогестерона после ЭКО себя не зарекомендовали, потому что после попадания в желудочно-кишечный тракт только 10 % микронизированного прогестерона всасывается и попадает в кровь женщины, а его другие формы вообще не всасываются (фактически оральные формы прогестерона являются пустышками). Кроме того, таблетированные формы прогестерона вызывают немало побочных эффектов. Поэтому в репродуктивной медицине чаще всего применяют внутримышечные инъекции прогестерона, которые насыщают кровь этим гормоном быстро, однако тоже сопровождаются большими побочными эффектами. Если учесть, что назначение прогестерона внутримышечно требует постоянных визитов женщины в течение нескольких недель в репродуктивную клинику, такая поддержка становится серьезным барьером для многих женщин. Влагалищное применение прогестерона позволяет повысить насыщение гормоном ткани матки, минуя процесс распада гормона в желудочно-кишечном тракте. Клинические исследования последних лет показали, что применение прогестерона в виде влагалищных свечей после ЭКО не улучшает исход процедуры и уровень фертильности не повышает. Незначительное улучшение отмечалось только у женщин с фиброматозными узлами и после пункции матки для получения яйцеклеток (затрудненное получение ооцитов). Очевидно, после травмы матки, а также при наличии миом, может наблюдаться повышенная сократительность и болезненность матки, поэтому кратковременное назначение прогестерона может положительно повлиять на подавление сократительной деятельности матки. Дополнительное назначение ХГЧ с прогестероном или без него после ЭКО или после применения других репродуктивных технологий исход беременности не улучшает. Некоторые врачи применяют ХГЧ только до момента диагностирования прогрессирующей беременности (обычно 4–5 недель).11.11. Прогестерон и преждевременные роды
Во всем мире проблема преждевременных родов остается актуальной до сих пор, так как она связана с высокими уровнями смертности и заболеваемости новорожденных. До 70 % недоношенных новорожденных имеют какие-то проблемы со здоровьем или же умирают в результате выраженной незрелости. О преждевременных родах мы говорим в случаях спонтанного или искусственного прерывания беременности с 20 до 37 недель, и они встречаются в 12 % всех беременностей. Считается, что чаще всего преждевременные роды вызваны наследственным фактором (генетическим компонентом), так как они наблюдаются в поколениях женщин — у дочерей, матерей, бабушек, а также близких родственников. Поэтому предполагается, что этот генетический компонент имеет непосредственное отношению к количеству и качеству прогестероновых рецепторов (ПР). Преждевременные роды, которые возникают до 32 недель беременности, опасны высоким уровнем смертности и заболеваемости новорожденных, поэтому исследователи постоянно ищут методы и средства предупреждения таких родов. Две трети преждевременных родов связаны с преждевременным разрывом плодных оболочек или спонтанным прерыванием беременности и возникновением родовой деятельности.11.11.1. Причины преждевременных родов
Возникновение родов является сложным процессом взаимодействия многих веществ. Один из механизмов родов включает понятие апоптоза, то есть клеточной смерти плаценты, который происходит перед родами в срок (при нормальной доношенной беременности). Но высокий уровень апоптоза наблюдается также в плаценте у женщин с преждевременными родами. Что вызывает преждевременную клеточную гибель плаценты, неизвестно. Однако предполагается, что прогестерон оказывает «спасительное» действие на клетки плаценты, задерживая их старение и самоуничтожение. Чувствительность клеток к прогестерону зависит от количества прогестероновых рецепторов. Известно, что рецепторы ПР-В едва активны в плаценте в течение всей беременности, как на поверхности мембраны, так и внутри ядра. Преждевременные роды до 34 недель наблюдаются у 2 % беременных женщин одним плодом. В двух третях случаев роды возникают спонтанно, часто с преждевременным разрывом плодных оболочек. В остальной трети случаев роды возникают по ятрогенной причине, то есть искусственно, что может быть связано с заболеванием матери (чаще всего неконтролируемой гипертонии беременных и преэклампсии), заболеваниями плода и врачебными ошибками в диагностировании и лечении беременных женщин. У большинства млекопитающих роды возникают при доношенных беременностях как результат понижения уровня прогестерона, фактически как результат «отмены» прогестерона. У женщин высокий уровень прогестерона наблюдается почти до конца родов, но только в крови. Локально, то есть в матке и ретроплацентарном пространстве, его уровни значительно понижаются перед родами, что было обнаружено не так давно.11.11.2. Роль прогестерона в укорочении шейки матки
Известно, что во время беременности прогестерон воздействует в первую очередь на матку (лютеиновый прогестерон — на эндометрий, плацентарный прогестерон — на миометрий), шейку матки и плодовые оболочки. Считается, что прогестерон контролирует размягчение шейки матки и ее укорочение в ходе подготовки к родам (и одним из ранних признаков беременности является размягчение шейки матки). Однако действие прогестерона специфическое: несмотря на размягчение шейки матки и незначительное ее укорочение в течение беременности, все же существует неизвестный пока механизм контроля созревания шейки матки. Интересно, что количество коллагена в тканях шейки матки, отвечающего за ее эластичность, не меняется, а меняется его организация, то есть перераспределение в тканях шейки матки. Введение препаратов, подавляющих действие прогестерона (антипрогестина) во второй половине беременности и перед родами приводит к быстрому созреванию шейки матки и ее раскрытию. Поэтому неизвестно, каким образом прогестерон действует в двух противоположных направлениях: вызывает изменения в шейке матке и препятствует ее быстрому укорочению и раскрытию. Одновременно причиной истмико-цервикальной недостаточности, из-за которой женщины теряют беременности во втором и третьем триместре и которая может быть причиной преждевременных родов при отсутствии других факторов риска, нередко считают воздействие высоких уровней прогестерона. Исследования на животных моделях показали, что два белка — тромбоспондин-2 и тенасцин С играют роль в реорганизации коллагена и при их нехватке возникает преждевременное созревание шейки матки и ее размягчение. Также обнаружено более 300 генов, регулирующих изменения в шейке матки при нормальных родах в срок и преждевременных родах. Поэтому ученые не исключают генетическую связь с преждевременным созреванием шейки матки, когда изменения происходят на молекулярном уровне из-за генетического полиморфизма или других генных дефектов.11.11.3. Роль прогестерон-индуцированного блокирующего фактора
Обнаружено, что эффект прогестерона на беременную матку может контролироваться белком, вырабатываемым лимфоцитами, который называется прогестерон-индуцированным блокирующим фактором (progesterone-induced blocking factor — PIBF, ПИБФ). Этот фактор оказывает защитное действие на матку, и у женщин с преждевременными родами концентрация этого фактора ниже по сравнению с женщинами, родившими в срок, почти на 70 %. Пониженный уровень ПИБФ находят также в моче женщин, страдающих повторными выкидышами и преждевременными потерями беременностей. Врачей-исследователей интересовал вопрос, может ли ПИБФ быть маркером, по уровню которого прогнозировать преждевременные роды можно заранее, а значит, принять меры по профилактике потери беременности. Исследования показали, что до 11–13 недель беременности уровень этого фактора одинаковый у женщин, рождающих преждевременно или в срок. Эти данные говорят о том, что механизм активации данного фактора включается после первого триместра беременности, что наталкивает на мысль, что первый триместр беременности является своего рода «отборочным туром» по качеству — дефектное зачатие отсеивается, неподготовленность женского организма к вынашиванию беременности тоже учитывается. И только после регуляции качества зачатого потомства включаются механизмы самосохранения беременности. Низкий уровень ПИБФ отмечается у женщин перед преждевременными родами, однако механизм его понижения неизвестен, как и не определено пока практическое значение измерения уровня этого фактора в крови.11.11.4. Использование прогестерона для профилактики преждевременных родов
На тему использования прогестерона для профилактики преждевременных родов во всем мире проведено около 800 клинических исследований, а возможно, и больше. Но из этого большого объема исследований лишь некоторые были проведены согласно требованиям доказательной медицины, где учитывались многие критерии. Применение прогестерона для профилактики преждевременных родов вызывало немало вопросов. Например, какой должна быть терапевтическая доза экзогенного прогестерона, если учесть, что организм женщины, в том числе матка, уже насыщены прогестероном, концентрация которого и так повышена? Какой должна быть минимальная длина шейки матки для получения положительного эффекта от лечения прогестероном? Какой оптимальный срок назначения прогестерона для предупреждения преждевременных родов? Оказалось, что четких ответов на эти вопросы нет, несмотря на проведенные клинические исследования в этой области. Во многих исследованиях участвовало очень небольшое количество добровольцев. Срок беременности, при котором назначали прогестерон, тоже был разным. Чаще всего использовались влагалищные свечи или гель с прогестероном. Исследования показали, что применение прогестерона имеет незначительный положительный эффект только у небольшой группы женщин, длина шейки матки которых не меньше 25мм. Однако такая длина шейки матки считается нормальной, а тотальный скрининг беременных женщин в отношении риска преждевременных родов не рекомендуется. У женщин с шейкой матки меньше 15мм применение прогестерона возможно только при наличии истории преждевременных родов в прошлом, но в какой форме, какой дозе, как долго, каким путем администрации — рекомендаций не существует. В течение некоторого времени прогестерон назначали беременным между 24–32 неделями беременности, но результаты оказались противоречивыми. Большинство врачей все же не используют прогестерон или его аналоги во второй половине беременности. Почти все профессиональные медицинские организации не рекомендуют рутинное применение прогестерона для предупреждения преждевременных родов, акцентируя внимание на том, что необходимо проведение большого количества исследований в этом направлении. Интересен факт, что в феврале 2011 года FDA разрешил использование синтетического прогестерона (гидроксипрогестерона капроната) для понижения риска повторных преждевременных родов у женщин с историей хотя бы одного эпизода преждевременных родов в прошлом. Впервые за последние 15 лет эта организация разрешила использование лекарственного вещества при беременности. Оказалось, что четких рекомендаций и схем применения прогестерона с этой целью все же не существует. Кроме того, прогестерон оказалсясовершенно неэффективным у женщин из группы высокого риска по невынашиванию беременности. У идеально подобранных кандидатов, женщин из группы низкого риска, прогестерон может быть эффективным только у трети таких женщин. И здесь возникает вопрос у очень многих врачей: как выбрать из когорты женщин с риском преждевременных родов идеальных кандидатов для терапии прогестероном? Большинство американских врачей относятся к прогестерону с большой осторожностью, все еще храня в памяти данные, которые потрясли медицинские круги всего мира — причастность заместительной гормональной терапии к повышению уровней рака молочной железы. Поэтому очень часто американские врачи заявляют: прогестерон не должен рассматриваться как очередная панацея.11.12. Прогестерон и внематочная беременность
Популярным было и остается измерение уровня прогестерона для определения наличия живой внутриматочной и трубной беременности. Известно, что низкий уровень прогестерона может наблюдаться при спонтанных потерях беременности и быть признаком внематочной беременности, которые считаются беременностями «неживым плодом». При нормальных маточных беременностях и наличии живого плода уровень прогестерона обычно в норме. Среди женщин постсоветского пространства доминирует страх в отношении внематочной беременности. Обычно в первые же дни задержки менструации женщины ждут не нормальную беременность, а панически ищут «доказательства» наличия внематочной беременности. Сравнивая психическое и эмоциональное состояние женщин разных стран мира и континентов, можно с уверенностью сказать, что постсоветские женщины живут в постоянном страхе и окутаны чрезвычайно негативной аурой. Является ли уровень внематочных беременностей в странах Восточной Европы выше по сравнению с такими показателями в других странах, чтобы «оправдать» этот панический страх? Статистика случаев внематочной беременности во всем мире приблизительно одинаковая, за исключением постсоветских стран, и составляет меньше 1 % случаев беременности. Самые высокие уровни смертности из-за внематочной беременности в странах Африки, в Бразилии и Мексике. В США, Канаде и странах центральной и западной Европы в 99.99 % случаев внематочная беременность не заканчивается смертью женщины. Во многих странах регистрируется 1 смертельный случай в 1–3 года (зависит от уровня населения). По данным статистики Национального руководства по гинекологии в 2006 году в России было выполнено 45 673 операции по поводу внематочной беременности, за 10 лет в России умерло 243 женщины от внематочной беременности. Данных по Украине нет, но предположительно уровень этого состояния в процентном соотношении такой же, как в России. Сравнительный анализ данных и ряд других публикаций показывает, что уровень внематочных беременностей по сравнению с мировыми показателями приблизительно в два раза выше. Являются ли такие показатели проявлением гипердиагностики и проявлением коммерциализации лапароскопий на территории бывших советских республик, или же действительно уровни внематочных беременностей больше, неизвестно. Однако настораживает ряд фактов. Во всем мире проведено несколько сотен клинических исследований и опубликовано около 5000 медицинских статей на тему диагностики эктопической беременности, спонтанных выкидышей и замершей беременности за последние несколько десятков лет. Но когда в 2012 году группа ученых и врачей провела статистический и эпидемиологический анализ публикаций, оказалось, что только 26 исследований, которые включали почти девять с половиной тысяч женщин в целом, были проведены в соответствии с требованиями доказательной медицины и их данные можно считать достоверными. В этом как раз и заключается самая серьезная проблема современных источников информации — объем публикаций, а значит, данных, увеличивается с каждым годом, однако только чрезвычайно маленький процент предоставляемой информации окажется достоверным, и эти данные могут быть приняты к сведению. В таком интенсивном потоке информации не всегда даже опытный врач может разобраться, не говоря уже о людях без медицинского образования. Доказано, что у женщин, принимающих препараты синтетического прогестерона с целью контрацепции или для лечения ряда заболеваний, количество внематочных беременностей повышено. То есть прогестины являются факторами риска по развитию внематочной беременности. Здесь важно упомянуть пресловутый дюфастон, которым увлечены многие врачи и женщины постсоветского пространства. Ошибочно его называют натуральным прогестероном или просто прогестероном. Дюфастон — это синтетический прогестерон, или прогестин — дидрогестерон, из группы прегнанов (см. схему классификации прогестинов в главе, посвященной вопросам синтетических форм прогестерона). Этот препарат не прошел лицензирование для лечения угрожающего аборта и других показаний по применению ни в США, ни в Австралии, ни в Канаде. В 2008 году он был запрещен к продаже в Великобритании. В некоторых аннотациях препарата говорится, что дюфастон якобы в отличие от других видов прогестинов не подавляет овуляцию. Это ложная информация: дидрогестерон, как и все прогестины, подавляет овуляцию, если его применяют в дозе больше 30 мг в день в первой половине цикла, то есть по контрацептивной схеме. Слухи о том, что ВМС повышает риск возникновения внематочной беременности, являются ложными. Наоборот, количество внематочных беременностей у женщин с ВМС ниже количества таких беременностей у женщин, не пользующихся контрацепцией. Однако если женщина забеременела при наличии ВМС, всегда необходимо исключить внематочную беременность. Внутриматочная гормональная система «Мирена», содержащая прогестин, наоборот, повышает риск внематочной беременности. Влияние экзогенного биоидентичного прогестерона на развитие внематочной беременности никем не изучалось, потому что этот гормон практически не назначается беременным женщинам во всем мире, за исключением редких случаев, ни с целью зачатия ребенка, ни как «сохраняющая терапия». Исключение в назначении препаратов прогестерона составляют женщины, у которых зачатие ребенка проведено с помощью репродуктивных технологий. И здесь на поверхность выплывает второй важный факт: у таких женщин уровни внематочной беременности выше, чем у беременных женщин после естественного зачатия. Известно, что прогестерон не только расслабляет мышцы матки, но и мышцы маточных труб — их моторика уменьшается. Известно также, что нарушения в моторике маточных труб являются фактором, провоцирующим развитие внематочной беременности. Уровень внематочной беременности после индукции овуляции составляет от 2 до 3 % и после ЭКО — 3–4 %. Конечно, объяснение механизмов таких высоких уровней может быть разное, но довольно часто в этих объяснениях упускается очень важный факт — после индукции и после ЭКО большинство женщин принимают прогестерон или прогестины. Таким образом, учитывая приведенные факты, нельзя исключить, что у женщин, принимающих прогестерон и прогестины на ранних сроках беременности, уровень внематочной беременности выше. Поэтому страх постсоветских женщин может быть весьма обоснован.11.13. Прогестерон и фолиевая кислота
Фолиевая кислота необходима для нормального роста, развития и функции клеток. Это водорастворимый витамин (В9), играющий ключевую роль в переносе одноуглеродных групп, например, метильных, при синтезе ряда органических веществ, в том числе ДНК, а также при митотическом делении клеток. Понижение уровня фолиевой кислоты приводит к замедлению и даже остановке клеточного деления, что используется для лечения некоторых видов рака (метотрексат в лечении хорионэпителиомы). Фолиевая кислота очень важна для беременности, когда происходит интенсивное деление и рост клеток эмбриона, поэтому ее прием рекомендуется всем женщинам, планирующим беременность, и беременным женщинам. Нехватка фолиевой кислоты сопровождается повышенным уровнем ряда пороков развития нервной, сердечно-сосудистой систем, а также нарушением роста и развития плаценты, повышенным уровнем спонтанных абортов, низким весом новорожденных. Транспорт фолиевой кислоты из крови матери в плодное яйцо и эмбрион происходит через клетки наружного слоя ворсинок плаценты (хориона), который называется синцитиотрофобластом. Его клетки содержат не только специальные рецепторы фолиевой кислоты, но и ее переносчика. Однако уровень фолиевой кислоты в цитоплазме клеток контролируется не только рецепторами и переносчиками, но также рядом ферментов, принимающих участие в переносе витамина из крови матери в клетки трофобласта, а также рядом белков, которые условно называют «протеинами, устойчивыми ко многим лекарствам» (multidrug resistance proteins — MRP). Оказывается, прогестерон плаценты тоже влияет на усвоение фолиевой кислоты трофобластом, в частности подавляет это усвоение.11.14. Прогестерон, тошнота и рвота беременных
В конце 60-х — начале 70-х годов во многих странах Европы и Северной Америки использовали прогестерон для лечения так называемой токсемии. Под токсемией врачи понимали то, что позже начали называть токсикозом, или гестозом, хотя вскоре эти термины исключили из акушерства. Во многих современных русскоязычных публикациях, даже научных, до сих пор используется понятие токсикоза. Под ранним токсикозом многие постсоветские женщины до сих пор понимают тошноту и рвоту беременных. «Ужасный токсикоз» стал неотъемлемой частью их беременностей. Во второй половине беременности понятием токсикоз прикрывались многие осложнения беременности, а также вполне нормальные явления, как, например, отеки и судороги ног. Прогестерон, 17-ОПГ или синтетические прогестероны обычно назначали во втором триместре (когда чаще всего появляется гипертония беременных, преэклампсия, изжога, нарушения со стороны работы кишечника, а не токсикоз) якобы с целью понижения токсемических явлений. Как ни странно, но большинство заграничных врачей не признавали токсикоз (токсемию), а называли этот диагноз «болезнью теорий», то есть вымышленным диагнозом, в чем и оказались правы. Тошнота и рвота встречается у 80–90 % беременных женщин, особенно в первом триместре, поэтому, если пользоваться «советской терминологией», чуть ли не все беременные женщины страдают токсикозом. В разделе, посвященном предменструальному синдрому, многие симптомы которого напоминают неприятные симптомы ранних сроков беременности, в том числе тошноту и рвоту, упоминалось, что появление таких симптомов связано с падением уровня лютеинового прогестерона после его пика в середине второй фазы цикла. Если у женщины возникает беременность, уровень прогестерона не понижается, потому что с началом имплантации плодного яйца поддерживается и выработка прогестерона желтым телом беременности, однако только на короткий период времени. Женщины, страдавшие до наступления беременности предменструальным синдромом, с задержкой менструации могут заметить, что все их предменструальные жалобы исчезли. Также упоминалось, что предменструальный синдром часто рассматривается как синдром отмены прогестерона. Помимо тошноты и рвоты, чуть ли не все женщины жалуются на боли внизу живота и пояснице, которые возникают обычно в 5–7 недель беременности, на увеличение груди и болезненность в ней (обычно с 6–7-й недели), раздражительность, беспокойство, плаксивость, бессонницу (и эти жалобы обычно достигают максимума в 8–10 недель). Но если перед менструацией наблюдается понижение прогестерона, то каким же образом можно объяснить все эти симптомы при беременности, когда прогестерон повышается? Разве можно связать состояние тошноты и рвоты с синдромом отмены, то есть «похмельем»? Давайте рассмотрим, что же на самом деле происходит в организме женщины в первом триместре беременности, то есть от начала зачатия ребенка до 14–16 недель. График, представленный ниже, показывает зависимость возникновения неприятных симптомов на ранних сроках беременности от уровней прогестерона и ХГЧ.
Практически никто из женщин не знает, что в организме беременной женщины вырабатывается два вида прогестерона, о чем подробно описано в начальных главах этой книги. Лютеиновый прогестерон вырабатывается желтым телом, а плацентарный — плацентой. Между этими двумя видами прогестерона нет различий в строении, однако существует разница в функции и воздействии на организм женщины. Лютеиновый прогестерон не является чужеродным для женщины, поэтому усваивается женским организмом, а плацентарный прогестерон является инородным гормоном, потому что плацента по генетическому строению является производным тех же клеток, что и плод. Для женщины такой вид прогестерона является экзогенным источником, исходящим из плаценты. Во всех учебниках и популярных публикациях вы найдете утверждение, что уровень прогестерона значительно повышается во время беременности (почти в 15 раз), но нигде не упоминается, что это рост плацентарного прогестерона, который практически не усваивается женским организмом, как и эстрогены, вырабатываемые плацентой, уровень которых повышается в 300–1000 раз. Если бы, то количество гормонов, которое вырабатывается хорионом и плацентой, усваивалось женским организмом, трудно даже представить, какое катастрофическое влияние они бы имели на женщину. Женщина просто умерла бы от этих супердоз гормонов. Но почему же она привыкает к таким высоким уровням и обычно со второго триместра беременности вплоть до родов чувствует себя лучше, чем в первые недели беременности, когда уровни гормонов не такие высокие? Потому что плацентарные гормоны имеют ограниченное влияние на органы-мишени (матку и молочные железы) и практически не усваиваются женским телом, то есть их выработка и обмен являются автономными. Считается, что уровень подъема ХГЧ приводит к появлению неприятных симптомов беременности, особенно тошноты и рвоты. С этим утверждением можно согласиться, тем более что при трофобластической болезни и многоплодной беременности, когда количество вырабатываемого ХГЧ больше, тошнота и рвота выражены сильнее. Итак, производство прогестерона желтым телом беременности начинает угасать с 5-й недели беременности, и обычно в этот период появляются первые признаки тошноты. Уровень плацентарного прогестерона начинает постепенно повышаться, и, казалось бы, суммарная доза прогестерона в крови женщины должна быть достаточной, то есть не низкой. Но, как я упоминала выше, плацентарный прогестерон является чужеродным для женского организма. Максимального пика тошнота и рвота достигают к 8-й неделе беременности, но уже после 10 недель состояние улучшается, а к 12 неделям у большинства женщин рвота прекращается, хотя тошнота может быть и дольше. Только у небольшого количества женщин тошнота и рвота могут наблюдаться до 20 недель, и у некоторых женщин до конца беременности, но чаще всего у таких женщин имеются заболевания желудочно-кишечного тракта (гастриты). Таким образом, не является ли тошнота и рвота реакцией организма на значительное понижение уровня лютеинового прогестерона, фактически тем же «похмельем» или «синдромом отмены»? И пока женский организм «не привыкнет» к плацентарному прогестерону, который является также экзогенным для тела женщины (как и таблетки, инъекции, кремы прогестерона при слишком низком уровне своего собственного прогестерона), и не начнет усваивать хотя бы в небольшом количестве этот «чужой» прогестерон, существует окно «отмены прогестерона». Оно может стать триггером для появления всех тех неприятных симптомов беременности, которые были упомянуты выше. Этот вопрос все еще требует изучения темы тошноты и рвоты беременных и анализа всех имеющихся данных. Возможно, падение уровня лютеинового прогестерона не имеет отношения к возникновению этих неприятных состояний беременности, а во всем действительно «виноват» ХГЧ или другое вещество, вырабатывающееся при беременности. Зная механизм возникновения тошноты и рвоты, врачи смогут помочь миллионам женщинам преодолеть этот период беременности без неприятных симптомов.
11.15. Прогестерон и послеродовая депрессия
Так как в предыдущей главе рассматривалась гипотеза гормональной отмены лютеинового прогестерона у женщин с тошнотой и рвотой, уместно вспомнить и послеродовый период. Многие женщины жалуются на «срыв нервов» после родов. Послеродовый блюз — это наиболее распространенное изменение настроения, встречающееся после родов, по разным данным — у 26–85 % женщин. Обычно это расстройство возникает в конце первой недели после родов и проявляется с 5-го по 12-й послеродовые дни нестабильностью настроения, плачем, раздражительностью, бессонницей, пониженным аппетитом, беспокойством. В большинстве случаев симптомы проходят без лечения, но у ряда женщин они могут привести к возникновению послеродовой депрессии. Послеродовая депрессия встречается у 10–20 % женщин. Часто послеродовая депрессия возникает на второй неделе послеродового периода. Казалось бы, при чем здесь послеродовый период и прогестерон? Если учесть, что девять месяцев беременности проходили на постоянно повышающемся уровне плацентарного прогестерона, который хоть и имел автономность обмена, но все же частично влиял на женщину, после родов уровень гормона катастрофически понижается. Плацента удалена, а значит, удален источник прогестерона, а собственные яичники все еще подавлены пролактином, который стимулирует лактацию. При регулярном грудном вскармливании большинство женщин находятся в состоянии менопаузы, и такая лактационная аменорея является отличной контрацепцией в первые шесть месяцев после родов. В первые недели послеродового периода прогестерон очень быстро распадается и выводится из организма — в считанные часы, но его метаболиты могут циркулировать в крови женщины дольше из-за их накопления жировой тканью, поэтому продолжать воздействовать на женский организм. Неудивительно, что такая резкая отмена прогестерона после его таких высоких уровней напоминает все тот же синдром отмены или «после прогестеронового похмелья» и провоцирует расстройства со стороны психики и эмоционального фона женщины. Интересен также факт, что даже с восстановлением менструальных циклов у ряда женщин в послеродовом периоде наблюдается прогестероновая недостаточность, в первую очередь из-за высоких уровней пролактина. Однако взгляд на возникновение послеродовых блюзов и депрессии, и понижение уровня прогестерона после родов требует более пристального внимания ученых и врачей. В некоторых публикациях есть упоминание, что прогестерон и прогестины успешно применяются для лечения послеродовой депрессии, что применение этого гормона понижает уровень депрессий почти с 70 % до 10 %. Однако такие утверждения оказались неточными. Наоборот, длительное применение прогестагенов приводит к ухудшению протекания депрессии (одним из побочных эффектов прогестерона и прогестинов является депрессия). Психиатры считают, что лечение послеродовой депрессии требует принятия более кардинальных мер и использования препаратов, которые характеризуются проверенным лечебным эффектом.11.16. Безопасность прогестерона при беременности
В связи с широким применением прогестерона возник вопрос о его безопасности при беременности, особенно на ранних сроках. В 1999 году Федеральная Администрация Лекарств (FDA) ввела групповое обозначение безопасности прогестерона и прогестинов при беременности, что применяется и в классификации других лекарственных препаратов. Микронизированный прогестерон вошел в категорию В. Это означает, что «репродуктивные исследования на животных не смогли показать риск для плода и адекватных хорошо контролируемых исследований на беременных женщинах не имеется; ИЛИ исследования на животных оказывают негативный эффект на плод, но адекватные и хорошо контролируемые исследования на беременных женщинах не смогли продемонстрировать риск для плода в любом триместре». Интересно, что в определении классов лекарств в отношении их безопасности для беременных женщин нет категоричных выражений «не показали, не обнаружены и т. д.», а используется выражением «failed tо demonstrate», что в дословном переводе с английского означает «провалились показать» (не удалось, не смогли). Другими словами, учитывается возможность того, что при других обстоятельствах, вероятно, связь была бы найдена. И в отношении прогестерона вред для плода существует, и он был доказан, и его доказывают в современных исследованиях. Необходимо учитывать, что американская, европейские и австралийская классификации лекарственной «вредности для беременности» являются относительными, и нередко один и тот же препарат может принадлежать к разным категориям (например, ацетоминофен, аспирин и другие). Но оказывается, что существует совершенно разный подход в оценке влияния прогестерона (и других лекарств) на плод. В классификации лекарств учитывается тератогенность препарата — вызывает ли он пороки развития у плода. Причем, очень часто внимание акцентируется на грубых пороках развития, то есть видимых на УЗИ и после рождения ребенка. Одновременно с развитием перинатологии, которая является относительно молодой отраслью акушерства, неонатологии и радиологии появилось очень много данных о малых пороках развития, которые могут проявить себя на поздних сроках развития беременности или в позднем детском и подростковом периодах. Неонатологов и педиатров времен высокого интереса к прогестерону в поисках сохраняющей терапии серьезно волновал вопрос безопасности назначения прогестерона беременным женщинам и как такое лечение влияет на развитие (во всех аспектах) ребенка. Такой же вопрос начали поднимать психиатры. Несмотря на то, что противников назначения прогестерона было очень много, были также и ярые сторонники, даже среди педиатров, которые публиковали «собственные наблюдения», фактически превознося прогестерон чуть ли не до уровня чудо-препарата, влияющего на развитие ребенка настолько положительно, что это якобы создает некую элитную группу детей — прогестероновых детей. Согласно этим «наблюдениям» дети, чьи матери принимали прогестерон, к тому же в очень высоких дозах, лучше развивались физически, умственно, быстрее начинали ходить и бегать, лучше учились в школе, получая лучшие оценки, и были более интеллигентными по сравнению с другими ровесниками, которым «не повезло» получить свою дозу прогестерона. «Интеллектуальное преимущество наблюдалось у детей, матери которых принимали прогестерон (в дозе 8 г) до 16 недель беременности». К счастью, таких ложных публикаций, основанных далеко не на принципах доказательной медицины, было очень мало и они не имели успеха среди большинства врачей мира. Очень немного известно о причине развития ряда опухолей плода и детей, в том числе злокачественных опухолей. Проблема также состоит в том, что, если у ребенка любого возраста обнаруживают какое-то серьезное заболевание, причина которого неизвестна или является результатом нарушения обмена веществ, очень редко у матери уточняется, как протекала беременность и какие лекарственные препараты она принимала. У постсоветских женщин сценарий один и тот же: была угроза срыва, лежала на сохранении, вводилась масса препаратов. А ведь помимо тератогенного эффекта, у многих лекарственных препаратов может быть токсический эффект. Токсичность препарата в отношении будущего ребенка может быть разной — зависит от срока беременности и на какие органы и ткани воздействует препарат. Токсичность не означает тератогенность, то есть она не вызывает пороки у плода непосредственно, но она может привести к гибели эмбриона или плода, нарушению его развития (в росте, например) и обмена веществ и развитию заболевания (например, появление врожденного зоба у плодов, матери которых принимали гормоны щитовидной железы). Таким образом, лекарственный препарат может быть эмбриотоксичным (поражать эмбрион), фетотоксичным (поражать плод) и органотоксичным (гепатотоксичным при поражении печени плода). Токсическое действие прогестерона основано на его биологической активности и фармакокинетике (доза, скорость усвоения, обмен, выведение из организма и т. д.).11.16.1. Опыт прошлого
В 70-х годах в США женщинами в первом триместре беременности широко использовался синтетический прогестерон. В 80-х и 90-х годах советские женщины начали «увлекаться» туриналом (аллилэстренол), производимым в Венгрии. Неожиданно появились данные, что синтетический прогестерон может вызывать появление небольших (малых) пороков развития у плода, особенно половых органов девочек и мальчиков (кстати, такие пороки были зарегистрированы и в СССР после приема туринала, но данные проигнорировали). Федеральная лекарственная администрация США (FDA) запретила использование прогестерона у беременных женщин в первом триместре, а в инструкции по применению препарата появилось утверждение «прием прогестерона противопоказан при беременности сроком до 4 месяцев, так как он может вызвать малые пороки развития плода». И дальше шло детальное описание всех видов пороков, которые были зарегистрированы в тех случаях, когда женщины использовали прогестерон в первом триместре. Европейские врачи тоже не остались в стороне и провели исследование безопасности туринала и ему подобных препаратов. Туринал по воздействию намного сильнее обыкновенного человеческого прогестерона. В некоторых странах туринал перестали рекомендовать для применения у беременных женщин и даже запретили его продажу. Венгерские врачи пробовали «отстоять» свой отечественный препарат, доказывая в своих клинических исследованиях, что этот синтетический гормональный препарат безопасен для беременности. Данные современных исследований опять напомнили о взаимосвязи между приемом прогестерона и возникновением гипоспадии у мальчиков, которая была обнаружена давно, но ее отрицали многие врачи в течение последних 20–30 лет. Оказалось, что в группе женщин, принимавших прогестины, которые входят в состав гормональных контрацептивов, уровень гипоспадий у новорожденных мальчиков выше по сравнению с популяционными уровнями. Также обсуждались уровни дефектов неба (заячья губа и другие) после приема прогестерона со второй половины беременности. В постсоветских государствах диагноз гипоспадии у новорожденных мальчиков стал настолько частым, что возник закономерный вопрос: это дань моде, проявление врачебной ошибки или последствия злоупотребления прогестероном, особенно синтетическими его формами, которые принимает чуть ли не каждая беременная женщина Украины, России и других постсоветских государств? Женщины и врачи должны серьезно задуматься над этим вопросом.11.16.2. Прогестерон и пороки развития
Степень опасности или безопасности лекарственного препарата по отношению к плоду определяется с помощью исследований — сначала на животных, потом на людях. Клинические исследования на беременных женщинах с применением новых или старых лекарственных веществ по определению их безопасности чрезвычайно ограничены, и на современном этапе акушерства таких исследований все меньше и меньше. В отношении прогестерона имеются волны подъема и падения интереса, как и совершенно разные направления поиска. После второй мировой войны тщательно изучалась роль прогестерона, но в большинстве исследований на животных моделях. У разных видов животных удалялись яичники, вводился дополнительно прогестерон и определялся исход беременностей. Интересовали ученых также и контрацептивные свойства прогестерона, поэтому его часто применяли в гинекологии, нередко для создания искусственной менопаузы (ложной беременности). Развитие репродуктивных технологий повлекло за собой повышение интереса к прогестерону, и его снова начали применять в акушерстве. Все эти волны противоречий не отражались на постсоветской медицине — прогестерон назначается всем подряд женщинам просто «на всякий случай», и это условно называется «профилактика или лечение угрозы прерывания беременности» до сих пор. Вопрос безопасности даже не затрагивается: уже два поколения людей «выращено» на прогестероне, и у многих здоровые нормальные дети. А есть ли взаимосвязь между теми многочисленными потерянными беременностями, рожденными нездоровыми детьми и приемом прогестерона? Если врачи постсоветского пространства утверждают, что сейчас здоровых беременностей нет, как и нет здоровых новорожденных, не связаны ли такие отклонения в здоровье с постоянным приемом прогестерона? Исследования в этом направлении никогда не проводились. То, что прогестерон может повлиять на развитие эмбриона, ученые и врачи знали давно. Хотя пороки развития, вызываемые прогестероном, встречаются очень редко, все же исследования последних лет подтверждают данные 30–40-летней давности, когда прогестерон пробовали использовать для повышения уровня фертильности и «сохранения беременности», не зная еще механизма его воздействия на женский организм. В те времена доказательная медицина была все еще на начальных этапах развития, поэтому были упущены многие важные моменты в анализе полученных данных, как, впрочем, и в проведении исследований. Большинством врачей эти данные были приняты всерьез, но они практически не дошли до врачей постсоветского пространства, где «сохранять беременности» начали с применения туринала. Этот препарат никогда не проходил серьезных клинических испытаний, тем не менее, он широко применялся советскими врачами в течение 10–15 лет, фактически до распада СССР, когда венгерские препараты пополняли советские аптеки без всякого контроля. Позже на рынке России, Украины и бывших стран социалистического лагеря появились отечественный и импортированный прогестерон и немало его синтетических форм. В 1994 году Др. Эллен Грант, серьезный противник назначения крема прогестерона без строгих показаний и оппонент Др. Джона Ли, рекламирующего этот крем повсеместно, в своих публикациях приводила данные клинических исследований на животных, о которых практически забыли в наше время. Др. Джина Шентал, проводившая такие же исследования, утверждала в своих трудах, что у животных назначение прогестерона негативно влияет на развитие эмбрионов. Современные исследования тоже подтверждают этот факт. Др. Грант, фактически тридцать лет тому назад, утверждала, что прогестерон и прогестины влияют на клетки эндометрия, кровеносных сосудов и энзимы, что также подтверждено многими научными исследованиями в наше время. Поэтому два распространенных побочных эффекта приема прогестерона — это головная боль и изменение настроения, раздражительность. Во второй фазе, особенно на пике уровня прогестерона, многие женщины жалуются на головные боли, общую слабость, а также на плаксивость, раздражительность, эмоциональность, частое изменение настроения, что длится вплоть до появления менструации. В современных исследованиях прогестерона внимание акцентируется на изучении его действия на клеточном и молекулярном уровне, однако безопасность применения прогестерона у разных категорий населения все еще требует проведения не одного серьезного исследования.11.16.3. Исследования на животных
Все исследования на животных по изучению влияния прогестерона начали проводиться с момента использования прогестерона и прогестинов в лечебных целях и проходили в пяти направлениях: • Исход беременности • Изменения гениталий плода по женскому типу • Изменения гениталий плода по мужскому типу • Нарушения развития репродуктивной системы • Нарушение сексуального поведения Первые исследования по изучению влияния прогестерона и прогестинов на беременных самках животных проводились в 40-х годах, а возможно, и раньше, однако большинство результатов таких исследований остались неопубликованными. В 1939 году впервые была опубликована статья об увеличении клитора у тех самок животных, которым вводили прогестерон. Большинство последовавших за этим опытов на животных моделях было проведено не по правилам доказательной медицины, чаще в виде примитивно организованных экспериментов, но в те далекие времена все научно-клинические исследования проводились вообще без каких-либо правил. У каждого исследователя была своя точка зрения, а поэтому свои правила. Из-за нехватки четкой организации проведения исследований на животных, полученные результаты воспринимались и до сих пор воспринимаются практическими врачами с некоторым равнодушием и недоверием. В течение длительного периода времени такие результаты вообще были недоступны большинству врачей и людям, интересующимся вопросами безопасности прогестерона. Тем не менее, благодаря интернету и переводу многих архивных документов крупных библиотек в электронные виды хранения информации сейчас многие данные исследований прошлого столетия стали доступны практически всем людям.11.16.3.1. Прогестерон и продолжительность беременности у животных
Поиск «сохраняющей терапии» прошел через определение влияния прогестерона на продолжительность беременности у ряда животных. Недостатком исследований было то, что применялись разные формы прогестерона, в том числе синтетические, а также в разные периоды беременности на разных животных. Как известно, прогестерон влияет на сократительную функцию матки не только женщин, но и животных. Так как перед родами уровень эндогенного прогестерона понижается, ученых интересовал вопрос, может ли повлиять экзогенный прогестерон на поздних сроках беременности на ее продолжительность, лактацию и поведение животных. Оказалось, что продолжительность беременности зависела от дозы вводимого прогестерона — маленькие дозы беременность не нарушали ее, большие же имели негативный исход. Исследование прогестерона со второй половины беременности было изучено на овцах. Продолжительность беременности возросла, как и увеличилась выработка молока, однако значительно увеличилось количество мертворожденных ягнят. Эксперимент с обезьянами был небольшим в силу дороговизны животных — в нем использовались только 6 самок, которым вводился прогестерон, но контрольной группы не было. Изменений в продолжительности беременности и весе новорожденных не нашли. У морских свинок прогестерон серьезных отклонений в весе потомства и продолжительности беременности не вызывал, но влияние прогестерона на плоды не изучалось.11.16.3.2. Прогестерон и выживаемость эмбрионов и плодов животных
Чрезвычайно малое количество исследований было посвящено прямому влиянию прогестерона на жизнедеятельность эмбрионов и плодов. Данных о влиянии прогестерона на ранних сроках беременности почти нет. Использование гормона у пони до имплантации после ЭКО в течение 6 дней негативного эффекта не показало. Также не обнаружили отрицательного эффекта прогестерона на бластоциты кроликов и крыс, если гормон применялся до имплантации. Однако использование гормона у животных в период спаривания, когда происходило зачатие, значительно повышало уровень гибели четырехдневных эмбрионов у кроликов. Интересное исследование было проведено на мышах в 1964 году, изучалась «концептуальная смертность», то есть уровень гибели эмбрионов и плодов. Одним мышам вводили прогестерон в виде подкожных инъекций, а другим в плодовый мешок. Оказалось, что, когда прогестерон вводили под кожу самок, гибель плодов наблюдалась в 65 % случаев, а когда в амниотический мешок, погибало 61 % плодов. У контрольной группы мышей уровень гибели был 2 %. Ученые предположили, что прогестерон является токсичным для плодов мышей, скорее всего, из-за выраженного наркотического влияния на центральную нервную систему, так как видимых дефектов эмбрионов не было обнаружено. Введение прогестерона мышатам через 16 часов после их рождения приводило к высокому уровню их гибели из-за негативного влияния на ЦНС. Тератогенный эффект прогестерона на животных был проверен только в одном исследовании, когда гормон вводили беременным самкам в период закладки органов. Оказалось, что прогестерон не влияет на закладку органов, но приводит к высокому уровню абортов и гибели крыс, что вынудило прекратить это исследование для оценки риска гормонального лечения. Последующие исследования свиней показали, что прогестерон негативно влияет на выживаемость эмбрионов и плодов, уменьшая продолжительность беременности и вместительность матки, ускоряя рост плодов. Также, применение прогестерона до зачатия и в период имплантации зачатка понижало уровень беременностей у свиней. Несколько публикаций о влиянии прогестерона на беременность и плоды животных, в основном крыс и кроликов, были опубликованы еще в 1968 году. Однако в критерии оценки родившегося потомства не входило описание пороков развития внутренних органов и скелета, хотя были проведены измерения аногенитального расстояния. Эти исследования все же показали значительный токсический эффект на потомство крыс, в том числе повышенный уровень внутриутробной гибели плодов. Также у кроликов и крыс, которым вводили прогестерон, в потомстве наблюдалось почти в два раза больше самцов, чем самок, и у обоих полов аногенитальное расстояние было больше по сравнению с контрольной группой. «Смертельная доза» прогестерона для всех плодов была 20 мг/кг. Чем больше была доза прогестерона, тем больше изменений в развитии животных находили. Доза в 5 мг/кг у животных соответствовала дозе в 350–400 мг/сутки у людей.11.16.3.3. Прогестерон и нарушения развития самок
После публикации данных о вирилизации наружных половых органов у новорожденных девочек в этом направления было проведено несколько исследований (более 10) на разных животных. Под вирилизацией, или маскулинизацией, понимают появление вторичных половых признаков по мужскому типу (повышенная волосатость, увеличение мышечной массы тела, изменения наружных половых органов и др.). Понятие вирилизации чаще употребляется в характеристике изменений у мужчин. Для определения уровня маскулинизации у самок измерялось аногенитальное расстояние. Все ранние исследования подтвердили вирилизующий эффект нортестостерона, а также прогестерона в тех случаях, где он применялся, за исключением небольших по объему исследований. Также в некоторых исследованиях были отмечены изменения гениталий у самок во время лечения прогестероном (увеличение клитора). Исследование 1977 года, в котором изучалось влияние 12 разных препаратов прогестерона и прогестинов, показало, что нортестостерон, тестостерон и два производных прогестерона — медроксипрогестерон и мегестрол, вызывают изменения в строении гениталий животных. Опыты, в которых исследовалось влияние мегадоз прогестерона и контрацептивов на развитие плодов у 10 обезьян, привело к высокому уровню гибели потомства, поэтому данные оказались неинформативными. В начале нового тысячелетия японскими учеными снова был проведен ряд экспериментов на животных, но данные этих исследований представлены очень скудно, всего несколькими предложениями, в которых говорится, что вирилизирующего эффекта не наблюдалось.11.16.3.4. Прогестерон и гипоспадия у животных моделей
К сожалению, животных моделей, на которых можно проследить возникновение гипоспадии (анатомического дефекта мужского полового органа) у самцов, очень мало и не все они могут использоваться в исследованиях. Если у самок признаки вирилизации можно обнаружить осмотром и измерением определенных анатомических структур, у самцов аногенитальное расстояние может быть разным. Обычно о нарушениях репродуктивной системы судят по осмотру взрослых самцов после полового созревания. Во многих исследованиях наряду с изучением влияния прогестерона и прогестинов на генитальные органы самок также изучали изменения аногенитального расстоянии у самцов. Гипоспадия у самцов и укороченное аногенитальное расстояние считается частью синдрома нарушения дифференциации половых органов и нередко в научной литературе называется понятием «феминизация». Исследований на тему влияния прогестерона было много, но не все результаты были опубликованы. Список исследований в хронологическом порядке следующий: • 1960 год — эксперименты показали уменьшение аногенитального расстояния у плодов-самцов крыс после введения прогестерона их матерям, однако данные не были статистически обработаны, поэтому степень поражения плодов осталась неизвестной. • 1961 год — у самцов крыс после применения прогестерона их матерями провели измерение аногенитального расстояния, но данные получили пестрые, без статистической обработки, что затрудняет их интерпретацию. • 1964 год — введение высоких доз прогестерона беременным самкам мышей привело к появлению гипоспадии у 3 % родившихся самцов, когда в контрольной группе таких отклонений не было. Все плоды самцов, матери которых получили хлорированные прогестагены, имели гипоспадии (100 %). Но в проведении этого исследования было обнаружено несколько погрешностей, особенно в сборе и предоставлении данных, что вызвало среди врачей немало сомнений об их достоверности. • 1964 год — у самцов морских свинок отклонений в репродуктивных органах не обнаружено, но описание наружных половых органов отсутствует. В том же году была публикация об осмотре гениталий трех самцов обезьян — отклонений не выявили. • 1968 год — у плодов-самцов кроликов было обнаружено увеличение аногенитального расстояния после введения прогестерона их матерям в период эмбриогенеза. • 1984 год — проведено исследование на овцах. Самцам вдвухнедельном возрасте вводились имплантаты с прогестероном до 4–12- недельного возраста. Уровень прогестерона в плазме крови был в 4 раза выше при использовании имплантатов. Это привело к понижению уровня тестостерона, особенно при использовании гормона до 12 недель, а также уменьшению размеров яичек. • 1987 год — отклонений аногенитального расстояния у мышей-самцов не обнаружено. • 1987 год — изучено влияние прогестерона на функцию половых органов у самцов, подвергшихся воздействию прогестерона внутриутробно. В плазме плодов-самцов было обнаружено значительное понижение тестостерона и повышение ЛГ, что не оказало влияния на развитие мужских половых органов. Однако их сексуальное поведение в период размножения было изменено. Только половина «прогестероновых» самцов смогла иметь успешное совокупление с самками. Осмотр внутренних половых органов у этих самцов, в том числе яичек, не показал отклонений. • 2004 год — было проведено небольшое исследование, в котором капсулы прогестерона имплантировались под кожу самкам во время беременности. У троих рожденных самцов обнаружена гипоспадия и ни одного нарушения в контрольной группе. Статистический анализ данных не проводился, а также были обнаружены неточности в описании проведения исследования, поэтому эти данные не были опубликованы. Это далеко не все исследования на тему гипоспадии у животных и влияния прогестерона на мужскую половую систему. Некоторые эксперименты проводились на детенышах животных. Многоразовое введение прогестерона детенышам крыс после их рождения приводит к изменениям в яичках.11.16.3.5. Прогестерон и поведение животных
Ряд исследователей параллельно изучали поведение новорожденных животных, матерям которых вводили прогестерон во время беременности. В одном из экспериментов все родившееся потомство «прогестероновых» мышей было принято и выкармливалось самками, не принимавшими прогестерон (из контрольной группы). Негативного влияния прогестерона на плодовитость, продолжительность беременности и исход беременности у «прогестеронового потомства» не наблюдалось. Однако у 80 % этих мышей наблюдалась агрессия по сравнению с «непрогестероновой» группой, и уровень агрессии был в два раза выше. В исследовании 1981 года крысам, которые кормили свое потомство грудным молоком, с первого по 28-й день послеродового периода вводили инъекции прогестерона. У крысят обнаружили значительное повышение прогестерона в крови по сравнению с контрольной группой. Такое повышение гормона не вызвало изменений в яичниках молодых самок, но наблюдались небольшие изменения в их поведении. Поведение у самцов отличалось значительно. Еще одно исследование проводилось в 1981 году, когда изучалось влияние прогестерона в послеродовом периоде у кормящих матерей-самок на поведение их потомства. Самкам в течение 28 дней послеродового периода вводили гормон, что повысило уровень прогестерона у детенышей крыс как мужского, так и женского пола. О поведении матерей на фоне приема прогестерона ничего неизвестно. Потомство самцов кастрировали и изучали их сексуальное поведение под влиянием инъекций тестостерона или эстрадиола. В «прогестероновой» группе уровень поведения по мужскому типу (поведение самца) был слабее, независимо от того, вводился им тестостерон или эстрадиол. Чрезвычайно маленькое количество самцов в этой группе вступало в половые отношения. В большинстве исследований, изучавших влияние прогестерона на лактацию и поведение самок, проводившихся до конца 80-х годов, у животных после рождения потомства были удалены яичники и матка для устранения влияния эндогенного прогестерона. Более ранние исследования показали, что прогестерон блокирует поведение самок крыс после родов, подавляя их активность из-за угнетения эстрогеном гипоталамуса. Такое угнетающее действие прогестерона наблюдалось у разных видов грызунов. Оказалось, что назначение прогестерона новорожденным самкам мышей повышает риск образования опухолей молочных железы, причем значительно. Назначение прогестерона также привело к нарушению зрелости влагалища, к изменениям в яичниках по типу разрастания тканей яичников. Возникновение этих отклонений зависит от возраста потомства и дозы прогестерона. В исследовании 1973 года новорожденным самцам крыс вводился прогестерон на третий день после рождения, и после достижения ими половой зрелости проводилось наблюдение за их сексуальным поведением (на 110-й день жизни). В «прогестероновой» группе количество половых совокуплений и эякуляции было значительно ниже контрольной группы. Исследования 1998 года подтвердили влияние прогестерона на сексуальное поведение самцов, а также обнаружили в зоне мозга, отвечающей за это поведение, выраженную активность прогестроновых рецепторов.11.16.4. Клинические исследования на беременных женщинах
В доказательной медицине и клинической эпидемиологии существует понятие «оценка качества» (quality assessment) клинического исследования, которое включает анализ качества проведения исследования, сбора данных, интерпретацию и анализ полученных результатов, в том числе статистический анализ достоверности и точности данных. Изучение многих вопросов беременности сопряжено с большими погрешностями в проведении клинических исследований, что связано в первую очередь со спецификой женского состояния, эмоциями и чувствами, через которые проходят женщины при возникновении осложнений беременности. Психоэмоциональный фактор как со стороны женщин-участников исследований, так и со стороны врачей-исследователей накладывает негативный отпечаток на качество клинического исследования и приводит к появлению погрешностей на разных уровнях исследований. Итак, последние данные по изучению влияния прогестерона на эмбрионы животных серьезно настораживают. А что говорят клинические исследования в отношении безопасности прогестерона для человеческих эмбрионов? Все ранее проведенные исследования по применению прогестерона были направлены на доказательство его эффективности или неэффективности для ряда состояний беременности, в первую очередь для сохранения беременности. И все эти исследования, за исключением небольших единичных, проведенных не по правилам, показали, что прогестерон неэффективен для лечения «угроз выкидышей». Прием прогестерона не повышает частоту зачатий и не улучшает исход беременности у здоровых женщин. У женщин, страдающих рядом проблем, понижающих их фертильность, назначение прогестерона без устранения факторов, приводящих к бесплодию или невынашиванию, тоже ситуацию не меняет. Однако при изучении эффективности лекарства безопасность препаратов оставалась вне внимания ученых. В некоторых исследованиях, хотя и учитывался уровень потерь беременностей после назначения прогестерона и без него в контрольных группах, упускались другие важные факторы, которые могли быть причастны к прерыванию беременности. Безопасность прогестерона на более поздних сроках беременности для предупреждения преждевременных родов также изучена не до конца, вызывает немало противоречий среди врачей и требует проведения большего количества клинических исследований.11.16.4.1. Пороки развития у девочек и мальчиков
В 1975–1985 годах были опубликованы результаты шести исследований, в которых пытались обнаружить риск развития пороков у плодов при применении прогестерона. Однако если к ним предъявлять требования современной доказательной медицины, все эти исследования следует считать неправильными и поэтому их данные нельзя считать достоверными. Из этих шести работ в трех изучали влияние гормона перспективно, однако информация о виде прогестерона или прогестина, который использовался беременными женщинами, как и дозы, продолжительность и режим приема, не были указаны. Две другие работы были ретроспективными, то есть анализ историй болезни (беременностей), но они не содержали контрольных групп, поэтому результаты не сравнивались. Еще одно исследование тоже было ретроспективным, но в нем изучалось влияние прогестинов. Все эти шесть исследований не выявили взаимосвязи между прогестероном и пороками развития плода, но все они были проведены неадекватно и их данные были недостоверными. Был еще ряд исследований, посвященных тому, как влияют гормоны, принимаемые беременной женщиной, на возникновение врожденных пороков развития, но прогестерон и прогестины в них не изучались. Но с 1985 года в медицинской литературе начали появляться и другие публикации — отчеты об обнаружении пороков развития у новорожденных, матери которых принимали прогестерон или 17α-гидроксипрогестерон, причем группы женщин были небольшие и большие (90–800 человек), но относительно числа женщин количество пороков тоже было не низким. Такие публикации были и раньше, но они не принимались во внимание большинством врачей и ученых в течение почти 15–20 лет. Чаще всего речь шла о возникновении гипоспадий, вирилизации новорожденных девочек и пороков развития сердечно-сосудистой системы.11.16.4.2. Прогестерон и гипоспадия у мальчиков
Гипоспадия — это анатомический порок развития мужского полового члена, когда отверстие мочеиспускательного канала (уретры) находится не по центру головки пениса, а в другом, не нормальном месте. В ряде случаев такой дефект затрудняет мочеиспускание. Гипоспадия встречается чаще всего среди белой расы людей, у 0.3–0.8 % мужчин. Критический период образования гипоспадий — это 8–16 недель, когда происходит закрытие уретральной складки. В последнее десятилетие высокие уровни гипоспадии начали наблюдаться среди новорожденных мальчиков России, Украины, и других постсоветских стран, хотя во многих случаях диагноз выставлен ошибочно. Тот факт, что диагноз гипоспадии звучит в постсоветских лечебных учреждениях чрезвычайно часто, настораживает, потому что известно, что почти каждая женщина бывших республик СССР принимает прогестерон с ранних сроков беременности нередко весьма продолжительный период времени. Хотя в список факторов риска по возникновению гипоспадии входят генетические факторы (генные мутации и полиморфизм), задержка развития плода, недоношенность, лечение бесплодия, старший материнский возраст, — все же не исключается возникновение этого порока развития под влиянием ряда веществ. Первая публикация о гипоспадии была напечатана в 1961 году — 4 случая гипоспадии среди 76 новорожденных, матери которых принимали по 1000 мг прогестерона или 200 мг ацетоксипрогестрона в сутки с целью предупреждения аборта. Поначалу результаты наблюдений Др. Куппермана во внимание не были приняты — прошло почти 20 лет, когда на эту тему было проведено несколько десятков новых исследований. Одни из них обнаружили взаимосвязь между прогестероном и гипоспадиями у мальчиков, другие — нет. Большинство из этих исследований были ретроспективными, то есть рассматривали случаи гипоспадий в прошлом. Многие исследования как раз не подтвердили генетический фактор риска развития гипоспадии, как и низкий вес новорожденного и задержку роста плода, курение и лечение бесплодия у родителей. Еще в целом ряде работ были получены противоречивые, слишком путанные данные, которые ясности в вопрос не вносили, но делали из гипоспадии «странное состояние». Самой большой ошибкой в проведении этих исследований было отсутствие четкого определения фармакологического препарата, который принимали женщины. По одним данным, такой препарат назывался «прогестином» (а какой именно?), «половым гормоном» (а какой именно?), «гормональной поддержкой матери» (а чем именно?). Те исследования, которые можно было включить в мета-анализ (они были проведены с наименьшими погрешностями), не показали связи между возникновением гипоспадии и приемом синтетических форм прогестерона. Из всех исследований в отношении гипоспадии только в двух использовали прогестерон во время беременности. Несмотря на горячие споры по поводу взаимосвязи межу прогестероном и гипоспадиями, ряд ученых провели исследования по изучению случаев гипоспадий после ЭКО, где для поддержки беременности использовали прогестерон. Оказалось, что уровень гипоспадий повышен в 5 раз. Еще одно крупное международное исследование, которое поводилось в восьми странах мира в 90-х годах, обнаружило зависимость между прогестероном, который принимали матери до и во время беременности (до 14 недель), и гипоспадиями, и риск возникновения гипоспадий был повышен в 2–4 раза. Риск был повышен и для прогестинов, которые назначались с целью лечения бесплодия и вынашивания беременности, но не как противозачаточные средства.11.16.4.3. Прогестерон и врожденные синдромы нарушения развития половых органов у девочек
Как уже упоминалось выше, под вирилизацией, или маскулинизацией, понимают появление мужских черт у женщин, что обычно является проявлением влияния мужских половых гормонов. Такое определение вирилизации касается только подростков и взрослых женщин. У новорожденных девочек признаки вирилизации могут выражаться через врожденный вирильный синдром, но чаще всего изменениями наружных половых органов — увеличенным клитором, или клиторомегалией. Другой синдром, который сопровождается вирилизацией, — это синдром врожденной гиперплазии коры надпочечников (врожденная гиперандрогения надпочечников, андрогенитальный синдром). Первые публикации об адреногенитальном синдроме появились в литературе в 50-х годах буквально с началом применения нортестостерона — синтетического прогестагена. В 60-х годах появились зарегистрированные случаи вирилизации новорожденных девочек без возникновения адреногенитального синдрома, матери которых принимали другие виды синтетического прогестерона. В 1957 году был зарегистрирован первый случай клиторомегалии и сросшихся половых губ (синехии) у новорожденной девочки, мать которой до этого имела двух здоровых детей, но во время беременности в 12 недель ей были введены три инъекции прогестерона из-за незначительных кровянистых выделений. Помимо прекращения кровотечения у матери после введения прогестерона повысилось либидо, усилился рост волос на подбородке и груди. Второй случай клиторомегалии был обнаружен у трехлетней девочки, что заметили сразу после рождения ребенка, но не обратили особого внимания. Мать этой девочки имела два выкидыша до рождения дочери и проходила лечение синтетическим прогестероном в первые недели беременности: сначала по 10 мг в сутки, а чуть позже по 20 мг каждые 8 часов в виде оральных препаратов. Женщина прекратила прием прогестерона за две недели до нормальных родов. В 1958 году был зарегистрированный третий случай клиторомегалии у новорожденной девочки. Это была восьмая беременность для женщины, которая имела двух здоровых детей и пять выкидышей на ранних сроках. Поэтому для сохранения этой беременности в начале второго триместра было назначено 120 мг прогестерона ежедневно, и к 34 неделям женщина принимала уже по 320 мг гормона. На этом сроке произошли преждевременные роды. Никаких отклонений, кроме клиторомегалии, у девочки не обнаружили. К счастью, размеры клитора уменьшились и пришли в норму к 2 годам жизни ребенка. Количество зарегистрированных случаев вирилизации у девочек достигло более 400 за весьма короткий период употребления прогестинов и прогестерона в практике врачей (около 6–7 лет), что привело к прекращению назначения ряда препаратов беременным женщинам. Во всех зарегистрированных случаях у новорожденных отклонений на хромосомном уровне не было (кариотип был нормальным). В 1972 году были описаны еще 5 случаев повышенной вирилизации, но уже у мальчиков, матери которых принимали от 100 до 300 мг прогестерона в неделю на сроке 2–9 недель беременности. После рождения у этих мальчиков обнаружили увеличение пениса и мошонки с яичками, которые пришли в норму на третьем году жизни детей. У троих новорожденных на лобке были волосы, мышечная ткань развита больше. В течение года в поведении мальчиков была отмечена агрессивность и повышенная подвижность с меньшей продолжительностью сна. Такие многочисленные случаи вирилизации привели к проведению нескольких исследований на животных моделях и клинических исследований на беременных женщинах. Интересными оказались результаты, которые выявили большую связь между вирилизацией девочек и приемом прогестерона, а не прогестинов. Обмен информацией между врачами не был таким быстрым, как в наше время, потому что не было компьютеров и интернета. Многие врачи не знали о зарегистрированных случаях вирилизации и продолжали назначать прогестерон и синтетические прогестины вплоть до начала 90-х годов. Несмотря на большое количество публикаций с описанием случаев вирилизации и других отклонений, клинических исследований, которые бы отвечали требованиям современной доказательной медицины, проведено было мало. Последний обзор и мета-анализ 30 клинических исследований по применению прогестагенов до 20 недель беременности, проведенный Кокрановской библиотекой в 2004 году, связи между прогестероновыми препаратами и пороками развития не обнаружил, хотя небольшое повышение риска все же наблюдалось. Другими словами, интерпретация заключения такого анализа публикаций оказалась нечеткой. Анализ также показал, что в четырех крупных исследованиях по применению прогестерона после ЭКО ни один из режимов приема гормона (короткий — 2 недели или длительный — до 12 недель), как и дозы препаратов, — исход беременности не улучшали. Уровни потерь на ранних сроках, количество родов, продолжительность беременностей и вес новорожденных были одинаковыми для всех групп. Ряд других исследований, которые не вошли в этот обзор и мета-анализ, тоже подтвердили отсутствие разницы в исходе беременности после ЭКО и использования разных режимов прогестероновой терапии. Но снова в 2005 году были опубликованы новые данные о детях после ЭКО — у девочек наблюдалось преждевременное половое созревание.11.16.4.4. Прогестерон и пороки сердечно-сосудистой системы
Помимо пороков развития со стороны половых органов, прием прогестерона с целью лечения угрожающего аборта ассоциируется с пороками развития органов сердечно-сосудистой системы и пищевода, что было обнаружено в ранних работах на заре приема гормона и подтверждено в более поздних публикациях. Прием прогестерона на ранних сроках беременности связан с развитием таких пороков как синдром гипопластического левого сердца, дефект перимембранной желудочковой перегородки, других пороков развития перегородок сердца, а также с атрезией пищевода. Эзофагеальная атрезия наблюдалась при приеме матерями любых половых гормонов, но наибольшая частота случаев была при использовании прогестерона. В ранних исследованиях была найдена связь между прогестероном и некоторыми пороками развития центральной нервной системы, дефектами конечностей и неба, но современные исследования ее не подтвердили. Интересными оказались данные о том, что женщины, независимо от возраста и других демографических показателей, принимавшие прогестерон для лечения бесплодия, прерывали курс гормона чаще (в половине случаев) на ранних сроках, чем те, которые использовали прогестерон как «сохраняющую терапию» — от гормональной терапии отказывалось около трети женщин. Уровни пороков развития сердца и атрезии пищевода были намного выше среди женщин, принимавших прогестерон для лечения угрожающего аборта, и практически отсутствовали в группе женщин, лечившихся от бесплодия (поддержка второй фазы после стимуляции овуляции). Несколько исследований показало, что большинство женщин не знают, что они принимают, то есть не понимают различия между синтетическими и биоидентичными формами прогестерона, а также другими видами половых гормонов. Когда исследователи изучали связь между приемом прогестерона и возникновением пороков развития у плодов, определение вида и формы лекарственного препарата было самым трудным этапом ретроспективного анализа. Многие женщины не могли назвать название препарата, а также уточнить дозу и продолжительность приема гормона. Они считали, что они принимают «прогестерон». К сведению, многие женщины не знают, что дюфастон не является биоидентичным прогестероном, а принадлежит к группе синтетических форм гормона — прогестинам. Исследования также показали, что кровянистые выделения на ранних сроках беременности чаще встречаются у женщин с пораженным каким-то дефектом плодом (почти в два раза чаще). Фактически матка пытается выбросить дефектное зачатие. Ошибочно врачи ставят в таких случаях диагноз угрожающего выкидыша и назначают прогестерон с целью «сохранения беременности». Это, с одной стороны. С другой стороны, мета-анализ 8 когортных исследований показал, что в 13 из 14 случаев рождения детей с врожденными пороками развития матерям назначали прогестерон, когда в первые недели беременности (в период, критический для закладки и формирования органов) у них появились кровянистые выделения. Поэтому такое негативное влияние на органогенез прогестерона тоже не исключается. Для одних читателей приведенные выше данные разных по объемам и дизайну клинических исследований и экспериментов на животных, а также анализ случаев пороков развития у людей, матери которых принимали прогестерон и прогестины, могут показаться важными и серьезными аргументами, вынуждающими задуматься над тем, насколько безопасно применение прогестерона. Другие читатели могут посчитать эти данные неубедительными, противоречивыми, неточными. Точно такая же реакция возникает и у многих врачей: одни открывают глаза, другие, наоборот, закрывают на один важный факт — безопасность прогестерона для беременности, в частности эмбриона и плода, до сих пор не доказана. И если имеется столько публикаций, где безопасность прогестерона и прогестинов подвергается сомнению, где получены тревожные данные о негативном влиянии гормона на животных моделях, рациональным решением будет все же воздержание от его использования, особенно без строгих показаний.12. ПРОГЕСТЕРОН И МЕНОПАУЗА
К середине средней продолжительности жизни (35 лет) у женщин появляются многочисленные физические и психологические проблемы, связанные с нарушением баланса эстрогенов и прогестерона, которые будут доминировать вплоть до наступления менопаузы. Фактически вторая половина жизни большинства женщин сопровождается понижением функции яичников из-за их старения, а поэтому постепенным понижением уровней половых гормонов и прогестерона. Процесс старения репродуктивной системы имеет свои фазы и обычно ускоряется после 35–37 лет. Вопрос старения женского организма и возникновения менопаузы стал чрезвычайно актуальным из-за того, что многие женщины откладывают процесс зачатия и рождения детей на старший возраст, когда функция яичников угасает, а тело готовится к менопаузе. Во многих странах средний возраст первородящих женщин составляет 30–34 года, а средний возраст женщин, обратившихся за помощью вспомогательных репродуктивных технологий — 39–40 лет. Перименопаузой или предклимаксом называют период между 45 и 54 годами, когда наблюдаются перепады гормональных уровней, частые периоды эстрогенной недостаточности (природной или возрастной), резко понижается фертильность женщины. Менопауза — это фактически момент прекращения менструальных кровотечений, а постменопауза — это период отсутствия менструаций после их прекращения (после менопаузы). Но часто женщины и врачи для удобства используют слово «менопауза» вместо «постменопауза». Также популярны понятия климакса, климактерического периода. Впервые понятие «менопауза» (la Ménоpause) появилось в обиходе благодаря описанию этого состояния французским гинекологом Де Гарденном в 1816 году. В 1839 году была опубликована первая книга на тему менопаузы, автором, который был другой французский врач, Др. Менвилл. Понятие «климактерический синдром» (или климакс) появилось в 1899 году благодаря статье под названием «Эпохальные безумия», в которой симптомы, испытывающие женщинами в постменопаузе, были названы «Климактерическим сумасшествием». Существует ложное убеждение, что повышенные уровни эстрогенов, или эстрогенное доминирование, в этот период жизни связаны с истинным повышением этих гормонов. Количество эстрогенов как раз в норме, а нарушение баланса между выработкой эстрогенов и прогестерона приводит к появлению разных признаков такого дисбаланса — от нарушения менструального цикла, до роста фибромиом и развития депрессии и других расстройств психики. Также физиологическое понижение уровней эстрогенов и прогестерона может привести к возникновению заболеваний не только на уровне репродуктивной системы, но и организма в целом. Предменопауза и менопауза сопровождаются изменениями и в других органах — сердечно-сосудистой системе, мозге, скелетно-мышечной системе и др. Чаще появляются горячие приливы и ночные потения, которые приводят к появлению психологического дискомфорта и жалоб неврологического характера (бессонница, раздражение, депрессия, нарушения памяти, уменьшение концентрации внимания). Многие женщины воспринимают процесс старения и обнаруженные признаки назревающей менопаузы негативно, с чувством страха, боязни потерять сексуальность и женственность. Прогрессирующая возрастная яичниковая недостаточность приводит к повышению риска слабоумия (деменции) и развитию умеренных когнитивных нарушений.12.1. Теории возникновения менопаузы
В современной медицине существует настоящий хаос в отношении понимания гормональных изменений в период климакса, а также влияния заместительной гормональной терапии на здоровье женщины. Такая неразбериха связана с тем, что животных моделей, которые бы в точности отражали состояние менопаузы у женщин, не существует. Другая причина состоит в огромном количестве гормональных препаратов, в том числе синтетических прогестеронов, которые используются женщинами в менопаузе с разными целями. За последние полстолетия в научной литературе появилось много гипотез и моделей, описывающих процесс старения и возникновения менопаузы у женщин.12.1.1. Эволюционные теории
Эволюционная точка зрения на возникновение менопаузы гласит, что организм современных женщин совершенно не готов к менопаузе из-за увеличения продолжительности жизни людей. В 18-м столетии из 100 родившихся младенцев до возраста совершеннолетия (16 лет по тем временам) доживало только 25, то есть уровни смертности были очень высокими. Поэтому средняя продолжительность жителя Европы была не больше 35–40 лет. Такая же продолжительность наблюдалась и в других странах. К этому возрасту (30–40 лет) многие женщины завершали свою детородную функцию. Некоторые умирали после частых беременностей, родов и периодов грудного кормления, так и не дожив до менопаузы. У других же менопауза наступала в 35–37 лет, но опять же, из-за короткой продолжительности жизни, многие женщины умирали, не дожив до 45–50 лет. К 40 годам немало женщин уже становилось бабушками, если учесть возраст замужества (14–17 лет). В 19-м столетии продолжительность жизни немного увеличилась, тем не менее, многие женщины так и не достигали периода менопаузы или же этот период был непродолжительным. Современные женщины во многих странах живут в среднем 75–80 лет. Если за средний возраст возникновения менопаузы принять 51 год (согласно ряду исследований), то от 25 до 35 лет своей жизни (1/3 минимум) женщины живут в менопаузе. Эволюционные гипотезы и теории развития менопаузы утверждают, что у людей не было достаточного времени для адаптации к таким быстрым эволюционным изменениям. Поэтому менопауза является своеобразным «побочным эффектом» увеличения продолжительности жизни (как, впрочем, и увеличение уровней многих заболеваний, в том числе раковых). Другая эволюционная гипотеза гласит, что менопауза является проявлением философского закона, отражающего взаимоотношение между качеством и количеством — потеря качества жизни из-за обретения количества лет, с чем трудно не согласиться. Гипотезы «Хорошей матери», «Бабушки» рассматривают возникновение менопаузы через отношение женщин к своему потомству — детям и внукам. Теория «отходов» утверждает, что с возрастом в организме возникает больше поломок на разных уровнях (от клеточного до органного). Поэтому природе проще заглушить репродуктивную функцию, так как ремонт поломок и восстановление тканей и органов требует больших затрат энергии и веществ. Репродукция становится «отходом», что и приводит к состоянию менопаузы.12.1.2. Клеточные гипотезы и теории
Клеточные гипотезы и теории рассматривают процессы старения яичников и возникновения менопаузы на клеточном и тканевом уровне с учетом образования разных веществ. Эти теории позволяют понять возникновение менопаузы на клеточном уровне, а также через взаимоотношение с эндокринными железами, в первую очередь гипофизом. Высокий уровень ФСГ с наступлением старости наблюдается у многих видов животных. Часто измерение уровня этого гормона проводится для постановки диагноза менопаузы, ранней или физиологической. Хотя уровень ФСГ колеблется в разные дни менструального цикла и может быть высоким на 2–5-й день цикла у женщин, менструирующих регулярно, однако его повышенный уровень может наблюдаться и в другие дни цикла задолго до появления нерегулярности и предклимактерических изменений, что является определенным прогностическим признаком старения яичников. Повышение уровня ФСГ является результатом торможения роста фолликулов и их гибели; одновременно высокий уровень этого гормона приводит к ускоренной гибели оставшихся фолликулов. Но до сих пор неизвестно, на каком уровне включается механизм старения яичников и выключения их функции — на уровне мозга, а потом на уровне органа, или наоборот.12.2. Животные модели менопаузы
Для подтверждения теорий и гипотез необходимы модели, на которых можно проводить эксперименты. Речь идет о животных моделях, и чаще всего используют грызунов, птиц, обезьян. Существует несколько животных моделей «менопаузы», изучение которых дает возможность ученым попытаться объяснить и понять процесс возникновения менопаузы у женщин. Наиболее распространенные модели — это «нетронутое (интактное) старение» и «овариэктомии» (удаления яичников).12.2.1. Нетронутое старение
Такой вид возникновения «менопаузы» наблюдается у грызунов. Однако у них нет менструальных циклов, а есть циклы созревания яйцеклеток, или репродуктивные циклы. Когда способность к размножению прекращается, возникает эстропауза. Точно так же, как и у людей, у грызунов в процессе старения (9–12 месяцев) появляются нерегулярные и затяжные циклы созревания половых клеток, понижается способность к зачатию. К концу первого года жизни репродуктивные циклы прекращаются, возникает затяжной эструс, который фактически становится эстропаузой. Уровни эстрогена у грызунов в этот период значительно понижаются. В зависимости от вида грызуна понижение уровней эстрогенов и прогестерона может быть разным. Также у грызунов в «менопаузе» повышаются уровни гонадотропинов. Негативной стороной такой модели является то, что у грызунов нет менструаций, поэтому у них нет «истинной менопаузы», то есть «точки отсчета» вхождения в менопаузу. У женщин во время менопаузы уровни эстрогенов могут быть непредсказуемыми — от высоких до низких. Но в целом они значительно понижаются. Уровень прогестерона понижается тоже, ФСГ и ЛГ повышается. У грызунов гормональных скачков не наблюдается — уровень гормонов у них понижается постепенно и предсказуемо. Данная модель включает переходный период, фактически предменопаузу, что происходит у людей и грызунов — процесс старения яичников не является скачкообразным. В отличие от других видов животных, у современных людей около 50 % продолжительности жизни занимает репродуктивный период (с 15 до 55 лет в среднем). Тем не менее, понижение репродуктивной функции начинает наблюдаться уже с 30 лет, и этот период угасания фертильности имеет моменты медленного и ускоренного старения яичников.12.2.2. Модель овариэктомии
Эту модель часто называют OVX-моделью. Она характеризует процесс прекращения репродуктивной функции, а также функции яичников, в любой период жизни взрослых животных, в том числе людей. Если удалить яичники, что называется овариэктомией, у женщины репродуктивного возраста (15–55 лет) возникнет искусственная менопауза. То же самое происходит и у самок животных: если удалить яичники, репродуктивные циклы прекращаются, уровни половых гормонов понижаются. Но речь идет не об искусственном удалении яичников, а о внезапном прекращении их функции, когда возникает менопауза, ранняя или нормальная физиологическая. Такая модель исключает переходный период изменений в организме животного и человека, связанных со старением репродуктивных органов. Резкое прекращение репродуктивных циклов и наступление менопаузы возможно у женщин в любом возрасте. Эта модель также имеет преимущество в том, что после удаления яичников у животных можно экспериментировать с назначением разных стероидных гормонов и их влиянием на гормональный фон, а также исследовать симптомы яичниковой недостаточности. Результаты таких назначений будут получены быстрее и выражены более четко, поскольку натуральный гормональный фон, создаваемый яичниками, в таких случаях исключается. Важную роль играет также остаточная ткань яичников, которая может проявлять определенную гормональную активность, особенно в выработке мужских половых гормонов. При возникновении менопаузы по типу «удаления яичников» всегда важно знать возраст женщины, какие гормональные препараты были назначены, в какой дозе, как долго они принимались и какое влияние в целом оказали на женский организм. Имеет значение и чувствительность тканей к вводимым стероидным гормонам, особенно при длительном их приеме. Эксперименты на животных с такой моделью менопаузы показали, что чем моложе организм в момент удаления яичников, тем короче периоды и с меньшими дозами заместительной терапии требуются. Но именно разный возраст прекращения функции яичников, а также разная ответная реакция на корректировку гормонального фона, затрудняет найти оптимальный вариант заместительной гормональной терапии для лечения женщин с яичниковой недостаточностью или ранней менопаузой. Чем старше женщина, тем чувствительность к эстрогенам ниже, поэтому доза гормональной терапии и ее продолжительность у женщин молодого возраста не могут быть такими же, как у женщин старшего возраста. Однако этот факт врачами чаще всего не учитывается, а назначение заместительной гормональной терапии проводится без индивидуального подхода и без учета возраста женщины. Модель овариэктомии помогает рассмотреть случаи возникновения внезапной менопаузы в основном у молодых женщин, которые теряют яичники по разным причинам задолго до возникновения натуральной менопаузы, а также у тех, у кого возникла острая яичниковая недостаточность (ранняя менопауза) по неизвестным причинам. Но такая модель не позволяет оценить процесс адаптации организма к старению.12.2.3. Модель ускоренной яичниковой недостаточности переходной менопаузы
Каждая группа ученых, изучающая вопросы менопаузы, обычно концентрирует внимание на конкретном направлении влияния гормональных изменений на какие-то отдельные органы. Например, модель интактного старения яичников концентрирует больше внимания на репродуктивной системе и уровне фертильности животных и человека. Модель овариэктомии уделяет большее внимание симптомам со стороны других органов, в частности мозга, из-за резкого прекращения функции яичников. Ученые, изучающие влияние менопаузы на сердечно-сосудистую систему, предложили новую модель, описывающую угасание функции яичников в результате изменений в системе их кровоснабжения, то есть на сосудистом уровне. Давно замечено, что хирургические манипуляции (лапароскопия, лапаротомия) на маточных трубах и яичниках, которые часто проводятся без строгих показаний у весьма молодой категории женщин, планирующих беременность, повышают риск возникновения ранней менопаузы, то есть яичниковой недостаточности. Эти манипуляции не обязательно связаны с удалением яичников или их части. Речь идет о других видах операций: рассечение спаек вокруг маточных труб, пластика труб, внематочная беременность, рассечение или сверление капсулы яичника у женщин с синдромом поликистозных яичников (и этот диагноз в преимущественном большинстве случаев выставляется неправильно). Обычно врачи не предупреждают женщин о риске ранней менопаузы после таких вмешательств. Тем не менее, возникновение яичниковой недостаточности у этой категории женщин объясняется тем, что происходит нарушение микроциркуляции и кровоснабжения яичников нередко из-за повреждений сосудов, как случайно, так и в качестве неизбежного следствия проводимой процедуры. Эксперименты на животных показали, что введение ряда веществ в организм мышей приводит к ускоренной гибели примордиальных и первичных фолликулов. К таким веществам относят промышленные химикаты, которые часто используются в производстве инсектицидов, пластмасс, антиокислителей, автомобильных шин, огнеупорных покрытий и др. Предполагается, что токсические вещества, проникающие в кровеносную систему репродуктивных органов, или же манипуляции на этих органах, нарушающие микроциркуляцию, могут привести к гибели фолликулов и ускорить процессы, ведущие к менопаузе. При натуральном старении, когда отсутствуют внешние повреждающие факторы, примордиальные фолликулы дегенерируют через атрезию. Ооциты при этом погибают через апоптоз (запрограммированная клеточная гибель), а клетки оболочки (тека-клетки) превращаются в интерстициальные клетки. Наличие этих клеток является характерной особенностью яичников в менопаузе. Они обладают андрогенной активностью, то есть могут вырабатывать мужские половые гормоны, в первую очередь андростендион. Такой вид модели менопаузы может использоваться у молодых животных с изучением его реакции на повреждение определенного количества примордиальных фолликулов через адаптацию к временной ускоренной потере фолликулов и восстановлению репродуктивной функции (что наблюдается также при хирургических манипуляциях на яичниках молодых женщин).12.3. Заместительная гормональная терапия
После открытия эстрогенов в 1923 году Др. Алленом и Дойзи работа над созданием препаратов, содержащих женские половые гормоны, набрала чрезвычайно быстрые темпы, и уже в 1926 году в продаже появились первые препараты с эстрогенами. Их начали широко применять для лечения климактерического синдрома, разговоры о котором тоже стали очень популярными среди женщин того времени, особенно богатых слоев белого населения США и Европы. Для большинства женщин мира такие гормональные препараты были все же недоступны. До конца 40-х годов назначение эстрогенов для лечения неприятных симптомов менопаузы основывалось скорее на теоретических предположениях, чем на доказанной эффективности такого лечения. Первыми идею о том, что эстрогенная терапия может предотвратить климактерический синдром, высказали Др. Гейст и Шпильман в 1932 году. Чуть позже Др. Рейфенштейн предположил связь между остеопорозом (потерей костной ткани) и менопаузой и предложил использовать гормональную терапию с этой целью. Однако наиболее глубоко эту тему изучил Роберт Вильсон, который в 50-х годах описал тесную связь между понижением функции яичников и возникновением не только климактерических симптомов, но и целой серии процессов старения женского организма, и для предотвращения таких изменений предложил использовать эстрогены. В 1966 году в Великобритании он опубликовал книгу «Женственность навсегда» (Feminine forever), которая стала чрезвычайно популярной не столько среди врачей, сколько среди женщин Европы и США. В этой книге был сформулирован диагноз «Синдром эстрогенной недостаточности», который врач предлагал лечить препаратами эстрогенов. В 1969 году Международный фонд здоровья (International Health Foundation) под натиском общественных споров о применении заместительной гормональной терапии для лечения климактерических симптомов провел опрос женщин в пяти странах Европы (по 400 из каждой страны). Оказалось, что знания женщин о климаксе и лечении его симптомов зависели от уровня публикаций в средствах массовой информации. Чем больше эта тема обсуждалась в обществе, тем больше женщин знало о гормональной терапии. Самыми образованными в вопросах эстрогенной терапии оказались жительницы Германии (в Германии же отмечена и самая высокая популярность книги Др. Вильсона). Результаты опроса привели к длительному обсуждению рациональности назначения гормональной терапии. К тому времени в арсенале медицины было несколько синтетических форм прогестерона, а на рынке появились и начали внедряться в массы первые гормональные контрацептивные препараты. Поэтому в процессе дискуссии вопроса о ЗГТ была высказана идея добавить к эстрогенам прогестерон. Ошибочно многие женщины, да и врачи тоже, рассматривали заместительную гормональную терапию (некоторые рассматривают до сих пор) как средство омоложения, некую панацею для возврата молодости и превращения менопаузальной женщины в предменопаузальную. Др. Норман выступал против такого взгляда, акцентируя внимание на том, что основная задача ЗГТ — это помощь женщине в устранении симптомов менопаузы на гормональном (эндокринном)уровне, а не с целью омоложения. Европейские страны были первыми в принятии ЗГТ как лечебной терапии климактерического синдрома, и вскоре она назначалась большому количеству женщин, в том числе тем, у кого были удалены матка и яичники. Мало того, что такая терапия назначалась по показаниям (для лечения), гормоны могли предлагаться любой женщине в предклимактерическом периоде при отсутствии жалоб — только по ее желанию «предотвратить» процесс старения яичников, что, конечно, было ложным убеждением — яичники стареют независимо от того, принимает женщина гормоны или нет. Среди врачей были и такие, которые предлагали принимать ЗГТ всем женщинам после 45 лет пожизненно. Единственной страной среди капиталистической Европы, где к ЗГТ относились с некой прохладцей и осторожностью, была Великобритания. Гормональная терапия в этой стране начала применяться приблизительно на 8 лет позже по сравнению с Германией и рядом других европейских государств. Фактически росту использования ЗГТ англичане обязаны активной пропаганде гормонов Венди Купер, которая в 1975 году опубликовала книгу «Без изменений: биологическая революция для женщин» (No Change: Biological Revolution for Women). Интересно, что чаще всего созданием мифов и активным внедрением многих лекарственных препаратов люди обязаны авторам «сенсационных книг», несмотря на то, что у большинства этих авторов нет медицинского образования, но зато есть связи и контакты в средствах массовой информации. В США, наоборот, к ЗГТ врачи относились агрессивно вплоть до начала 90-х годов. Только единицы американских врачей назначали гормональную терапию менопаузальным женщинам. После публикаций книг Др. Ли, о котором уже упоминалось не раз в этой книге, массово начали внедряться препараты прогестерона среди женщин климактерического возраста, к тому же по их собственной инициативе. Но необходима ли ЗГТ на самом деле? Действительно ли прогестерон помогает в устранении климактерических симптомов? Женщины старшего возраста применяют заместительную гормональную терапию для подавления климактерических симптомов, особенно горячих приливов. Для уменьшения побочных эффектов эстрогенов женщины часто комбинируют его прием с приемом прогестерона. Для лечения климактерических симптомов чаще всего применяются эстрогены, прогестероны и реже андрогены. Как и эстрогены, прогестерон может помочь в профилактике потери костной ткани, лечении бессонницы, раздражения, головных болей. Однако клинические исследования подтвердили наличие изменений в молочных железах на фоне приема ЗГТ: ткань молочных желез становится плотнее. Комбинация эстроген-прогестероновой ЗГТ вызывает больше изменений, чем применение только одного эстрогена. Кроме того, при применении «натурального» эстрогена наблюдается больше отклонений, чем при применении синтетического прогестерона (прогестинов). Такие изменения могут «маскировать» развитие рака молочной железы и усложнять интерпретацию диагностических тестов. Проведено уже немало клинических исследований по сравнению действия микронизированного прогестерона (МР) и ацетата медроксипрогестерона (МПА), синтетической формы прогестерона, но многие из них были проведены с определенными погрешностями. Чаще всего заграничные врачи используют этот вид прогестерона для лечения климактерических симптомов. Оказалось, что разницы в снижении симптомов или появлении кровянистых выделений при применении разных форм прогестерона не наблюдалось. И МР, и МПА имеют одинаковое влияние на молочные железы, сердечно-сосудистую систему и другие органы. Эндокринные общества некоторых стран предупреждают, что утверждения о безопасности и преимуществе микронизированного прогестерона являются необоснованными, недоказанными и преждевременными. Большинство обществ акушеров-гинекологов строго не рекомендуют комбинацию разных форм прогестерона, а также переходы с одной на другую. Прогестерон является одним из видов заместительной гормональной терапии независимо от формы, поэтому врачи и женщины должны понимать простую истину: гормон есть гормон, и не важно, каким путем его получили. В 2002 году были опубликованы результаты американского клинического исследования Women’s Health Initiative (WHI) по использованию эстрогенов и прогестина (МПА) в гормональной заместительной терапии у женщин в климактерическом периоде. Они показали увеличение риска развития рака молочной железы (на 26 %), сердечно-сосудистых заболеваний, кровоизлияния в мозг, образования тромбов и тромбоэмболии по сравнению с контрольной группой женщин, принимавших плацебо. В этом исследовании участвовали 16 608 женщин в возрасте 50–79 лет, с сохраненной маткой, из 40 американских клинических центров с 1993-го по 1998-й год. Результаты этого исследования шокировали не только многих врачей, но и женщин, применявших ЗГТ, а также тех, кто искал безопасные формы ЗГТ и планировал принимать комбинацию эстрогенов и прогестерона. После публикации статьи в течение 3 месяцев назначение врачами комбинации эстрогена с прогестероном понизилось на 63 %. Это означало, что миллионы женщин остались без помощи и лечения. Около 70 книг с серьезной критикой гормональной заместительной терапии на английском языке и не меньше на других языках были опубликованы в короткий период времени. В другом развернутом исследовании в Великобритании было изучено влияние ЗГТ на развитие рака молочной железы у 1 084 110 (более 1 миллиона) женщин в возрасте 50–64 лет с 1996-го по 2001-й год. Результаты показали, что такая терапия повышает уровень этого опасного заболевания, особенно если использовалась комбинация эстрогена и прогестерона — намного больше, чем применение только эстрогенов. Как вспоминает моя коллега Др. Келли Мерфи, когда она обучалась в медицинской школе в 90-х годах, назначение заместительной гормональной терапии всем без исключения женщинам в постменопаузе было не просто рекомендацией, а догмой, и молодые врачи настолько в это верили, что мало у кого возникало сомнение, что данные в поддержку пользы ЗГМ могут быть неточными и даже ложными. В 1999 году более 90 миллионов женщин в мире принимали гормоны в постменопаузе. Данные двух крупных исследований шокировали врачей, особенно гинекологов и семейных врачей, которые чаще, чем другие специалисты, назначали ЗГТ. Многие отказались от такой терапии, потому что эти данные затрагивали не только вопрос о серьезных побочных эффектах лечения, но и этические вопросы: как доверять врачам, если их утверждения, а значит, знания, оказываются ложными? И все же американским и европейским врачам необходимо отдать должное: как только они узнали о новых данных, они открыто и смело начали предупреждать женщин о возможном вреде ЗГТ (такая же быстрая реакция врачей наблюдалась в 2010–2012 годах после публикации целой серии крупных исследований о вреде витамина Е для беременных женщин — большинство зарубежных врачей перестало рекомендовать этот витамин беременным и женщинам, планирующим беременность). К 2005-му году, как показали последующие исследования, хотя и немногочисленные по количеству участников, большинство женщин климактерического периода знали о серьезных последствиях гормональной заместительной терапии, и получили они такую информацию в основном от своих врачей. Но публикации новых данных о негативных последствиях ЗГТ привели к еще одному негативному явлению — поиску альтернативных методов лечения менопаузальных симптомов. И, казалось бы, в чем же негативизм альтернативных методов лечения? В том, что очень быстро врачи и женщины «переключились» на использование «натурального» прогестерона вместо синтетического, который продавался на рынке на коммерческой основе вне контроля организаций, проверяющих качество препаратов и лицензирующих такие препараты как лекарства. Проблема была не в том, что многие препараты «натурального» прогестерона содержали далеко не прогестерон, но также доза большинства препаратов не была обоснована клиническими исследованиями. Фактически ни одна из форм «натурального» прогестерона в то время не прошла серьезных клинических испытаний безопасности и эффективности. Часто масла в огонь подливает пресса и другие средства массовой информации: врачи, дескать, такие плохие, потому что пользуются только препаратами, утвержденными как лекарства, а когда появляются результаты таких серьезных клинических исследований, врачи при этом все равно отказываются назначать натуральные заменители гормонов, — значит, нужно, чтобы женщины сами ими пользовались. Такие ложные обоснования применения «натуральных» гормонов также поддерживаются (и не бесплатно) теми фармакологическими компаниями, которые производят эти «натуральные» гормоны, а поэтому им выгодны продажи их продукции. Анализ 130 исследований по применению альтернативных терапий для лечения симптомов менопаузы, в том числе применения «натурального» прогестеронового крема, показал, что такие терапии действуют на уровне плацебо. Это не принижение значения альтернативной медицины, а подтверждение того факта, что от индивидуального восприятия состояния менопаузы зависит наличие симптомов у большинства женщин — корни проблемы погружены в мышление. Поэтому может помочь все, что угодно, если женщина поверит в это. И, наоборот, ничего не поможет, если женщина верить в это не будет.13. ПРОГЕСТЕРОН И КОНТРАЦЕПЦИЯ
Гормональная контрацепция — такая же актуальная тема, как и тема заместительной гормональной терапии, и ее обсуждение в обществе продолжается в течение последних шестидесяти лет. На смену одним гормональным контрацептивам приходят другие, потому что одни синтетические гормоны сменяются другими. Основная цель в поиске новых видов женской контрацепции — это уменьшение побочных эффектов и создание более комфортных схем использования препаратов, не требующих ежедневного внимания женщины к вопросу предохранения от беременности. Во всем мире, как предполагается, удается предотвратить 187 миллионов незапланированных беременностей благодаря использованию гормональной контрацепции. Это означает предотвращение смерти около 2.7 миллионов новорожденных и 215 000 женщин из-за осложнений беременности и родов. Это также предотвращает до 80 % абортов и большое количество осложнений, связанных с прерыванием беременности. До сих пор многие женщины и врачи в ряде стран смотрят на гормональную контрацепцию как на «исчадие зла», акцентируя внимание на серьезных побочных эффектах применения такого вида контрацепции, возникающих у некоторых женщин. Но история и медицинская практика показывают: в тех странах, где уровень гормональной контрацепции на низок, наблюдаются чрезвычайно высокие уровни абортов, в том числе нелегальных. Количество осложнений из-за прерывания беременности значительно превышает количество осложнений из-за применения гормональной контрацепции. Поэтому «из двух зол» необходимо выбирать меньшее — и гормоны в этом отношении наиболее эффективный вариант предохранения от беременности. О том, что прогестерон и прогестины успешно используются для предупреждения беременности, уже не раз упоминалось в этой книге. Фактически весь поиск синтетических форм прогестерона был организован с целью создания гормональных контрацептивов. Прогестерон предохраняет от беременности, подавляя овуляцию, если его применять в начале цикла или за несколько дней до овуляции. И так чаще всего и происходит, когда женщина лечится от «прогестероновой недостаточности», при ложном диагнозе, принимая прогестерон с 5-го или 11-го дня цикла, а желанная беременность не наступает. Все же предпочтение в гормональной контрацепции отдано синтетическим формам прогестерона — прогестинам, которые помимо прогестеронового действия имеют дополнительно и другие свойства, о чем говорится в главе «Синтетические формы прогестерона». Такое предпочтение основано в первую очередь на том, что синтез биоидентичного прогестерона на момент открытия нескольких прогестинов отсутствовал, а когда его начали получать из растительного сырья, на рынке уже имелись гормональные контрацептивы. Комбинация разных видов гестагенов с синтетическими эстрогенами не только увеличила выбор КОК, но и позволила проводить подбор гормональных контрацептивов индивидуально. Кроме того, прогестины по своему действию намного сильнее прогестерона, поэтому требуется меньшая доза для подавления овуляции. В некоторых источниках (чаще всего в рекламных аннотациях) можно найти утверждение, что тот или иной прогестин не подавляет овуляцию. Это ошибочное утверждение. Все без исключения прогестины, как и прогестерон, подавляют овуляцию (и в нормальных физиологических циклах прогестерон не участвует в созревании фолликула, а его очень кратковременный скачок наблюдается за несколько часов до овуляции не без цели, о чем упоминалось в разделах, посвященных овуляции). Суть в том, что подавление овуляции требует определенной дозы прогестина или прогестерона. Обычно в состав гормональных контрацептивов входит то количество гормона, которого вполне достаточно для подавления овуляции.13.1. Классификация гормональных контрацептивов
Точно так же как есть классы поколений прогестинов, существуют классы гормональных контрацептивов, и фактически такая классификация контрацептивов основана на классификации прогестинов. Помимо классов поколений существуют комбинированные оральные контрацептивы (КОК): монофазные, трехфазные и продолжительного воздействия, а также контрацептивы, содержащие только прогестины или, как их называют, «чисто прогестагенные контрацептивы». Монофазные КОК имеют неизменную одинаковую дозу гормонов для 21-й таблетки и часто 7 таблеток-пустышек. У трехфазных количество гормонов меняется для каждой недели приема в течение трех недель, а дальше делается перерыв в 7 дней или принимаются таблетки-пустышки. Гормональные контрацептивы, созданные для продолжительного воздействия, содержат определенное количество гормонов. Если это КОК в таблетированной форме, то каждая таблетка содержит одинаковую дозу эстрогена и прогестина, и такие КОК принимаются в течение трех месяцев с перерывом в одну неделю или приемом пустышек в течение 7 дней. Прогестиновые контрацептивы, выпускаемые в виде таблеток, принимаются в течение 28 дней. Прогестины в виде инъекций обеспечивают контрацептивный эффект на 12–18 недель (Депо-Провера), а в виде имплантатов предохраняют от беременности в течение трех лет. Внутриматочная гормональная система «Мирена» обеспечивает контрацептивный эффект в течение 5 лет. Применение прогестинов оказалось безопаснее для ряда категорий женщин, которые не могли воспользоваться КОК, например, для женщин старше 35 лет, курящих, имеющих историю заболевания венозных сосудов и образования тромбов, повышенного кровяного давления. Прогестины — единственные гормональные контрацептивы, которыми могут воспользоваться женщины, кормящие грудью. Они также удобны и безопасны для подростков и молодых нерожавших женщин. Нередко женщины, планирующие гормональную контрацепцию, жалуются, что врачи предлагают выбрать им препарат по их желанию. Если во многих странах гормональные контрацептивы можно приобрести только по рецепту (за исключением экстренной контрацепции), потому что гормоны приравниваются к серьезным лекарственным препаратам, в постсоветских странах их можно купить в любой аптеке. Опросы женщин показывают, что чаще всего они покупают гормональные контрацептивы, выбирая их по цене (обычно самые дешевые — это контрацептивы старого поколения, поэтому с серьезными побочными эффектами) или по совету подруг, знакомых, а еще чаще «виртуальных контактов» на разных форумах. В каждой стране мира в продаже имеется ограниченное количество гормональных контрацептивов, как отечественных, так и импортных. Нередко это могут быть одинаковые по составу препараты, но под разными названиями. Всегда необходимо уточнить у врача, к какой группе и к какому поколению относится гормональный контрацептив, который назначается женщине, а также не забыть расспросить о побочных эффектах препарата.13.2. Воздействие прогестинов как контрацептивов
Существует четыре механизма воздействия прогестинов в качестве контрацептивного агента: 1. Нарушение процесса овуляции через подавление роста ЛГ и ФСГ в середине цикла. Следует знать, что во всех противозачаточных гормональных таблетках и других формах препаратов основной контрацептивный эффект обеспечивается прогестагенным компонентом. Эстрогены добавляют с целью получения лучшего регулярного кровотечения отмены (для лучшего роста эндометрия) и предупреждения кровотечения в середине цикла. Они также могут подавлять овуляцию, воздействуя на выработку ЛГ и ФСГ гипофизом, но в высоких дозах. 2. Выработка густой шеечной пробки, что предотвращает попадание сперматозоидов в полость матки (такой же эффект оказывает прогестерон при беременности, когда формируется шеечная пробка). 3. Нарушение качества эндометрия, который становится непригодным для имплантации. Такой эффект достигается путем подавления возникновения и активации прогестероновых рецепторов, повышением роста стромальных клеток и уменьшением количества секреторных желез эндометрия. Также наблюдается отечность тканей эндометрия. 4. Уменьшение подвижности маточных труб и движений ресничек. Именно этим объясняется также повышение риска возникновения внематочной беременности при применении прогестиновых препаратов с лечебной целью. Несмотря на то, что существует множество прогестинов, все они без исключения имеют вышеперечисленные механизмы контрацептивного действия, но каждый гестаген может иметь и специфическое действие как следствие определенной пропорции по силе проявления этих механизмов. Другими словами, одни гестагены больше подавляют овуляцию, другие — меньше, одни больше нарушают качество эндометрия, другие — меньше и т. д. Одни прогестины имеют более выраженный антиандрогенный эффект, другие, наоборот, проявляют андрогенный эффект и т. д.13.3. Безопасность применения прогестиновых контрацептивов
Для большинства женщин прогестиновые контрацептивы мини-пили (в английском варианте Progestin-only рills, или POP) являются безопасным методом предохранения от беременности. Побочные эффекты препаратов обычно такие же, как и при использовании прогестерона. В 2000 году ВОЗ разработала Медицинские критерии приемлемости контрацептивов пациентами с учетом их заболеваний и клинических проблем (Medical Eligibility Criteria — MEC), которые используются на практике во многих странах мира. Несколько раз эта классификация дополнялась, и последнее, 4-е издание было опубликовано в 2009 году. В некоторых странах, как, например, в США, Великобритании, эти критерии были дополнены в 2012–2013 годах. Россия приняла адаптационный вариант 4-го издания критериев ВОЗ в 2012 году. Существует четыре класса Медицинских критериев приемлемости контрацептивов пациентами, которыми пользуются врачи и при назначении прогестинов: МЕС 1 — состояние, при котором ограничений к применению контрацепции нет, МЕС 2 — состояние, при котором преимущества метода контрацепции в целом превосходят теоретически обоснованный или доказанный риск, МЕС 3 — состояние, при котором теоретически обоснованный или доказанный риск в целом превосходит преимущества контрацептивов (относительные противопоказания), МЕС 4 — состояние, которое представляет неприемлемо высокий риск для здоровья и использования контрацепции (абсолютные противопоказания). При назначении прогестинов, как и других методов контрацепции, правилом номер один является следующее: определение достоверности того, что женщина не беременна. Поэтому в некоторых странах от врача требуют проведение определения уровня ХГЧ в крови женщины, особенно в случаях нерегулярных менструальных циклов, во второй половине цикла или при ненормальных последних месячных (короткие, мажущие) до назначения гормональных контрацептивов. Анализ крови на ХГЧ не проводят, если у женщины не было половых отношений со дня нормальных последних месячных или если она пользуется другими надежными методами контрацепции. Прогестины могут назначаться без исключения беременности в первые 7 дней от начала менструального цикла, в первые 4 недели после родов у женщин, не кормящих грудью, и в первые 7 дней после аборта. У кормящих матерей при отсутствии менструаций все же рекомендуется провести тест на ХГЧ, если после родов прошло 4–6 или больше месяцев. Тест на беременность может быть положительным не раньше 3 недель после полового акта, поэтому этот факт необходимо учитывать при оценке состояния женщины. После исключения беременности общее состояние каждой женщины, пожелавшей воспользоваться гормональной контрацепцией, должно быть оценено согласно Медицинским критериям приемлемости. При наличии абсолютных противопоказаний контрацепция прогестинами не может быть использована. К сожалению, такой подход к оценке состояния женщины и приемлемости контрацепции в каждом индивидуальном случае часто игнорируется врачами, особенно в тех странах, где гормональные контрацептивы можно приобрести без рецепта врача. Самым частым побочным эффектом приема прогестиновых контрацептивов являются нерегулярные кровотечения или мажущие кровянистые выделения. Около половины женщин, использующих мини-пили, имеют продолжительные кровотечения, а около 70 % — кровянистую мазню в одном или более циклов. У 20 % женщин менструации исчезнут, у 40 % кровянистые выделения будут появляться периодически, а у 40 % кровотечения будут регулярными. Именно из-за этого побочного эффекта до 25 % женщин, пользующихся прогестиновой контрацепцией, прекращают ее прием в течение первого года.13.4. Режимы приема контрацептивов
Идея использования прогестинов с контрацептивной целью принадлежит Др. Грегори Пинкусу, который в 1950-х годах предложил принимать 21 день гормональные таблетки и 7 дней пустышки для возникновения кровотечения отмены, что симулирует натуральный цикл. Интересно, что этот 21/7-дневный режим был выбран с целью следования лунному циклу, чтобы контрацептивы были морально приняты не только женщинами и врачами, но и католической церковью. До конца 1970-х годов в медицинской литературе не существовало публикаций, которые бы опровергали «классический» режим приема контрацептивов, но в 1977 году появились первые данные о более длительном приеме активных гормональных контрацептивных таблеток без перерыва — в течение 84 дней, чтобы уменьшить количество менструальных кровотечений до трех месяцев. Современные врачи активно спорят о том, нужны ли на самом деле женщине месячные и если нужны, то как часто. Сторонники «редких менструаций» аргументируют свою точку зрения тем, что до сих пор женщины развивающихся стран (бедных экономически стран) имеют в целом на 160 менструальных циклов меньше (более 10 лет без менструаций), чем жительницы развитых стран. Это объясняется определенными демографическими факторами: эти женщины начинают менструировать позже, беременеть и рожать раньше и чаще, и держат детей на грудном вскармливании дольше. Конечно, средняя продолжительность жизни этих женщин меньше таковой в развитых странах, но они реже страдают разного рода «женскими болезнями», имеющими гормональную зависимость, как и раком молочной железы и эндометрия. Сторонники «классических менструаций» считают, что регулярные 28-дневные искусственные менструальные циклы более приемлемы женщинами, так как не вызывают у них страха и переживаний, что они могут быть беременными, если «таблетки не сработают», а также оказывают меньший вред организму женщины. Как раз вред от приема контрацептивов в беспрерывном режиме в течение трех месяцев не обнаружен. Такой режим не всегда приемлем для здоровых женщин, но существует ряд заболеваний, когда отсутствие менструации может кардинально улучшить состояние женщины. К расстройствам менструальной функции относят болезненные менструации (альгодисменорея, или дисменорея), чрезвычайно обильные или частые менструации (меноррагии), нерегулярные маточные кровотечения (метроррагии) и обильные нерегулярные маточные кровотечения (менометроррагии). Предменструальный синдром хотя и не считается заболеванием, но у ряда женщин он может сопровождаться выраженными симптомами. Эндометриоз также полностью зависит от колебания уровней гормонов и наличия менструального цикла. Существует также циклическая мигрень, приступы которой возникают перед месячными. В ряде случаев необходимо «передвинуть» менструальное кровотечение из-за каких-то событий в жизни женщины. Поэтому применение гормональных контрацептивов в другом режиме позволяет менять продолжительность цикла, что называется менструальной манипуляцией, или подавлением менструации. Современные контрацептивы позволяют создавать искусственную менопаузу или значительно уменьшать количество и частоту кровянистых выделений (имплантаты, внутриматочная система, инъекции), что приемлемо для многих женщин, особенно забывающих принимать таблетированные формы гормональных контрацептивов в постоянном режиме. В 2006 году на рынке некоторых стран появился препарат под названием «Аня» (Anya, Lybrel), содержащий 20 мкг этинилэстрадиола и 90 мкг левоноргестрела в каждой таблетке. Хотя этот препарат называют революционным новшеством в современной контрацепции, состав препарата не имеет новых ингредиентов. В отличие от всех остальных КОК этот гормональный контрацептив продается в упаковке, содержащей 365 активных таблеток, без таблеток-пустышек. Прием таблеток в постоянном режиме предотвращает возникновение кровотечения отмены (искусственной менопаузы), хотя прорывные кровотечения все же наблюдаются. Скорее всего, новшество в производстве такого контрацептива имело коммерческую цель — продажа количества гормонов на целый год всегда приносит большую прибыль, чем продажа по месяцам. Сколько женщин не выдержит прием гормонов в течение года, это уже другой вопрос, который обычно в рекламных аннотациях не обсуждается.13.5. Как долго можно принимать гормональные контрацептивы
Так как репродуктивный возраст современных женщин расширился, и менопауза возникает в более старшем возрасте, многих женщин волнует вопрос гормональной контрацепции после 40 лет и как долго можно принимать такой вид контрацепции. Когда необходимо прекратить прием гормонов? Ведь на фоне гормональной контрацепции очень трудно определить, произошло ли угасание функции яичников и наступила ли физиологическая менопауза. Современные рекомендации гласят, что женщинам после 40 лет чаще всего в качестве гормональной контрацепции подойдут прогестины, то есть контрацептивы без эстрогенного компонента. Предполагается, что прием таких контрацептивов может быть до 55 лет, когда у большинства женщин наступает физиологическая менопауза. Чтобы вовремя определить приход климактерического периода на фоне приема гормональной контрацепции, рекомендовано после 45 лет периодически (раз в полгода) определять уровень ФСГ. Наследственная история (возраст матери женщины, в котором у нее наступила менопауза) может помочь в прогнозировании возраста менопаузы у женщины, хотя такой прогноз будет неточным. Ближе к 55 годам уровень ФСГ необходимо определять чаще. Если два показателя уровня ФСГ с разницей не меньше одного месяца составляют больше 30 МЕ/л, это серьезный признак физиологической недостаточности яичников, то есть наступления климакса. В таких случаях женщина может принимать прогестины еще в течение одного года (или двух лет в возрасте до 50 лет). Нередко прогестиновая контрацепция дополняется заместительной гормональной терапией, или же женщина полностью переходит на ЗГТ, прекратив прием прогестинов.13.6. Экстренная контрацепция
До появления гормонов методы экстренной контрацепции (ЭК) были ограничены. Многие акушеры-гинекологи знали, что при непродолжительной задержке менструации введение высоких доз раствора прогестерона внутримышечно, вызывает у большинства женщин кровотечение отмены. Были ли женщины беременны или же у них был сбой менструального цикла — до появления тестов на беременность провести диагностику ранней беременности было невозможно. В лабораториях использовали лягушек, кроликов, мышей для подтверждения беременности у женщин, и такой метод диагностики нередко требовал неделю или больше для получения результата. Впервые экстренная гормональная контрацепция была применена у женщин в 1966 году. В качестве гормонов назначали высокие дозы эстрогенов. В Нидерландах начали использовать синтетический эстроген — этинилэстрадиол, который до сих пор входит в состав многих КОК, а в США — диэтилстильбэстрол (DES). В 1971 году была обнаружена связь между возникновением злокачественных опухолей влагалища у девочек, чьи матери применяли диэтилстильбэстрол во время беременности, и с конца 1980-х годов этот гормон перестали использовать в гинекологии и акушерстве. В 1974 году появился режим приема комбинированных контрацептивов по Юзпе (метод Юзпе) в качестве ЭК. А в 1975 году появилась ЭК с применением прогестинов без эстрогенов, чем пользуется большинство женщин до сих пор. Врачи испытали большое количество гормональных и им подобных препаратов с целью контрацепции, но КОК в режиме Юзпе и прогестины оказались самыми эффективными и относительно дешевыми. Другим методом ЭК, которым начали пользоваться врачи около 40 лет тому назад, было введение внутриматочного средства (спирали) в полость матки в течение недели после случайного или незащищенного полового акта. К сведению, немецкий врач Др. Э. Графенберг, известный больше мистической G-точкой, которую до сих пор так старательно ищут мужчины, женщины и врачи в женском влагалище, первым предложил массовую продукцию ВМС в виде кольца с серебряным наполнителем (кольцо Графенберга). До конца 1950-х годов ВМС производились из серебра и золота, и реже из нержавеющей стали, поэтому цена этого вида контрацепции была высокой, и ею могли воспользоваться далеко не все женщины. В США начали выпускать пластмассовые ВМС, что моментально повысило популярность «спиралей» среди женщин и врачей. Интересно, что гормональные ВМС, содержащие прогестины, появились еще в конце 1960-х годов, но на рынок так и не попали по разным причинам. «Мирена», созданная в 1976 году, длительный период времени не была доступна широкому кругу женщин из-за многочисленных продолжительных судебных разбирательств по поводу ее небезопасности. Экстренная контрацепция с введением ВМС, содержащей медь, была запатентована в 1975 году (в том же году, когда с этой целью начали применять прогестины). Использование прогестинов оказалось более приемлемым и дешевым методом ЭК с наименьшим количеством побочных действий при очень высокой эффективности. Поэтому такому методу отдают предпочтение до сих пор, несмотря на появление и других методов ЭК. Продвижению и распространению прогестинов (левоноргестрела, или ЛНГ) способствовала ВОЗ, участвующая в проведении крупного исследования по сравнению эффективности прогестинов и метода Юзпе в 1998 году. На современном рынке имеется большое количество препаратов левоноргестрела под разными названиями, которые содержат 1.5 мг этого гормона в единичной или двойной дозе (по 0.75 мг). Самое главное, в отличие от других видов контрацепции, эти гормональные препараты можно приобрести без рецепта, что удобно для многих женщин. В Индии, например, таблетки ЛНГ с целью ЭК выдаются бесплатно. Контрацептивная эффективность препарата после приема одной дозы в 1.5 мг или двух доз по 0.75 мг через 12–24 часа в течение 72–120 часов после незащищенного полового акта одинакова. Помимо таблеток разработан гель, содержащий 0.75 или 1.5 мг ЛНГ, который также защищает от инфекций, передающихся половым путем (ИППП) и ВИЧ. В ряде стран в качестве ЭК начали применять антагонисты прогестерона — мифепристон (10 мг) и селективные модуляторы прогестероновых рецепторов — ацетат улипристала (30 мг). Основной механизм действия всех без исключения гормональных препаратов, использующихся для ЭК — это подавление или задержка овуляции. Дополнительно может быть и другое воздействие, хотя оно оспаривается из-за слишком кратковременного применения гормонов и их быстрого выведения из организма. Если зачатие произошло, ЭК оказывается неэффективной в большинстве случаев. Фактически и прогестерон, и любой прогестин можно использовать с целью ЭК, однако проблема в дозе, индивидуальной усвояемости и переносимости препарата, поэтому левоноргестрел до сих пор считается одним из самых универсальных прогестинов, применяемых с этой целью.14. ПРОГЕСТЕРОН И ДРУГИЕ ОРГАНЫ И СИСТЕМЫ ОРГАНОВ
Воздействие прогестерона на разные ткани проявляется разными механизмами, сопровождающимися выработкой различных органических веществ. Например, в желчном пузыре под воздействием прогестерона вырабатывается большее количество тирозинкиназы и циклического монофосфата аденозина. В мышцах сосудов тоже вырабатывается много веществ. В мышцах матки и сердца в воздействие прогестерона втянут кальций. Прогестерон может улучшить процесс дыхания, особенно у больных эмфиземой. Он увеличивает тонус венозных сосудов костной системы, что улучшает кровоток, замедляет процесс потери костной ткани, улучшает состояние суставов и повышает эффективность лечения артритов. У женщин многие обострения заболеваний и, наоборот, ремиссии тесно связаны с менструальным циклом, беременностями, менопаузой. Менструальный цикл влияет не только на состояние психики, но и на ряд общих заболеваний. Известно, что перед менструацией ухудшается протекание астмы, эпилепсии, синдрома раздраженного кишечника, диабета, артритов. Существует так называемая менструальная мигрень. Практически нет такого органа, нет такой системы органов, на которую прогестерон не влиял бы непосредственно или косвенно. Эта реакция будет зависеть не только от уровня прогестерона в крови, но и от пропорции уровней других гормонов. Иначе говоря, в воздействии прогестерона на другие клетки и ткани существует интеграция с другими веществами, в том числе вырабатываемыми этими клетками и тканями. Влияние прогестерона на разные органы и системы органов рассматривается ниже.14.1. Прогестерон и молочные железы
Молочная железа — еще один орган-мишень, помимо матки, реагирующий на прогестерон. Благодаря чувствительности клеток молочной железы с каждым менструальным циклом в ней тоже наблюдаются изменения, особенно во вторую фазу менструального цикла. Из молочных желез, окутанных жировой и соединительной тканью, сформирована грудь. Железы имеют две основные группы клеток: вырабатывающих молоко (железистые) и выстилающие протоки, по которым это молоко выделяется наружу (покровные). Другими словами, подготовка женского организма к зачатию ребенка и беременности начинается с изменений не только в эндометрии, но и в молочных железах. Для нормального развития молочной железы нужны и эстрогены, и прогестерон. Эстроген через эстрогенные рецепторы стимулирует рост молочных протоков, которые прорастают жировую прокладку груди, начиная с области соска вглубь молочной железы, словно ветви дерева, отходящие от ствола. Прогестерон через прогестероновые рецепторы вызывает рост молочных долей и долек, а также мелких пузырьков — альвеол, вырабатывающих молоко. Эта часть молочной железы по строению напоминает гроздья винограда. Пузырек альвеолы выстлан одним слоем железистых клеток — лактоцитов, верхушки которых обращены в полость альвеолы. В основании альвеолы расположены отростчатые миоэпителиальные клетки, обладающие способностью сокращаться и регулировать объем альвеол, выбрасывая через проток, скапливающийся в них секрет. Промежуточным вариантом клеток являются люминальные эпителиальные клетки, которые могут образовывать лактоциты и миоэпителиальные клетки. Прогестерон имеет уникальное воздействие на пролиферацию (деление) клеток. С одной стороны, он может ее стимулировать, с другой стороны, — подавлять. Вид воздействия зависит от уровня прогестерона и продолжительности его воздействия (кратковременное оно или постоянное). Ткани молочной железы легко метаболизируют прогестерон и прогестины, причем последние усваиваются хуже, чем прогестерон. В нормальной молочной железе эпителиальные клетки вне состояния деления не содержат рецепторов, как эстрогенных, так и прогестероновых. Эти рецепторы имеются в небольшом количестве в люминальных клетках. Только 7–10 % нормальных эпителиальных клеток молочной железы имеют эстрогенные и прогестероновые рецепторы. В норме у женщин эпителий молочной железы вне процесса лактации находится под влиянием циклических изменений гормонов, поэтому тоже меняется в течение менструального цикла. Если цикл ановуляторный, в организме женщины доминирует эстроген, а в овуляторные циклы имеется комбинация эстрогена и прогестерона, уровень которого увеличивается во вторую фазу. Поэтому пролиферация тканей молочной железы происходит больше в овуляторные циклы. При нормальном овуляторном цикле пролиферация (митоз) клеток эпителия молочной железы наблюдается в середине лютеиновой фазы и после понижения уровня прогестерона (во второй половине этой фазы). 98 % эпителиальных клеток молочной железы в период роста (пролиферации) имеют эстрогенные и прогестероновые рецепторы. Одни из клеток являются прогестерон-чувствительными, другие прогестерон-нечувствительными, но до сих пор неизвестно, как распределены эти клетки и как регулируется в них паттерн (порядок) размещения прогестероновых рецепторов. Другие гормональные вещества также участвуют в росте молочной железы и ее функции, в честности фактор эпидермального роста (EGF), который принадлежит к группе факторов роста. Прогестероновые рецепторы не могут активироваться в ответ на повышающийся уровень эстрогенов при отсутствии этого фактора в тканях молочной железы. Рост и пролиферация молочных долек и протоков наблюдается также под влиянием других гормонов: пролактина, гормонов щитовидной железы, инсулина. Клетки молочных желез также могут вырабатывать определенные вещества, стимулируя рост соседних клеток молочных долек и протоков. Помимо пролиферации железистых и покровных клеток усиленно растут ткани (структурные), поддерживающие форму и структуру молочных желез. Ткани молочной железы могут накапливать жидкость, особенно перед менструацией, становясь тяжелыми, болезненными, чувствительными. После падения уровней гормонов, что наблюдается непосредственно перед менструацией, эпителий, который вырос до этого периода, проходит процесс самоуничтожения — апоптоз. Благодаря апоптозу уничтожаются многие поврежденные, в том числе генетически, клетки. Однако процесс разрушения клеток молочных желез сопровождается небольшими очагами воспаления, что приводит к формированию микрорубцов, состоящих из фиброзной ткани. При наличии выраженной пролиферации железистой ткани организм не справляется с процессом уничтожения этой ткани, усугубляя формирование фиброзных очагов, что нередко женщины и врачи называют мастопатией.14.1.1. Боль в молочных железах
Боль молочных желез — это самая распространенная жалоба молодых менструирующих женщин, и крайне редко она встречается у женщин в менопаузе. Многие врачи считают боль в обеих молочных железах, особенно во второй половине менструального цикла, перед месячными и в первые дни месячных, признаком предменструального синдрома. 70 % женщин испытывают дискомфорт в молочных железах в определенные периоды своей жизни, у 10 % женщин боль, выраженная или сильная. Часто боль сопровождается уплотнением и напряжением молочных желез. Если уровни гормонов повышены или имеется продолжительное гормональное влияние в результате их приема, пролиферация наблюдается постоянно, что позволяет аккумулироваться дефектным генетически клеткам, которые могут трансформироваться в злокачественные. Факторы, которые приводят к повышенному усвоению гормонов эпителиальными клетками или нарушают процесс их самоуничтожения, значительно повышают риск развития рака молочной железы (см. «Прогестерон и рак молочной железы»). Заболевания печени, желчевыводящих протоков и желчного пузыря тоже могут привести к нарушению циклических изменений в груди. Печень играет очень важную роль в разрушении избытка вырабатываемых эстрогенов и прогестерона. Хронический стресс, депрессия, неврозы, гипертония, ожирение, воспаления придатков тоже могут привести к изменениям в молочных железах (оксидативный стресс). Перед назначением прогестерона рекомендуется проведение осмотра молочных желез, гинекологического ручного осмотра и цитологического исследования шейки матки.14.2. Прогестерон и мозг
Влияние эстрогенов на мозг и нервную систему женщины изучено лучше, чем влияние прогестерона. Известно, что эстрогены оказывают защитный эффект на ткани мозга. Во время менопаузы при нехватке эстрогенов наблюдаются нарушения его работы с развитием слабоумия, расстройств памяти и кровоизлияния в мозг. Существует прямое и непрямое влияние эстрогенов. Прямое влияние подразумевает воздействие на нервные клетки, блокировку активации аминокислот, повышение гуморального иммунного ответа, повышение антиокислительных свойств и поддержание обмена ионов кальция в гемостазе. Непрямой эффект состоит в улучшении функции клеток сосудов и повышении циркуляции крови в мозговой ткани. В первой, фолликулярной, фазе доминируют эстрогены, уровень которых повышается, а во второй, лютеиновой, фазе доминирует прогестерон. Однако почти нигде не упоминается о том, что повышение уровня прогестеронапревосходит почти в 100 раз его показатели в начале первой фазы, чего не скажешь о росте эстрогенов (это колоссальная разница). Вместе с повышением уровня прогестерона наблюдается повышение уровней его метаболитов, которые влияют на разные органы, в том числе на мозговую ткань. Прогестерон оказывает как положительное, так и отрицательное воздействие. Например, он предотвращает смерть нейронов, подавляет процесс окисления жиров клеточных мембран, поддерживает рост нервных клеток и формирование новых нейронов. Прогестерон имеет еще одно положительное воздействие — он защищает клетки мозга от повреждения, уменьшает частоту эпилептических припадков, улучшает память. Как упоминалось раньше, клетки нервной системы и мозга имеют GABAA рецепторы (рецепторы гамма-аминобутировой кислоты), с помощью которых происходит усвоение прогестерона и его воздействие. В разделе 8.4.5 «Регуляция менструального цикла» рассмотрено два противоположных эффекта, которые оказывает прогестерон на гипофиз и мозговую ткань — стимулирующий и подавляющий. Эффект зависит не только от вида метаболитов прогестерона, но и от ферментов, которые участвуют в усвоении прогестерона мозговыми клетками.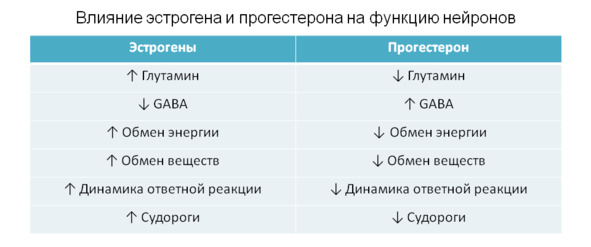
Также в этой книге не раз упоминалось о сексуальном различии между женщинами и мужчинами. Гормональный фон, в котором доминируют мужские половые гормоны или женские половые гормоны, также влияет на частоту психических заболеваний и расстройств психики у мужчин и женщин. Например, уровень депрессии в два раза выше у женщин, чем у мужчин, в то время как посттравматические стрессовые расстройства встречаются у 20 % мужчин и только у 8 % женщин. Расстройства настроения наблюдаются в два раза чаще у женщин, чем у мужчин. Шизофренией страдает в 1.4 раза больше мужчины, чем женщины, и развитие шизофрении у женщин возникает намного позже (25–30 лет), чем у мужчин (16–25 лет). Но даже на лечение и использование различных лекарственных препаратов от расстройств психики и нервных заболеваний женщины реагируют часто иначе, чем мужчины, что не всегда учитывается при назначении препаратов.
14.2.1. Прогестерон и стресс
В организме человека основные программы выживания заложены в древней части мозга — стволовой и лимбической системе, которую часто называют мозгом рептилий, потому что эта часть мозга почти одинакова у них и всех других животных, находящихся в эволюционной классификации животного мира выше рептилий, в том числе человека. Лимбическая система имеет центр реакции человека на окружающий мир. Эта реакция может выражаться агрессией или доверием. Эта же часть мозга отвечает за процесс адаптации. Во многих экспериментах было обнаружено, что прогестерон является основным гормоном приспособления и выживания в условиях стресса. Очень многие люди знают, что существует гормон стресса — адреналин (эпинефрин), который вырабатывается мозговым веществом надпочечников. Это не просто гормональное вещество, его также называют нейротрансмиттером — адреналин является основным химическим веществом нервной системы, через которое передаются сигналы по нервным волокнам. Другой известный гормон стресса — норадреналин, или норэпинефрин, тоже вырабатывается надпочечниками. В действительности при возникновении стресса выделяется в первую очередь не адреналин, а норадреналин и кортизол. 90 % норадреналина используется нервной системой, а так как он распадается очень быстро (полураспад составляет 1.5–2 минуты), его воздействие на весь организм кратковременное — обычно первой реагирует сердечно-сосудистая система учащением сердцебиения (тахикардия) и повышением кровяного давления (гипертония). Кортизол вырабатывается корой надпочечников, и его называют глюкокортикоидом. Старое название кортизола — гидрокортизон (до сих пор используется в медицине для лечения многих заболеваний). Этот стероидный гормон не только усиливает действие норадреналина и адреналина, а значит, возникновение тахикардии и гипертонии, но и воздействует на многие органы. Так как полураспад гормона составляет 60–90 минут, это воздействие становится длительным. Чем большему стрессу подвергается организм человека, тем больше вырабатывается кортизола, и при его высоких концентрациях полураспад затягивается до двух часов. Поэтому кортизол считают наиболее вредным и агрессивным среди всех гормонов стресса. Основным источником кортизола является 17α-гидроксипрогестерон (17-ОПГ), который является метаболитом прогестерона и прегненолона. Одновременно 17-ОПГ является метаболитом кортизола, то есть реакция синтеза и распада кортизола идет через образование 17-ОПГ. Следует отметить, что 17-ОПГ является метаболитом и других стероидных метаболитов прогестерона и мужских половых гормонов. По одному повышенному уровню этого гормонального вещества нельзя делать выводы о том, что это повышение происходит из-за высокого уровня кортизола или андрогенов (и так многие врачи ошибочно ставят диагноз гиперплазии коры надпочечников). Исследования показали, что прогестерон выполняет защитную функцию при возникновении стресса путем уравновешивания выработки кортизола. При достаточном уровне прогестерона кортизола вырабатывается меньше, чем при нехватке прогестерона. Поэтому стрессовая ситуация при высоком уровне кортизола приводит к повреждению организма на разных уровнях, а также ускоряет процессы старения. Ведь не секрет, что люди, находящиеся в постоянной стрессовой ситуации, выглядят старше своего возраста. Также кортизол включает механизмы накопления и сохранения энергии, поэтому происходит аккумуляция жира, особенно в области живота, спины и бедер. Во время беременности уровень кортизола в сыворотке крови увеличивается не только за счет его предшественника — прогестерона. Беременность является стрессом для женского организма из-за большой скорости роста нагрузок и изменений в теле. Уровень кортизола повышается между 30 и 32 неделями беременности, что является начальным звеном созревания легочной ткани плода через стимуляцию выработки специального вещества — легочного сурфактанта. Повышение уровней глюкокортикоидов, особенно кортизола, ближе к концу беременности наблюдается у всех самок млекопитающих, при этом источником кортизола у разных животных может быть, как материнский организм, так и организм плода. Так как прогестерон играет роль в возникновении «замка» на уровне шейки матки, повышение уровня кортизола к концу беременности у женщин и у самок животных характеризует процесс снятия прогестероновой блокировки для укорочения, размягчения и открытия шейки матки и повышения сократительной функции мышц матки.14.2.2. Прогестерон и когниция
Слово «когниция» (cognition) редко используется в популярной литературе, но им часто пользуются психологи и психиатры для характеристики познавательного процесса у людей. Это слово происходит из двух слов: латинского cognition — познание, познавание и греческого gnόsis — знание, мышление, размышление. В медицине и психологии под когницией понимают познавательный процесс, или совокупность психических (ментальных, мыслительных) процессов получения, переработки и усвоения информации — восприятие, категоризация, мышление, речь, поведение. Когниция также включает осознание и оценку самого себя в окружающем мире, и оценку самого мира, что определяет поведение человека (поступки, отношение к людям и внешнему миру, а также к своему телу). То, что стероидные гормоны могут влиять на когницию и поведение человека, известно в течение нескольких десятков лет и было изучено в ряде клинических исследований и экспериментов. Наблюдение колебаний настроения, эмоционального фона женщин в течение менструального цикла показывает связь между изменениями уровней гормонов и когнитивной функцией женщин. Изменения уровней эстрогена и прогестерона влияют на память, как длительную, так и кратковременную. В первой половине фолликулярной фазы на фоне низких уровней гормонов улучшается память по восприятию информации из окружающей среды в отношении ориентации человека. На фоне повышенного уровня гормонов в первой половине лютеиновой фазы улучшается словесная (вербальная) и визуальная память, а также память по выполнению рутинных, привычных действий. Эмоциональная память связана с влиянием стероидных гормонов, особенно на лимбическую систему мозга, о которой упоминалось в предыдущем разделе. Формирование эмоций и чувств, связанное с функцией этой части мозга, связано с программами размножения, поиска пищи и выживания, реакции на окружающую среду и другие живые существа. Это эмоции, связанные со страхом, агрессивностью, раздражительностью, злостью, а также те, которые определяют сексуальное поведение — поиск сексуального партнера и получение сексуального удовлетворения. Миндальное тело лимбической системы является складом памяти — здесь сохраняются и «проходят чистку» все события, и обычно в памяти остаются те события, на которые у человека был определенный эмоциональный ответ: сильный испуг, чрезмерное переживание, большое удовольствие. О взаимосвязи гормонов стресса с эмоциями и эмоциональной памятью тоже давно известно. Ведь при испуге и переживаниях повышаются уровни кортизола, адреналина и норадреналина. Но небольшое повышение уровня, например, кортизола память улучшает, а выраженное повышение и длительное, наоборот, ухудшает. Норадреналин, который повышен во вторую фазу менструального цикла, тоже влияет на эмоциональную память женщины. Однако связь этих гормонов с когницией у женщин все же не настолько выражена, как у мужчин. Считается, что половые гормоны и прогестерон, особенно их колебания и пропорция, являются ключевым звеном в воздействии на поведение женщины, ее когницию, память, эмоции и чувства. В частности, расстройствами настроения, депрессией, стрессовым расстройством страдают чаще женщины, а не мужчины. В медицинской литературе существует очень мало данных о том, как женщина реагирует на внешние и внутренние раздражители в зависимости от менструального цикла. В то время как сам процесс менструального цикла изучен и описан досконально, вплоть до молекулярного уровня, в том числе какие изменения происходят в яичниках и матке, поведение и реакция женщины на колебания гормональных уровней, овуляцию и менструацию, практически не изучены. В ветеринарии и зоологии, наоборот, существует много данных о поведении животных как ответной реакции на изменения в их репродуктивной системе. Хотя в народе не за одно тысячелетие накопились наблюдения за состоянием и поведением женщин в зависимости от менструального цикла (нередко в виде шуток, песен, веселых историй), в медицине эта тема практически упущена, и только сейчас ей начали уделять больше внимания. Основная причина таких упущений связана с тем, что большинство специалистов рассматривают женщину и ее проблемы без учета особенностей пола. Даже если и имеются данные, что частота определенных заболеваний у женщин выше или ниже по сравнению с мужчинами, такая информация воспринимается как эпидемиологический факт, и лишь единицы пытаются связать такие отличия с особенностями функционирования женского тела и наличием определенных периодов, которых никогда не бывает у мужчин (менструации, беременность, послеродовый период, климакс). Состояние тревоги всегда основано на страхе, на боязни женщины чего-то или кого-то и питается за счет негативного мышления и негативных эмоций. Другими словами, это проекция внутреннего содержимого сознания на физическое тело и часто всего лишь самовнушение. В некоторой степени процесс аналитического мышления может контролировать доминирование тревоги и подавлять страх. Но у большинства людей такой вид мышления не развит до того уровня, когда человек не «слепо» воспринимает информацию, а рационально анализирует услышанное, увиденное, прочитанное, в том числе и свое поведение как результат реакции на информацию. Женщины — не исключение, и у многих лимбическая система мозга доминирует в своем влиянии на поведение женщины — она многого боится, у нее «хроническое» состояние тревоги, она раздражительна, она слепо доверяет толпе и часто закрыта для альтернативного взгляда на событие, явление и т. д. В медицине существует понятие патофизиологического и психобиологического процессов. Первый отражает процесс развития патологической реакции организма на что-то (на причину заболевания под влиянием факторов риска), процесс возникновения заболевания. Второй отражает реакцию и поведение индивидуума на психоэмоциональном уровне, что может усугублять или устранять патофизиологический процесс. У женщин реакция на предстоящую менструацию может вызвать паническое, тревожное состояние, что приведет к возникновению неадекватной реакции на уровне физического тела. И наоборот, появление определенных физических признаков перед менструацией может повлечь неадекватную психоэмоциональную реакцию. Таким образом, возникает порочный круг, в который попадает женщина часто из-за непонимания своей женской физиологии. Примеров, когда возникает дисбаланс психического и физического состояний среди женщин, множество, особенно среди тех, кто хочет беременности, и тех, кто ее панически боится, а также среди тех, кто не думает о нормальной беременности, но живет в постоянных страхах перед внематочной беременностью и самопроизвольным абортом (и фактически провоцирует такое состояние). Поведение некоторых женщин доходит до абсурда: за несколько дней до начала очередных месячных они начинают придираться к любому ощущению в их теле и реагировать на такие ощущения еще большим нагнетанием ситуации. Многие делают тесты на беременность по несколько раз в день, бегают на УЗИ, не выходят из кабинетов врачей. И вместо того чтобы успокоить женщину, объяснить особенности функционирования женского тела, врачи в большинстве случаев «находят» диагнозы, и нередко целые букеты диагнозов, и начинается новый порочный круг бесконечного обследования и лечения. Влияние менструального цикла на когницию, память, поведение женщины репродуктивного возраста изучалось поверхностно, и во всем мире проведено всего несколько исследований на эту тему. Большое внимание уделялось воздействию заместительной гормональной терапии на когницию и память женщин в постменопаузе. В одном из исследований использовался тест Bem Sex Roles Inventory (BSRI), который состоит из 60 характеристик (черт, качеств): 20 качеств, доминирующих у мужчин (амбициозность, независимость, агрессивность и др.), 20 качеств женственности (эмоциональность, чувствительность, аффективность и др.) и 20 нейтральных качеств и чувств (счастье, удовлетворение, уверенность и т. д.). Оказалось, что состояние «женственности» меняется с менструальным циклом незначительно — женщины остаются женщинами постоянно. Однако проявление «мужского» у женщин зависит от фазы менструального цикла — в предовуляторную фазу мужские качества понижаются, в период менструации, на фоне низких уровней гормонов, — повышаются. Менструация характеризуется большими переживаниями, раздражительностью, агрессивностью. Женщины более разговорчивы во второй половине цикла, а во время менструации «болтливость» достигает максимума. И такие показатели не исключают тот факт, что женщины пользуются словесно-аналитической стратегией для решения проблем в отличие от мужчин, которые предпочитают холистический путь решения. Словесно-аналитический, или вербально-аналитический подход подразумевает детализацию, заострение внимания на мелочах, в то время как холистический подход акцентирует внимание на целостности проблемы в первую очередь, а не на ее составных частях. Исследования также показали, что ближе к овуляции женщины становятся привлекательнее, вызывают больше внимания у мужчин, их тело выделяет специфические запахи, привлекающие мужчин. В период овуляции женщины одеваются ярче и красивее, чаще пользуются макияжем, носят одежду, которая меньше покрывает тело (больше открытых участков). Такое поведение определяется не только колебаниями гормонов в течение менструального цикла, а все еще сохранившимися инстинктами размножения, которые включают и инстинкты привлечения противоположного пола. Изучение влияния менструального цикла и колебаний гормонов на когнитивное состояние женщин и их поведение все еще требуют дополнительных исследований, но уже имеющиеся результаты показывают, что такое влияние существует и оно не опровергает ряд характеристик женского поведения и качеств женщин, подмеченных народом.14.2.3. Прогестерон и эмоции
Ранее упоминалось об эмоциональной памяти, а также о возникновении негативных эмоций, страха, тревоги у женщин в некоторых ситуациях, в том числе в зависимости от менструального цикла. Ряд исследований показал, что прогестерон и его метаболиты имеют модулирующий эффект на нейротрансмиттеры — серотонин и норадреналин, вовлеченные в регуляцию эмоций. Интересно, что согласно результатам, одного из исследований прогестерон оказался важнее для эмоционального фона мужчин, чем женщин. Если при исследовании женщин основное внимание концентрируется на влиянии прогестерона на репродуктивную функцию, то у мужчин изучается влияние гормона на функцию мозга (с целью улучшения этой функции). Аллопрегнанолон, или 3-α,5-α-тетрагидропрогестерон (ТГП), связывается с GABAA рецепторами, у которых доминируют α и δ субъединицы. Такие рецепторы наблюдаются чаще в лимбической системе мозга, которая контролирует эмоции. Нехватка этого метаболита или применение веществ, которые могут понижать чувствительность рецепторов к ТГП, приводит к возникновению тревожного поведения. Аллопрегнанолон имеет одну особенность: он очень быстро вырабатывается из прогестерона и, если он не использован, быстро распадается, поэтому его уровень полностью зависит от уровня прогестерона, циркулирующего в крови. А значит, к концу второй фазы количество ТГП значительно понижается, так как понижается количество прогестерона, что вызывает негативные эмоции, то есть реакцию на стрессовую ситуацию, если таковая возникает в этот период. Модели животных подтвердили взаимосвязь низкого уровня ТГП и поведения с доминированием страха и агрессии. Если вводить прогестерон в миндальное тело лимбической системы у крыс, у которых были удалены яичники (а поэтому был низкий уровень прогестерона), наблюдается значительное понижение тревоги, страха и агрессии в поведении животных. И наоборот, введение веществ, которые понижают выработку ТГП, повышает уровень тревоги и беспокойства, и такие животные стараются спрятаться от других, проводят меньше времени на открытой местности. Реакция у таких животных на стресс или шок затяжная, часто с отсутствием движений (застыли в страхе).14.2.4. Прогестерон и депрессия
О том, что у женщин часто бывают периоды плохого настроения, плаксивости, бессонницы, упадка сил, знали очень многие люди задолго до появления термина «депрессия», знают и сейчас. На тему депрессии существует немало анекдотов, она описана во многих литературных произведениях. С развитием науки и техники, когда жизнь людей становится намного комфортнее, чем у их прародителей, у людей начали исчезать не только навыки выживания в условиях дикой природы, но и появилось время для самокопания в себе, что повлекло за собой «моду» на многие расстройства психики. Выражение «Ах, у меня такая депрессия!» стало популярным атрибутом многих женщин и мужчин. Даже маленькие дети знают, что у их мам есть периоды «депрессии», когда к маме лучше не подходить и лишних вопросов не задавать. Применение антидепрессантов стало очередной модой, активно поддерживающейся фармацевтическими компаниями. Страдать от депрессии — неотъемлемый атрибут жизни современных людей. Правда, если сказать человеку, что он страдает психическим заболеванием, каковым является депрессия, то можно натолкнуться на чрезвычайно негативную реакцию и страшную обиду. «Я страдаю психическим заболеванием» — звучит как черное пятно сумасшествия, «ненормальности», но «я страдаю от депрессии» (у меня депрессия) — это модное и популярное выражение, которым пользуются даже подростки. Тем не менее, диагноз депрессии существует, и он действительно относится к расстройствам психики, или психическим заболеваниям. Первым, кто описал разницу между частотой случаев депрессии у женщин и мужчин, был английский писатель Чарльз Диккенс, который тоже страдал депрессией. Он изучил демографию больных, поступающих на лечение в одну из известных психиатрических больниц Лондона, и заметил, что чаще всего депрессией страдали женщины, о чем и упомянул в одной из своих публикаций. Он также заметил, что депрессия возникает чаще у представительниц определенных социальных слоев. Наблюдения Диккенса полностью совпадают с наблюдениями современных врачей. Такая частота случаев депрессии у женщин привела к появлению понятия «репродуктивная депрессия», возникновение которой связано с менструальными циклами, послеродовым и предклимактерическим периодами. Фактически эпизоды депрессии встречаются у женщин чаще всего в периоды гормональных перестроек, что наблюдается после родов и перед вхождением в климакс. Известно, что самая высокая частота депрессии у женщин в предменопаузе — за 2–3 года до прекращения менструаций. Триада — предменструальная депрессия, послеродовая депрессия и климактерическая депрессия — в 2009 году была названа репродуктивной депрессией, и ее появление связывают с колебаниями гормонов, вырабатываемых яичниками. Выделение репродуктивной депрессии в виде отдельного диагноза позволяет увидеть это состояние не как отдельный психиатрический диагноз, а во взаимосвязи функционирования женского организма в разные периоды жизни женщины, а также понять влияние половых и других стероидных гормонов на состояние женской психики. Так как эстрогенные и прогестероновые рецепторы имеются в тканях мозга, влияние половых гормонов и прогестерона на функцию мозга очевидно.14.2.4.1. Предменструальная депрессия
Выше упоминалось, что приблизительно у 10 % женщин предменструальное состояние может протекать по типу предменструального дисфорического расстройства (ПМДР), которое не только создает выраженный дискомфорт, но и приводит к нарушению работоспособности и жизнедеятельности женщин. Такое состояние требует своевременной диагностики и лечения. Депрессия, нарушение настроения, эмоциональные нарушения являются частью ПМДР. Многие врачи, такие как гинекологи и психиатры, не соглашаются с термином «дисфорический», который приравнивает предменструальный синдром в выраженной форме к психиатрическому заболеванию. Некоторые врачи предлагают сменить это название на «овариальный циклический синдром», акцентируя внимание на зависимости симптомов от функции яичников, а также цикличности появления симптомов. Механизм возникновения предменструальной депрессии неизвестен, хотя он такой же, как и у предменструального синдрома. Понижение уровня прогестерона во второй половине менструального цикла может быть триггером в возникновении симптомов депрессии. Как отличить предменструальную депрессию от биполярного аффектного расстройства, которое в прошлом называли маниакально-депрессивным психозом? Существуют определенные критерии постановки диагноза предменструальной депрессии: • симптомы появляются с каждым менструальным циклом; • депрессия исчезает с наступлением беременности; • симптомы депрессии появляются в послеродовом периоде в виде послеродовой депрессии; • с восстановлением менструального цикла после родов симптомы депрессии появляются перед каждой менструацией; • протекание депрессии ухудшается с возрастом, особенно в предклимактерическом периоде; • часто сопровождается другими жалобами, имеющими связь с менструальным циклом (менструальная мигрень, боль в молочных железах, вздутие живота); • период без симптомов составляет 7–10 дней в месяц, в основном в первой половине цикла. Лечение предменструальной депрессии подавлением овуляции с помощью комбинации эстрогенов и прогестерона (или прогестинов) или применением гормональных контрацептивов подтверждает связь этого вида депрессии с функцией яичников. Многие врачи считают, что назначение антидепрессантов для лечения предменструальной депрессии неуместно. Прогестерон практически не используется для лечения этого состояния, хотя были попытки его применения.14.2.4.2. Послеродовая депрессия
Этот вид депрессии часто остается не диагностированным, потому что после родов многие женщин находятся фактически в изолированном состоянии, будучи погруженными в новые заботы о новорожденном. Первые месяцы грудного вскармливания, привыкания и адаптации к появлению нового члена семьи требуют от женщин не только времени, но и дополнительных сил и энергии. Многие симптомы депрессии могут маскироваться под усталость после родов, недосыпания, переживания за процесс лактации и состояние ребенка, нарушения функции щитовидной железы. Послеродовые блюзы в отличие от депрессии возникают у многих женщин в первую неделю после родов, что связано с резкой гормональной перестройкой, и не всегда такое состояние требует применения антидепрессантов и другого вида лечения. Послеродовая депрессия появляется позже и может длиться весь послеродовый период, переходя в предменструальную депрессию. Внимание акушеров-гинекологов обычно обращено на состояние репродуктивных органов, и первый визит женщины к врачу чаще всего бывает не раньше 8–10 недель после родов. Но даже на приеме у врача женщины редко рассказывают о своих жалобах со стороны психики, описывают симптомы депрессии, а врачи чаще всего об этом и не спрашивают. Таким образом, послеродовая депрессия может остаться не диагностированной длительный период времени. Если женщина в послеродовом периоде обратится за помощью к психиатру или семейному врачу с жалобами на депрессию, связь между возникновением послеродовой депрессии и наличием в прошлом предменструальной депрессии может быть упущена. Поэтому в таких случаях самым частым видом лечения будут все те же антидепрессанты. В современных публикациях некоторыми врачами рекомендовалось использование прогестерона и прогестинов для лечения послеродовой депрессии. Однако большинство психиатров не признают альтернативных методов лечения депрессии, предлагая применять только антидепрессанты. Акушеры-гинекологи не имеют соответствующей подготовки в диагностике послеродовой депрессии, а тем более ее лечении. Заметим, что в ряде исследований показано, что применение эстрогенов может улучшить настроение и помочь в лечении послеродовой депрессии, в то время как некоторые виды прогестинов, наоборот, ухудшают протекание депрессии. Послеродовая депрессия однозначно требует пристального внимания ученых и врачей, потому что многие вопросы в отношении ее возникновения, диагностики и лечения до сих пор остаются без четких ответов.14.2.4.3. Климактерическая депрессия
Предклимактерический и климактерический период сопровождаются многочисленными симптомами, которые сами по себе могут вызывать немало негативных эмоций и чувств у женщин. Для многих людей неприятен и сам факт старения. Угасание функции яичников становится заметным — менструальные циклы нерегулярные, а со временем менструации прекращаются, появляется сухость влагалища, но довольно часто страхи вокруг состояния менопаузы являются искусственными. Климактерическим синдромом, сопровождающимся горячими приливами и другими неприятными симптомами, страдают чаще всего женщины развитых стран, где менопауза стала диагнозом, а не нормальным физиологическим состоянием женщины. Поэтому климактерическая депрессия тоже чаще встречается у женщин развитых стран, в основном жительниц городов. Особенность климактерической депрессии в том, что она появляется на фоне предменструальной депрессии, симптомы усиливаются за 2–3 года перед менопаузой, в истории женщин есть эпизод (ы) послеродовой депрессии. Заместительная гормональная терапия может помочь в устранении многих симптомом такой депрессии. Чаще всего эта категория женщин попадает в группу больных биполярным аффективным расстройством психики и основное лечение в виде антидепрессантов назначается психиатром. Гинекологи иногда лечат этот вид депрессии препаратами эстрогенов, однако большинство психиатров такой вид лечения не признают. Прогестины обычно назначаются в комбинации с эстрогенами, и их влияние на климактерическую депрессию не изучено. Репродуктивная депрессия — это новый диагноз, но его восприятие, скорее всего, будет принято в штыки большинством психиатров, потому что доминирующее значение в возникновении такого состояния отдается функции яичников, о которой у психиатров поверхностное представление. Гинекологами это состояние тоже будет диагностироваться редко, так как слово «депрессия» вызывает у большинства из них ассоциацию с психиатрическими болезнями. Сколько потребуется лет, чтобы на женский организм начали смотреть через призму функции его репродуктивных органов, неизвестно. Очевидно, еще долго женщинам придется «сидеть» на антидепрессантах.14.2.5. Прогестерон и мигрень
Мигрень, которая характеризуется приступами сильной головной боли, считается неврологическим заболеванием. Она встречается у 10–15 % женщин и редко у мужчин, поэтому мигрень принято называть «женской болезнью». А так как возникновение мигрени часто наблюдается с появлением менструальных циклов и в течение всей репродуктивной жизни женщины, взаимосвязь с половыми гормонами и другими стероидами очевидна. То, что мигрень относится к разряду неврологических заболеваний, приводит к тому, что ее лечением занимаются невропатологи, у которых знания о женской репродуктивной системе и ее гормональной регуляции поверхностное — это не их специальность. Поэтому связь между менструальными циклами, а также беременностью, периодами лактации, приемом гормональных контрацептивов и возникновением мигрени часто упускается из виду или игнорируется. Что современная медицина знает об этой связи и какую роль играет прогестерон в возникновении мигрени? Мигрень может возникать в любом возрасте женщины, но ее появление часто отмечают в подростковом возрасте с появлением менархе — первой менструации. Уровни эстрогенов и прогестерона у подростков практически не отличаются от уровней взрослых женщин. Уровни тестостерона и его метаболитов могут быть повышены, особенно в начале полового созревания. Появление головных болей и мигрени может наблюдаться у детей до начала полового созревания и уровни эпизодов мигрени одинаковы у мальчиков и девочек. Но как только появляется первая менструация, частота возникновения мигрени у девочек повышается в 2–3 раза по сравнению с мальчиками. Пик мигрени у подростков наблюдается в 12–13 лет и чаще всего она сопровождается аурой — рядом специфических симптомов-признаков, предшествующих возникновению головной боли. С 14 до 17 лет уровень мигрени падает, и она бывает чаще всего без ауры. Считается, что этот тип мигрени имеет большую зависимость от регулярных менструальных циклов. Несколько лет тому назад в классификации головных болей и мигрени появилась менструальная мигрень, которая характеризует зависимость мигрени от менструального цикла. Она включает два вида мигрени без ауры: мигрень, связанную с менструацией, и мигрень, возникающую вне менструации (месячных), или «истинную менструальную мигрень». Первый тип мигрени возникает за два дня до менструации или в первые три дня кровотечения. Второй вид мигрени возникает вне менструального кровотечения, но только во вторую половину цикла. До 50 % женщин, страдающих головными болями, имеют первый тип мигрени. Истинная мигрень встречается примерно у 20 % женщин с этим неврологическим заболеванием. У остальной части женщин с мигренью менструальная зависимость не наблюдается. Между менструальной и неменструальной мигренью существует большая разница. Менструальная мигрень возникает чаще и регулярнее, она проявляется более сильными головными болями, приводящими к значительному нарушению общего состояния и плохому самочувствию. Такие женщины нередко не в состоянии выполнять работу и даже простые функции, им требуется прием более сильных обезболивающих и других препаратов, многие из которых могут иметь абортивный эффект. Было проведено несколько исследований по измерению уровня половых гормонов и прогестерона у женщин, страдающих мигренью, для сравнения с уровнями гормонов здоровых женщин. Разницы в уровнях эстрогена и прогестерона найдено не было, за исключением незначительного повышения прогестерона в фолликулярную фазу. Но такое повышение пока что не находит объяснения, потому что менструальная мигрень возникает во вторую фазу — перед менструацией или во время менструации. Создание искусственной менопаузы (медикаментозной или путем удаления яичников) значительно улучшает состояние женщин и понижает уровень возникновения мигрени почти на 75 %. Почему возникновение мигрени зависит от менструального цикла? Точного ответа нет до сих пор. Поэтому в этой отрасли медицины существует много гипотез и теорий, а на их основании созданы многие схемы лечения, которые эффективны для одних женщин и совершенно неэффективны для других. Предполагается, что мигрень возникает из-за поломки на уровне ответной реакции мозга на колебания уровней половых гормонов. Теория эстрогеновой отмены связывает возникновение мигрени с понижением уровня эстрадиола перед месячными. Введение прогестерона перед месячными не понижает уровень мигрени. Наоборот, введение быстродействующих форм эстрогенов в середине лютеиновой фазы блокирует возникновение атак головных болей. Свойство эстрогенов подавлять приступы в предменструальный период используется с лечебной целью. Простагландиновая теория объясняет появление менструальной мигрени повышенным уровнем простагландинов во многих тканях женщины, в том числе мозговой, перед месячными и в первые дни менструации. Этот механизм объясняет возникновение болезненных менструаций. Применение противопростагландиновых препаратов может купировать приступы мигрени, а также снимать боли внизу живота во время месячных. Низкий уровень магния в крови женщин во второй половине цикла может быть причиной возникновения менструальной мигрени. Внутривенное введение солей магния понижает частоту возникновения головных болей. Прием таблетированных форм магния во второй половине цикла также предупреждает возникновение менструальной мигрени у многих женщин. Хотя в противопоказаниях по применению гормональных контрацептивов указана мигрень, исследования на эту тему, равно как и выводы после получения результатов, были проведены в 1970-х годах, на заре применения гормональной контрацепции. Первые противозачаточные препараты содержали по 50–100 мкг синтетического эстрогена — этинилэстрадиола. Современные препараты содержат от 15 до 35 мкг эстрогенов. Результаты прошлого показали ухудшение протекания мигрени у женщин, применявших КОК, но у одних приступы возникали на фоне приема активных таблеток (гормональных), а у других — в период 7-дневного перерыва или приема плацебо-таблеток. Согласно результатам современных исследований, у одних женщин наблюдается незначительное ухудшение протекания мигрени, у большинства это состояние остается неизменным, и у небольшой части женщин наблюдается улучшение. Во время беременности наблюдаются высокие уровни эстрогенов и прогестерона. Эти гормоны большей частью являются производными плаценты, то есть инородными, поэтому организмом женщины почти не усваиваются и быстро выводятся из него через почки и кишечник. Почти у половины женщин, страдающих мигренью до беременности, состояние улучшается в первом триместре, у более чем 80 % — во втором, а в третьем триместре почти 90 % женщин отмечает улучшение в отношении головной боли из-за мигреней. Практически 80 % женщин избавляются от мигрени с началом третьего триместра беременности. Другими словами, беременность лечит мигрень. У беременных женщин мигрень чаще бывает с аурой. Предсказать, у кого из женщин, страдающих мигренью, будет улучшение во время беременности, а у кого — нет, а возможно будет и ухудшение, нельзя, потому что до сих пор не найдены прогностические критерии, по которым можно определить потенциальных кандидатов мигрени. Считается, что высокий уровень прогестерона во время беременности оказывает обезболивающий эффект на ткань мозга. Но такой эффект может достигаться только в комбинации с высокими уровнями эстрогенов, что было доказано в экспериментах на животных. Несмотря на то, что после родов уровни эстрогенов и прогестерона резко понижаются, и отмечается их физиологическая недостаточность из-за высокого уровня пролактина, мигрень не наблюдается у большинства женщин в течение первых послеродовых месяцев. Исследования показали, что те женщины, которые кормят грудью, почти в 100 % случаев не имеют приступов мигрени в первый месяц после родов, и количество приступов не выше уровня второго триместра. Наоборот, женщины, которые перешли на искусственное кормление, в 40 % случаев испытывали приступы головных болей в первый послеродовый месяц. Регулярное грудное кормление создает у 70 % женщин состояние лактационной аменореи в течение первых шести месяцев после родов. Это состояние сопровождается ановуляцией и отсутствием менструаций. Считается, что повышение уровня прогестерона во вторую фазу менструального цикла может оказывать защитный эффект для предотвращения приступов мигрени. Исследования показали, что назначение синтетического прогестерона женщинам предклимактерического возраста (за 2–8 лет до возникновения климакса) понижает частоту возникновения мигрени, что можно объяснить также возникновением ановуляции при приеме прогестинов. Негативными эффектами длительного приема прогестинов являются появление болезненности в молочных железах и прорывные кровотечения. Применение имплантатов и инъекций прогестинов с длительным действием, напротив, приводит к учащению приступов мигрени. В комбинации с эстрогеном прогестерон повышает частоту мигрени, особенно у женщин в постменопаузе, что является частным побочным эффектом заместительной гормональной терапии. Поэтому по мнению ученых и врачей, участие прогестерона в возникновении или подавлении приступов мигрени зависит от многих факторов и пока что непредсказуемо в большинстве клинических случаев.14.2.6. Прогестерон и эпилепсия
Эпилепсия — это одно из заболеваний, где прогестерон нашел применение в первую очередь для лечения женщин. Судороги не возникают спонтанно и хаотично, а обычно более чем в 50 % случаев имеют определенный кластер (паттерн). У 35 % женщин наблюдается ритмичность в возникновении эпилептических припадков, что является результатом влияния менструального цикла, в частности стероидных гормонов и циклических изменений их уровней. При наличии овуляторных циклов наблюдается строгая зависимость между возникновением судорог и соотношением уровней эстрогенов и прогестерона. Они чаще возникают перед овуляцией и реже всего наблюдаются в середине второй фазы, то есть на пике уровня прогестерона. Перед менструацией частота судорог тоже увеличивается, что является результатом понижения уровня прогестерона. У женщин с ановуляторными циклами, когда уровни прогестерона низкие на протяжении всего цикла, эпилептические припадки возникают в любой день цикла. Прогестерон и прогестины используют в лечении эпилепсии уже не одно десятилетие. Существует две схемы лечения: первая схема направлена на поддержку лютеиновой фазы и медленное понижение дозы прогестерона перед менструацией, вторая схема заключается в создании искусственной менопаузы, когда нет колебаний гормонов. Такое лечение уменьшает частоту возникновения судорог на 40–50 %.14.2.7. Прогестерон и сон
Так как известно, что некоторые метаболиты прогестерона могут оказывать седативное действие, у многих исследователей и врачей не раз возникал вопрос о влиянии прогестерона на сон, поскольку одним из побочных эффектов экзогенного прогестерона является сонливость. Можно ли использовать прогестерон для лечения бессонницы? Исследования показали, что эндогенный прогестерон, вырабатываемый у женщин в лютеиновую фазу в большом количестве, не влияет на циклы сна и бодрствования мозга, а также на выработку гонадотропинов, ТСГ и пролактина во время сна и активности. Таким образом, натуральный прогестерон, вырабатываемый женским организмом, влияния на сон не оказывает. Экспериментальное исследование с контрольной (плацебо) группой, в котором изучались изменения гормональных уровней во время сна и бодрствования при использовании экзогенного прогестерона, показало интересные результаты. Недостатком этого исследования было небольшое количество участников — 8 женщин в климактерическом периоде. Эти женщины не страдали расстройствами сна, однако сон в лабораторных условиях нарушался периодическими заборами венозной крови для определения уровней гормонов и полиграфическим измерением активности мозга у некоторых участников. В течение первых суток исследований сон не был нарушен ни у женщин, которым вводили прогестерон, ни у тех, кто был в контрольной группе. Сон на вторые сутки сопровождался дискомфортом из-за внутривенных катетеров, однако в «прогестероновой группе» после введения гормона нарушений сна было меньше. Ученые предположили, что прогестерон не влияет на качество сна у женщин, не страдающих бессонницей, то есть когда сон в норме, но оказывает эффектпри нарушениях сна. Качество сна зависит также от дозы прогестерона, и влияние гормона на сон может оказаться противоположным при употреблении малых и высоких доз. У мужчин после введения единичной дозы прогестерона увеличилась продолжительность 1–3-й стадий медленного сна. У женщин в постменопаузе администрация прогестерона сопровождалась уменьшением расстройств сна вследствие увеличения выработки гонадотропинов и уменьшением уровня ТСГ (ТТГ), что связывают с влиянием гормона на GABA-систему, о которой упоминалось раньше. Но воздействие прогестерона оказалось положительным только в тех случаях, когда расстройство сна возникало из-за раздражителей внешней среды. Влияние прогестинов на сон и его расстройства не изучалось. Также неизвестно воздействие комбинаций прогестерона, прогестинов и эстрогенов на сон человека.14.2.8. Прогестерон и болезнь Альцгеймера
Процесс старения сопровождается многими изменениями в организме человека. Возраст является изолированным фактором высокого риска развития многих заболеваний, в том числе болезни Альцгеймера. Когда-то это заболевание называлось сенильной, или старческой деменцией, но позже оно было выделено в особый вид деменции — альцгеймеровской, названной так в честь немецкого психиатра, описавшего это заболевание в 1906 году. Чаще всего болезнь Альцгеймера встречается после 65–70 лет, но существуют редкие формы более раннего развития заболевания. Так как в процессе старения меняются уровни гормонов, вопрос о том, как влияют половые гормоны и прогестерон на прогресс или регресс этого вида деменции, интересует многих ученых и врачей, тем более что влияние эстрадиола и прогестерона на работу мозга изучается уже длительный период времени. С менопаузой у женщин понижаются уровни эстрадиола, прогестерона, тестостерона. Замечено, что у женщин с резким падением уровней этих гормонов после наступления менопаузы риск возникновения болезни Альцгеймера выше, чем у тех, чьи уровни гормонов понижаются постепенно. Половые гормоны проявляют защитное действие на клетки мозга, а с понижением уровней гормонов повреждение нейронов увеличивается. Прогестерон является регулятором риска возникновения болезни Альцгеймера, потому что без него защитное воздействие эстрадиола на клетки мозга будет слабым. Хотя роль прогестерона в развитии или предупреждении этого заболевания еще глубоко не изучена, но известно, что добавление прогестерона или прогестинов к схемам лечения эстрогенами (фактически создание схемы заместительной гормональной терапии) значительно повышает лечебный эффект эстрогенов. Но вместе с тем комбинации с разными видами прогестинов оказывают разные эффекты на когницию, память, процесс мышления женщин в постменопаузе. Данные о том, что ЗГТ может улучшить когницию женщин, противоречивы, достоверных данных не хватает из-за того, что при наличии большого количества исследований на эту тему использовались разные виды прогестинов, в разных комбинациях с эстрогенами, а также разные формы гормонов и разные пути администрации. Сравнительный анализ полученных данных провести невозможно. И отсутствие надежных данных не позволяет использовать ЗГТ для лечения болезни Альцгеймера у женщин. Чаще всего для лечения этого вида деменции используют комбинации эстрогенов и андрогенов, реже — только эстрогенов. У мужчин нередко применяют андрогены для лечения болезни Альцгеймера, и эффект такого лечения лучше, чем у женщин эстрогенами. Поэтому многие врачи рекомендуют применять женщинам тестостерон, а не эстроген. Прогестерон до сих пор остается в стороне при лечении этого заболевания. Использование половых гормонов и прогестерона в лечении болезни Альцгеймера требует проведения объемных, хорошо организованных клинических исследований.14.3. Прогестерон и иммунная система
В течение длительного периода времени предпочтение отдавалось изучению влияния эстрогенов, в том числе синтетических форм, на защитные или иммунные силы женщины. В последнее десятилетие повышается интерес к прогестерону и прогестинам. Как уже упоминалось, между организмом женщины и мужчины имеется половое различие, или половой диморфизм. Но оказывается, что такие различия наблюдаются и в работе иммунной системы. Известно, что женщины чаще страдают аутоиммунными заболеваниями, чем мужчины. Поэтому все большее внимание исследователей заостряется на изучении воздействия стероидных гормонов, в частности тестостерона, эстрогенов и прогестерона, на работу всех уровней защитной системы человека. Эти гормоны могут действовать на иммунные клетки напрямую или же на ткани, у которых возникает реакция с вовлечением иммуностимуляторов. Прогестерон не только влияет на иммунные клетки, иммунные ткани и органы через прогестероновые рецепторы, находящиеся в них, но и принимает участие в аутоиммунных процессах. Механизм его участия в воспалительных и аутоиммунных процессах значительно отличается от механизмов воздействия эстрогенов и тестостерона. Он действует независимо от других гормонов, особенно на уровне репродуктивной системы, но вместе с тем соотношение прогестерона и половых гормонов играет важную роль в этом воздействии. При разных обстоятельствах с учетом пропорции гормонов прогестерон может быть другом или, наоборот, врагом для разных клеток и тканей женского организма. Прогестерон оказывает противовоспалительное действие, особенно на ткани репродуктивной системы. Поэтому перед менструацией, когда его уровень падает, в матке начинаются процессы неинфекционного воспаления, что необходимо для отторжения старого эндометрия и начала роста нового. В тканях матки появляется и большое количество разных видов лейкоцитов. Однако использование инъекций прогестерона с целью контрацепции, а также применение синтетических производных прогестерона длительного действия (Депо-Провера), значительно повышает риск заражения ВИЧ-1 инфекцией. Повышение риска связано с нарушением защиты слизистой оболочки, подавлением выработки противовирусных интерферонов и угнетением функции Т-лимфоцитов. При беременности, наоборот, очень высокие уровни прогестерона могут подавлять защитные силы организма, но не на уровне тканей репродуктивной системы, а на клеточном уровне иммунологической системы, и важную роль в этом играет также и хорионический гонадотропин. Синергизм ХГЧ и прогестерона позволяют материнскому телу принять плодное яйцо и выносить плод в течение 9 месяцев, несмотря на его инородность. Лейкоцитоз, который наблюдается при беременности, является компенсаторной защитной реакцией на действие прогестерона. Сэр Питер Медавар, известный иммунолог прошлого столетия, который занимался вопросами пересадки органов и тканей, рассматривал беременность как уникальное состояние иммунной системы, когда плод (с плацентой и оболочками) и мать являются двумя совершенно разными организмами — инородными телами по отношению друг к другу. С одной стороны, плод стремится избежать защитной атаки со стороны матери, поэтому плацента становится определенным барьером в «общении» с женским телом. Вместе с детским местом вырабатывается большое количество веществ, особенно прогестерона, что должно в совокупности оказать иммуноподавляющиее действие на защитные силы матери и дать плоду возможность не только выжить в чужеродной окружающей среде, но и успешно развиваться до того состояния, когда он сможет самостоятельно выжить за пределами женского организма. С другой стороны, материнский организм далеко не подавлен иммунологически. Напротив, в нем повышаются многие защитные процессы в крови и тканях, в том числе в матке, появляется большое количество иммунных клеток (антитела, лейкоциты). Женская иммунная система в период беременности способна подавить многие воспалительные и аутоиммунные процессы. Другими словами, плод не является иммунологически инертным, а мать — иммунологически подавленной. Наоборот, беременность необходимо рассматривать как состояние повышенного иммунитета.14.3.1. Прогестерон и системные аутоиммунные заболевания
Многие аутоиммунные заболевания имеют тесную связь не только с половой принадлежностью организма, то есть хромосомными и генными особенностями, но и с уровнями прогестерона и других стероидных гормонов, особенно их пропорциями. Действительно, врачи хорошо знакомы с понятием риска развития аутоиммунных заболеваний в зависимости от гормонального статуса человека. Но на клеточном и молекулярном уровне эти взаимоотношения еще не изучены. Между понятием аутоиммунности и аутоиммунными заболеваниями имеется большая разница. В процессе роста и жизнедеятельности клетки и органы постоянно повреждаются, поэтому требуют постоянного ремонта — начиная от молекулярного уровня, заканчивая органным. Задача иммунной системы состоит в том, чтобы вовремя обнаружить поломку и свести к минимуму ее влияние на соседние клетки и органы, как и на весь организм в целом. И не только ограничить это воздействие, но и навести порядок, то есть устранить поврежденные и нефункционирующие (фактически мертвые) клетки и их составные части. Аутоиммунность подразумевает появление аутореактивных лимфоцитов, которые могут проявлять защитную функцию. Нередко аутоиммунность сопровождается образованием антител, которые не оказывают негативного влияния на функцию ткани или органа. Например, специфические антитела к ткани щитовидной железы могут находить у людей с нормальной ее функцией. Антитела, которые часто находят у больных ревматоидным артритом и волчанкой, могут также циркулировать в крови совершенно здоровых людей, не принося никакого вреда. Поэтому, когда говорят об аутоиммунном заболевании, подразумевают активный процесс повреждения клеток и тканей с нарушением их функции. Когда речь идет об аутоиммунном заболевании у женщин, всегда важно отличить истинный аутоиммунный процесс, ведущий к повреждению тканей, от природного или физиологического аутоиммунного процесса, вызванного колебаниями стероидных гормонов. Известно также, что во время беременности многие аутоиммунные процессы утихают, что связано с высоким уровнем прогестерона и другими веществами беременности.14.3.1.1. Системная красная волчанка
Системная красная волчанка (люпус) относится к редким заболеваниям, и ею страдает от 2 до 100 на 100 000 человек населения — уровни заболеваемости зависят от региона и этнической принадлежности. Но в 90 % всех зарегистрированных случаев люпусом страдают женщины детородного возраста. Если учесть эти особенности распространения заболевания, становится очевидным, что такой феномен тесно связан не только с половыми отличиями женщин и мужчин на генетическом уровне, но также с разницей в уровнях половых гормонов и прогестерона. Влияние эстрогенов на возникновение волчанки изучено лучше, чем влияние прогестерона. Известно, что системная красная волчанка (СКВ) появляется у девочек подросткового возраста с наступлением менархе. Поэтому считается, что появление чувствительности к стероидными гормонам и гонадотропинам в этом возрасте является тем триггером, который провоцирует развитие волчанки. Исследования также показали, что применение гормональных контрацептивов или заместительной гормональной терапии повышает риск возникновения волчанки в 1.5–3 раза. Другие данные говорят о том, что прогестиновые контрацептивы, наоборот, понижают риск возникновения этого аутоиммунного заболевания, однако эти данные требуют дополнительной клинической проверки. Влияние эстрогенов и прогестерона на возникновение системной красной волчанки необходимо изучить детально. Но уже известно, что у женщин, страдающих СКВ, уровень прогестерона в лютеиновую фазу ниже показателей здоровых женщин. Также обнаружен особый вид гена, наличие которого повышает риск возникновения волчанки. Этот ген вырабатывает белок, который является ко-активатором прогестероновых рецепторов и других стероидных гормонов. Как выражается эта взаимосвязь между прогестероном и развитием волчанки пока неизвестно.14.3.1.2. Ревматоидный артрит
Ревматоидный артрит относится к системным аутоиммунным заболеваниям, однако очень часто его диагностируют неправильно и лечат как обыкновенное воспаление суставов. Но в то же время этот диагноз выставляют в случаях совершенно других воспалительных и дегенеративных процессов костно-мышечной системы. Поэтому данные о распространении ревматоидного артрита противоречивы. Так как доля населения старшего возраста значительно возросла во многих развитых странах, считается, что от 16 до 25 % людей страдает разными видами артрита. Ревматоидным артритом поражено от 0.5–1.5 % людей. Женщины болеют этим заболеванием в 2–3 раза чаще мужчин, поэтому врачей интересует вопрос взаимосвязи половых и других стероидных гормонов с возникновением этого аутоиммунного заболевания. Известно, что при возникновении ревматоидного артрита в крови появляется ревматоидный фактор и антинуклеарные антитела, но далеко не у всех больных (30 %). Одновременно, у 10 % здоровых людей тоже могут быть антитела и повышенный ревматоидный фактор. Ревматоидный фактор (РФ) относится к аутоантителам, он может связываться с другими антителами, в частности с IgG, формируя иммунный комплекс. Существует несколько видов РФ, образованных из разных белков, в том числе из других видов антител. Поэтому РФ может быть повышен и при других состояниях и заболеваниях, но чаще всего это случается при воспалениях, вызванных вирусной инфекцией. Фактически название «ревматоидный фактор» является ошибочным и устаревшим, но им до сих пор пользуются в практической медицине. О влиянии прогестерона на развитие и протекание ревматоидного артрита имеется очень немного данных. Однако известно, что чем больше у женщины было беременностей и родов, тем больший защитный эффект существует в отношении развития этого заболевания, хотя эти данные оспариваются некоторыми учеными. Гормональные контрацептивы не влияют на протекание ревматоидного артрита, как и препараты заместительной гормональной терапии. Высокие уровни гормонов во время беременности, наоборот, подавляют развитие и вызывают стойкую ремиссию ревматоидного артрита. В послеродовом периоде, когда уровни гормонов значительно понижаются, наблюдается повышенная активация ревматоидного процесса.14.3.1.3. Рассеянный склероз
Рассеянный склероз (РС) нередко относят к неврологическим заболеваниям, хотя это системное аутоиммунное поражение миелиновых оболочек нервных волокон головного и спинного мозга. Причина возникновения и развития заболевания до сих пор неизвестна. Рассеянный склероз не имеет ничего общего со старческим склерозом, так как может возникать у подростков и молодых людей. Чаще всего РС страдают женщины, и первые признаки заболевания могут появляться с наступлением менархе в 15 лет. Обычно симптомы возникают в районе 30-летнего возраста. У женщин это заболевание встречается в два раза чаще, чем у мужчин. Считается, что стероидные гормоны значительно влияют на развитие и протекание рассеянного склероза. Беременность оказывает благоприятный эффект на это заболевание, а в послеродовом периоде наоборот наблюдается активация аутоиммунного процесса. Очевидно, прогестерон проявляет защитное действие на миелиновые оболочки нейронов и усиливает их восстановление. Поэтому прогестерон начали использовать в лечении рассеянного склероза, особенно на начальных стадиях.14.3.2. Астма
Зависимость приступов астмы от менструального цикла замечена давно, но долгое время этот феномен не изучался. Современная классификация заболеваний включает такую разновидность астмы, как предменструальная астма (ПМА), которая наблюдается у 30–50 % женщин, страдающих этим недугом. Если в возникновении классической астмы замешан аллергический фактор (реакция организма на аллерген), то причина появления приступов удушья перед менструацией неизвестна. Исследования показали, что различий в уровнях эстрогенов и прогестерона у здоровых женщин и страдающих астмой не существует. Гормональная терапия с целью подавления частоты приступов астмы производит противоречивый эффект — одним женщинам помогает, другим — нет, у третьих может усугублять проблему. Поэтому предполагается, что предменструальная астма является результатом нарушения ответной реакции женского организма на изменение пропорции половых гормонов и прогестерона и падение их уровней перед месячными, а не на количество гормонов в крови. Несмотря на изучение предменструальной астмы, роль стероидных гормонов в ее возникновении непонятна и вызывает споры между врачами-исследователями. Изменения уровней гормонов могут вызывать определенную воспалительную реакцию в дыхательных путях. Известно, что эстроген имеет положительное влияние на бронхолегочную систему, хотя такие данные опровергаются некоторыми учеными. Процесс заживления и восстановления тканей и уменьшение воспалительной реакции чаще наблюдается в фолликулярную фазу цикла — на фоне роста эстрогенов. Хотя прогестерон тоже имеет противовоспалительное действие, его понижение перед месячными активирует воспалительные процессы в органах репродуктивной системы, что необходимо для нормального протекания менструации. Не исключено, что именно падение уровней гормонов является триггером в возникновении приступов предменструальной астмы Профилактики и лечения предменструальной астмы с учетом колебаний стероидных гормонов и их использования индивидуальным подбором гормона и дозы не существует. В этом направлении врачам еще предстоит поработать.14.3.3. Тиреоидиты
Прогестерон воздействует на щитовидную железу и может привести к нарушению ее функции. Именно поэтому беременность часто сопровождается гипотиреоидным состоянием, что является результатом высоких уровней как прогестерона, так и эстрогенов. У небеременных женщин дополнительные дозы прогестерона могут привести к возникновению гипертиреоза, и наоборот, нехватка прогестерона на фоне повышенных уровней эстрогенов (повышение может быть относительным только по отношению к низкому уровню прогестерона) приводит к развитию зоба и гипотиреоза. Поэтому до назначения прогестерона необходимо провести обследование щитовидной железы и корректировку ее функции, если есть нарушения. Аутоиммунный тиреоидит — распространенное заболевание щитовидной железы, которое изучается уже не один десяток лет. Существует две формы аутоиммунного тиреоидита — болезнь Грейвса и болезнь Хашимото. Болезнь Грейвса называют диффузным токсическим зобом, или базедовой болезнью. Она часто сопровождается увеличением размеров щитовидной железы и повышенной выработкой тироидных гормонов. Ею болеют в основном женщины — в 8 раз чаще, чем мужчины. В постсоветской медицине болезнь Грейвса относят к нарушениям функции щитовидной железы, а фактор аутоиммунности чаще всего не учитывается. Иногда врачи называют такое состояние одним словом — зоб. Болезнь Хашимото, наоборот, характеризуется пониженной функцией щитовидной железы, хотя могут наблюдаться периоды гипертиреоидизма тоже. Первоначально этот вид тиреоидита называли лимфоцитарным тиреоидитом, аутоиммунным тиреоидитом, лимфатическим аденоидным зобом. Это заболевание тоже чаще встречается у женщин — в 15–20 раз чаще, чем у мужчин. Считается, что это заболевание имеет генетическую связь, а человеческий лейкоцитарный антиген (HLA) играет одну из главных ролей в возникновении тиреоидита. Длительный период времени между врачами шли споры о взаимосвязи между болезнью Грейвса и болезнью Хашимото, но согласно современной классификации заболеваний эти два состояния щитовидной железы относят к системным аутоиммунным заболеваниям и называют двумя разновидностями аутоиммунного тиреоидита, потому что они сопровождаются выработкой аутоантител на ткань щитовидной железы. Появление этих антител может наблюдаться за несколько лет до первых признаков нарушения функции щитовидной железы. Так как аутоиммунным тиреоидитом болеют чаще всего женщины, существует выраженная связь между половыми гормонами и возникновением этого заболевания. До подросткового возраста случаи аутоиммунного тиреоидита у детей чрезвычайно редки, и частота заболевания у девочек и мальчиков одинакова. Но с наступлением полового созревания и появлением менархе уровень заболеваемости среди девушек и женщин значительно повышается. Беременность влияет на аутоиммунный тиреоидит негативно, и чем чаще женщина беременеет и рожает, тем у нее выше риск развития аутоиммунного тиреоидита. Одновременно тиреоидит негативно отражается на беременности. Антитела к щитовидной железе могут проникать через плаценту и поражать эмбрион, особенно ткани щитовидной железы и мозга. Известно, что у женщин, страдающих аутоиммунным тиреоидитом, особенно с гипофункцией железы, уровень спонтанных потерь беременности и невынашивания выше по сравнению со здоровыми женщинами. Только у небольшого количества женщин болезнь Грейвса может затихать во время беременности, но после родов снова обостряется. Гормональные контрацептивы оказывают защитное действие на щитовидную железу, и преимущество отдается эстрогенам и их положительному воздействию на этот эндокринный орган. Прогестерон, наоборот, повышает уровень антитиреоидных антител и риск возникновения тиреоидита. Почему прогестерон повышает риск развития одних аутоиммунных состояний и понижает риск развития других, неизвестно. Но скорее всего, это связано с вовлечением веществ, которые по-разному взаимодействуют с прогестероном, в частности разных классов и подклассов антител.14.4. Прогестерон и мочевыделительная система
Продолжительное время роль половых гормонов в функции мочевыделительной системы не была изучена. Однако при наблюдении беременных женщин было замечено, что высокие дозы прогестерона приводят к задержке калия в организме, а также к возникновению устойчивости (нечувствительности) к альдостерону — основному гормону надпочечников, отвечающему за обмен NaCl — соли, без которой жизнь клеток и организмов невозможна. Прогестерон поэтому является антагонистом альдостерона.14.5. Прогестерон и сосуды
Известно, что прогестерон действует на гладкие мышцы матки, расслабляя их, но он также воздействует на эндотелиальные клетки сосудов и нервные клетки, на макрофаги и тромбоциты. Кроме того, механизмов воздействия на клеточном и молекулярном уровнях у прогестерона несколько: через стероидные ядерные рецепторы, через рецепторы и взаимодействие с мембраной клеток и изменение ее электрической проводимости, через обмен ионов кальция, через вовлечение многочисленных белков и других органических веществ, в том числе киназ, энзимов, синтаз. Сразу же после менструации с началом фолликулярной фазы растущий уровень эстрадиола вызывает пролиферацию эпителиальных и стромальных клеток эндометрия, а также стимулирует рост сосудов посредством выработки васкулярного эндометриального фактора роста (ВЭФР) стромальными клетками. В лютеиновой фазе прогестерон вызывает децидуальную реакцию вокруг сосудов. Специальный белок (ангиопротеин-1) является стабилизатором сосудов и одновременно блокирует их чрезмерное разрастание, что также поддерживается прогестероном. Другим веществом белковой природы, которое вырабатывается децидуальным эндометрием под воздействием прогестерона, является тканевой фактор (ТК), играющий очень важную роль как рецептор для фактора коагуляции VII и его активной формы VIIа. Соединение ТК с факторами коагуляции провоцирует цепочку тромбообразования. Поэтому вторая фаза цикла и беременность характеризуются повышенным физиологическим уровнем свертываемости крови. В середине лютеиновой фазы, когда повышается пик гормона и начинается имплантация, у женщины наблюдаются максимальное гемостатическое состояние (наименьший шанс кровопотери), максимальная активность веществ, понижающих распад фибрина (а значит, повышающих образование тромбов), и подавление веществ с протеолитическим действием (расщепляющих клетки). Эти механизмы действия прогестерона важны для защиты матери от агрессивно внедряющегося хориона плодного яйца: с одной стороны, подавленная протеолитическая активность помогает ему легче имплантироваться, но, с другой стороны, кровотечение, которое может наблюдаться из-за разрушения хорионом микрососудов эндометрия, контролируется повышенными кровеостанавливающими механизмами (гемостазом). Также глубокое проникновение трофобласта в ткани эндометрия и матки строго контролируется прогестероном. В местах нарушенного эндометрия (после абортов, рубцов после операций), где усвоение прогестерона нарушено, может наблюдаться врастание трофобласта, что может проявиться патологией плаценты (placenta accreta и др.). Если беременность не возникла, быстрое понижение прогестерона приводит к изменению среды эндометрия в сторону повышенной кровоточивости сосудов, что необходимо для возникновения менструации. Все эти процессы строго регулируемые и контролируемые и протекают синхронно.14.5.1. Прогестерон и маточный гемостаз
Все абнормальные кровотечения матки можно условно разделить на две группы по механизму развития: (1) кровотечения, в которых наблюдается нарушение эндометриального гемостаза, (2) кровотечения, в которых нарушены строение и функция эндометриальных сосудов в результате повреждения или нарушения ангиогенеза. Нарушения гемостаза проявляются обильными (тяжелыми) менструальными кровотечениями, которые в 11 % случаев начинаются с менархе в подростковом возрасте. Болезнь Виллебранда, при которой нарушается выработка фактора фон Виллебранда, важного фактора свертываемости крови, встречается в 20 % случаев меноррагии. Использование контрацептивов, особенно прогестинов пролонгированного действия (например, Мирена, Депо-Провера), тоже приводит к возникновению абнормальных маточных кровотечений. Кровотечения связаны с формированием больших тонкостенных сосудов, несмотря на повышенный уровень тканевого фактора. При этом также наблюдается большое количество незрелых сосудов и частично зрелых сосудов, а также густота их распределения. Это множественные кровоточивые сосуды, легко повреждающиеся и ломающиеся, что приводит к возникновению прорывных кровотечений на фоне длительного использования прогеcтинов. Процессы свертываемости крови и гемостаза при этом не нарушены. В тканях эндометрия также наблюдается повышенный уровень окислительных процессов и образования веществ, повреждающих эндометрий. У женщин, имеющих миомы и полипы, тоже отмечаются абнормальные кровотечения, как во время менструации, так и между ними. Около одной трети женщин с полипами и миомами жалуются на кровотечения. Не все миомы сопровождаются кровотечением, потому что в большинстве случаев они находятся вне эндометрия (субсерозно или интерстициально). Субмукозные миомы находятся в полости матки в тесном соприкосновении с эндометрием. Установлено, что классическая кровоточащая миома является сосудистой опухолью, имеющей расширенные варикозно венозные сосуды — venous ectasia. Это объясняется повышенной активацией эстрогенных рецепторов, опухолевого фактора и ряда других факторов, влияющих на функцию сосудов (фибропластический фактор роста, связанный с гепарином эпидермальный фактор роста, паратиреоидный гормон, пролактин и др.). Расширенные венозные сосуды кровоточат больше во время месячных. В отличие от миом полипы чаще характеризуются кровотечением вне менструации, то есть метроррагиями. Механизм возникновения кровотечения при полипе неизвестен. Исследование полипов показывает повышенную микроциркуляцию крови в них, а также наличие сосудов с нарушенной структурой. Эти сосуды расширенные, тонкие и легко кровоточивые.14.5.2. Нарушения свертываемости крови
Беременность сопровождается физиологическими изменениями крови, качества которой кардинально меняются. С одной стороны, во время беременности женщина может чаще кровоточить. С другой стороны, в системе свертываемости (коагуляции) наблюдается тенденция к тромбообразованию, особенно в конце беременности. Большинство наследственных заболеваний, связанных с кровотечениями, при беременности протекают без обострения. Нормальная беременность ассоциируется с постепенным увеличением нескольких коагуляционных факторов: фибриногена, VII, VIII, X, XII, фактора Виллебранда (VWF), особенно в третьем триместре. Другие факторы (II, V, IX, XI и XIII) увеличиваются незначительно, или их уровень не меняется. При беременности также повышаются фибринолитические ингибиторы PAI-1 и PAI-2 и тканевой активатор плазминогена — вещество, которое играет важную роль в тромбообразовании. Количество свободного белка S, подавляющего коагуляцию, уменьшается, тромбин-антитромбиновый комплекс (ТАТ) и Д-димер тоже увеличиваются. Показатели большинства факторов коагуляции возвращаются в норму не раньше 8 недель после родов. Кровь беременной женщины становится вязче, несмотря на больший объем плазмы. Концентрация тромбоцитов, наоборот, понижается на 10 % и наблюдается физиологическая тромбоцитопения, чаще в третьем триместре. Такие изменения в крови важно учитывать в правильной постановке диагноза, потому что большинство лекарственных препаратов при беременности противопоказаны, а неграмотное вмешательство в систему свертываемости крови у беременных может закончиться катастрофическими последствиями как для женщины, так и для плода. Все заболевания системы свертываемости крови у беременной женщины можно разделить на те, которые сопровождаются кровотечением (тромбоцитопении, наследственные заболевания крови, сопровождающиеся кровотечением, обретенная гемофилия, тромболитические микроангиопатии), и те, которые сопровождаются повышенным тромбообразованием (тромбофилии). Высокие уровни прогестерона опасны прежде всего тромбообразованием, поэтому заболевания, при которых наблюдается образование тромбов, представляют больший риск для беременной женщины в ходе беременности. Во время родов нарушения свертываемости крови, напротив, опасны больше из-за высокого риска кровотечения.14.5.3. Прогестерон как вазодилататор
Вопрос о том, расслабляет ли прогестерон сосуды, то есть, является ли вазодилататором, спорный. Исследований, которые были посвящены вопросам влияния стероидных гормонов на сосуды, не так много, но категории женщин и критерии оценки результатов, как и виды гормонов, которые применялись в этих исследованиях, настолько разные, что это затрудняет сделать правильные выводы. Чаще всего изучалось влияние эстрогенов на сердечно-сосудистую систему, в основном у женщин в постменопаузе. В сужении и расширении (релаксации) сосудов участвует большое количество веществ, в том числе те, которые содержат азот: нитро-L-аргинин и синтаза оксида азота (СОА, NOS). Активность разных видов NOS зависит от стероидных гормонов, но может регулироваться эстрогеном. Известно, что эстроген может приводить к сужению сосудов. Но исследования на животных, у которых были удалены яичники, показали, что реакция сосудов на прогестерон и прогестины разная. Введение прогестерона вызывало расширение сосудов, в то время как некоторые прогестины такого эффекта не производили. Поэтому вопрос о том, насколько прогестерон может модулировать функцию синтаз оксида азота, остается открытым для исследования и обсуждений. При беременности высокие уровни прогестерона и эстрогенов оказывают выраженный негативный эффект на венозные сосуды женщины. Поэтому поверхностные варикозные вены чаще всего наблюдается у повторнородящих женщин. Также замечено, что высокие уровни этого измененного состояния сосудов чаще наблюдаются у женщин развитых стран, что связывают с малоподвижным образом жизни и распространенностью ожирения среди этих женщин. Уровень прогестерона в плазме крови женщин с варикозными расширенными венами нижних конечностей значительно выше такового у здоровых беременных женщин. Такой рост прогестерона наблюдается после 14 недель беременности. Венозные сосуды имеют рецепторы прогестерона, поэтому могут реагировать на этот гормон понижением тонуса и расширением, а также уменьшением выработки коллагена — вещества, которое отвечает за эластичность сосудов. Застой крови в нижних конечностях из-за понижения оттока крови и сдавления магистральных вен растущей маткой также являются факторами в развитии варикозных вен. Наследственные факторы тоже могут играть роль в развитии варикозных вен при беременности. Однако наличие варикозных вен у беременных женщин опасности тромбообразования не представляет, поэтому врачи очень редко рекомендуют профилактику гепарином или его заменителями. Основное внимание уделяется женщинам с историей возникновения тромбов (в том числе семейной), поражения глубоких вен конечностей.14.6. Прогестерон и скелетно-мышечная система
Ошибочное назначение прогестерона для профилактики остеопороза усугубляет потерю кальция. И это неудивительно. Ведь известно, что при беременности женщина теряет большое количество кальция, что обычно объясняют тем, что плод требует кальций для построения собственной скелетной системы. И вправду, к концу беременности скелет плода содержит 30 г кальция, 80 % которого он получает в третьем триместре. Это означает, что в этот период ежедневная скорость накопления кальция (в организме плода) составляет 250–300 мг. Чтобы покрыть такие потребности плода, в материнском организме может существовать три механизма получения дополнительного количества кальция в крови: усиление процессов всасывания кальция кишечником, уменьшение фильтрации ионов кальция почками и выведения его из организма, увеличение «вымывания» кальция из костной ткани матери. Действительно, всасывание кальция из пищи через кишечник удваивается уже к 12 неделям беременности. Так как для усвоения кальция необходим витамин Д, его выработка тоже увеличивается в два раза параллельно с усвоением кальция. Предполагается, что всасывание кальция кишечником стимулируется при беременности повышенным уровнем пролактина и плацентарного лактогена. Но роль прогестерона тоже не отрицается. Участие почек, наоборот, негативное в отношении накопления кальция — он выводится в большем количестве, начиная с 12 недель беременности. Обратное всасывание кальция (абсорбция) не наблюдается. Поэтому во время беременности наблюдается увеличение уровня кальция в моче. Все клинические исследования, изучавшие обмен кальция во время беременности, основаны на измерении уровня кальция в сыворотке крови, а также маркеров костного образования и распада в крови и моче. Но при беременности увеличивается объем плазменной части крови, причем значительно, что делает кровь «разведенной», а поэтому понижает концентрацию веществ, находящихся в ней. Клинических исследований, которые изучали строение костной ткани посредством ее биопсии у беременных женщин, единицы, и они имеют немало погрешностей в их проведении, поэтому полученные данные не могут считаться достоверными. К тому же, результаты получились противоречивыми — согласно одним костная ткань трубчатых костей становится плотнее, согласно другим, напротив, пористее. До сих пор нет четких данных, подтверждающих потерю кальция костной тканью у беременной женщины. Считается, что самым опасным периодом потери кальция у женщин является период грудного вскармливания, когда женщина теряет от 1 до 3 % запасов кальция в месяц (по некоторым данным до 6 %). Этот период характеризуется все тем же повышенным уровнем пролактина, а также физиологически низким уровнем эстрогенов. На фоне таких гормональных изменений нормальный уровень прогестерона становится физиологически повышенным по сравнению с эстрогенами. Овуляция при этом подавляется, наступает послеродовая аменорея, или менопауза, которая при регулярном кормлении длится в среднем 6 месяцев, но может продолжаться и в течение всего периода грудного вскармливания. Клинические исследования по изучению остеопороза проводились и проводятся массово во многих странах мира, так как это проблема многих женщин в постменопаузе, особенно в развитых странах, где физическая активность людей значительно ограничена. Оказалось, что количество беременностей не влияет на развитие остеопороза — его уровни одинаковы у рожавших и нерожавших женщин. Однако остеопороз чаще наблюдается у женщин, в истории которых были периоды грудного вскармливания. Другими словами, существует зависимость между количеством периодов лактации, но не количеством беременностей (многие женщины в развитых странах не кормят грудью новорожденных). И все же к концу беременности пониженная плотность костной ткани у беременных женщин допустима, поэтому остеопороз при беременности не исключается. Он обычно наблюдается на фоне приема гепарина, кортикостероидов и противосудорожных препаратов. Некоторые врачи считают, что послеродовый остеопороз и высокая потеря кальция костной тканью появляются у тех женщин, у которых наблюдались явления остеопороза в период беременности (что обычно никем не диагностируется).14.7. Прогестерон и надпочечники
Натуральный прогестерон (вырабатываемый яичниками женщины) участвует в синтезе многих других стероидных гормонов. Об этом уже не раз упоминалось в этой книге. Также была описана связь между прогестероном и гормонами надпочечников, которые вырабатываются при стрессе (см. раздел 14.2.1 «Прогестерон и стресс»). Данных о том, что экзогенный прогестерон используется организмом для выработки глюкокортикоидов и минералокортикоидов, не существует. Но в некоторых тканях прогестерон может превращаться в дезоксикортикостерон, один из минералокортикоидов, и проявлять свое действие. Одновременно прогестерон может связываться с рецепторами минералокортикоидов и блокировать их активность. У женщин на протяжении всего менструального цикла существует определенная пропорция прогестерона и дезоксикортикостерона. Во вторую фазу менструального цикла более 75 % дезоксикортикостерона вырабатывается из прогестерона через метаболизм этого гормона в других тканях (периферических), а не в надпочечниках. У мужчин, наоборот, основным источником дезокискортикостерона является кора надпочечников. При использовании экзогенного прогестерона резкое повышение его в плазме крови приводит к нарушению пропорции гормонов, в том числе надпочечниковых, таким образом прогестерон проявляет противоминералокортикоидное действие.15. ПРОГЕСТЕРОН И РАК
О том, что стероидные гормоны причастны к развитию рака разных органов, известно давно, и с каждым годом появляется все больше публикаций на эту тему. Особое внимание уделяется эстрогенам, так как они значительно повышают риск рака молочной железы и эндометрия. Они также имеют отношение к возникновению рака яичников. Тестостерон повышает риск образования рака простаты. Кортизол, гормон стресса, является фактором риска развития ряда злокачественных образований. Анаболики могут провоцировать рак почек, легких и яичек. Другие виды гормонов, которые не относятся к классу стероидных гормонов, тоже вовлечены в процессы, причастные к возникновению рака. Так, например, высокие уровни инсулина имеют связь с раковым процессом в кишечнике, поджелудочной железе, почках и матке. Инсулиноподобные факторы роста (или гормоны роста) вовлечены в процесс образования рака простаты, груди и кишечника. Хотя связь между пролактином и возникновением рака молочной железы оспаривается, и многие ученые ее отрицают, однако рак легких, почек, прямой кишки, яичников часто сопровождается повышенным уровнем пролактина, и влияние пролактина на возникновение рака в других органах предстоит еще изучить. Все без исключения гормоны, вырабатываемые в человеческом организме, играют важную положительную роль, выполняя определенную функцию. Однако все гормоны, за исключением альдостерона, могут вызывать раковый (злокачественный) процесс как соло-канцерогены или в комбинации с другими веществами. И если между стероидными гормонами и возникновением разных видов новообразований имеется связь, то невозможно не признавать такой связи между прогестероном, праотцом всех стероидных гормонов, и раковым процессом. В группе гормон-зависимых опухолей яичников, яичек, эндометрия, простаты, молочной железы, щитовидной железы и остеосаркомы влияние как эндогенных, так и экзогенных половых гормонов, и прогестерона играет важную роль из-за стимуляции роста раковых клеток.15.1. Прогестерон как канцероген
Длительное время тот факт, что прогестерон является канцерогеном, то есть может вызывать новообразования, не принимался во внимание должным образом врачами и теми, кто рекомендовал применение прогестерона или же использовал этот гормон с разными целями. И только около пяти лет тому назад прогестерон был назван канцерогеном официально, то есть он вошел в группу препаратов, способных вызвать рак, в фармацевтических классификациях ряда стран. Тканевой фактор (ТФ) является белком, который инициирует коагуляционные процессы и метастазирование многих видов злокачественных опухолей. Прогестерон, воздействуя на инсулиновые рецепторы, увеличивает транспорт сахара (глюкозы) в раковые клетки, снабжая их дополнительным количеством энергии. Фактически раковые клетки — это «энергетические вампиры». Дополнительная энергия идет на ангиогенез (рост сосудов) и метастазирование (распространение опухоли). Тканевой факторспособствует росту раковых клеток и их устойчивости к выживанию. Не все производители прогестерона в аннотациях к препарату правдиво описывают возможные побочные эффекты и негативные стороны применения этого гормона, хотя прекрасно осведомлены о результатах исследований прогестерона на животных моделях и добровольцах. Но есть и такие, кто не скрывает эту информацию. Например, в информации о продуктах корпорации Sigma-Aldrich, одного из самых крупных мировых производителей прогестерона, имеющей представительства в 40 странах мира, в описании биохимических и физиологических свойств прогестерона сказано, что гормон «Вызывает созревание и секреторную активность эндометрия матки, подавляет овуляцию. Прогестерон участвует в этиологии (возникновении) рака молочной железы». Надо отметить, что слово «созревание» не идентично слову «рост». Прогестерон подавляет рост эндометрия, о чем уже упоминалось в других разделах и главах, но способствует созреванию (достижению степени зрелости) внутренней выстилки матки. ВОЗ в монографии Программы по изучению канцерогенного риска на человека вместе с Международным агентством исследования рака (IARC) еще в 1999 году утверждала, что оба гормона, эстроген и прогестерон, не без основания считаются канцерогенами для людей. Это утверждение поддерживается Национальной токсикологической программой (США) в отчете по канцерогенам в 2005 году.15.2. Пролиферация
Часто при слове «пролиферация» у людей возникает страх, потому что в медицине распространено мнение, что пролиферация — это плохое состояние. Пролиферация означает деление клеток, а значит, рост тканей. В живом организме, особенно растущем, молодом, пролиферация тканей — это неотъемлемый постоянный процесс. Но даже в старшем возрасте, когда все обменные процессы замедляются, обновление тканей требует деления и роста новых клеток. Поэтому процесс пролиферации сопровождает человека до самой его смерти. Пролиферация выходит за рамки нормы тогда, когда деление клеток ускоряется или же происходит рост патологических клеток, ушедших из-под контроля со стороны ядерных и клеточных механизмов деления клеток и организма в целом. Этот процесс подразумевает митотическое (простое) деление клеток. Почему при делении раковых клеток теряется контроль, и рост выходит за пределы допустимых норм, нарушая целостность органа? Точных ответов на этот вопрос не существует, однако предполагается, что под воздействием канцерогенов в ДНК клетки происходят изменения (мутации), которые нарушают выработку ряда веществ, контролирующих (подавляющих) деление клеток, особенно дефектных, раковых. Одни из генов, контролирующих рост клеток, так и называются — гены подавления опухолей. Если возникает мутация в этих генах, клетки начинаются размножаться без всякого контроля. Эстрогены и прогестерон, в том числе синтетические формы, скорее всего, не являются генотоксическими, или мутагенными, то есть не вызывают мутации в генах, хотя этот факт оспаривается. Однако обнаружено, что они значительно влияют на деление (пролиферацию) клеток молочной железы, ускоряя это деление. Нормальные и измененные генетически клетки также могут по-разному реагировать на гормоны, особенно экзогенные.15.3. Исследования на животных
Первые публикации о том, что прогестерон является канцерогеном, были приняты во внимание в 1982 году по результатам экспериментов на животных. Подкожное введение прогестерона мышам привело к появлению рака молочных желез не только в большем количестве, но и в более раннем возрасте мышей. Длительный прием прогестерона привел к развитию зернистоклеточного рака яичников и эндометриальной стромальной саркомы у мышей-самок (данные 1979 года). Применение прогестерона у новорожденных самок мышей вызывает злокачественные новообразования влагалища, шейки матки и других репродуктивных органов. У собак после длительного подкожного применения прогестерона чаще наблюдалась гиперплазия эндометрия, уплотнения и фиброаденомы молочных желез (1982 год). В комбинации с другими канцерогенами прогестерон вызывает тот же эффект, то есть те же новообразования молочных желез и внутренних половых органов, но они появляются раньше.15.4. Исследования на женщинах
Многие годы Др. Ли рекомендовал использовать крем с прогестероном для предупреждения преждевременных родов, для лечения климакса, а также и для профилактики рака молочной железы наложением крема непосредственно на грудь, что было самой грубой и опасной ошибкой врача. Эллен Грант была одним из пионеров-исследователей Великобритании в области гормональной контрацепции, начиная с 1960-х годов, что позволило ей быть свидетелем развития гормональной контрацепции и воздействия гормонов на женский организм. В течение 40 лет этот врач-исследователь, гинеколог и нутрициолог по специальности, принимала активное участие в движении против злоупотребления половыми гормонами, была сторонником экологической медицины и медицины окружающей среды, пропагандировала здоровый образ жизни и рациональное сбалансированное питание. Она также стала первым публичным оппонентом Др. Ли и его публикаций, стараясь предупредить об опасности злоупотребления гормональными препаратами, в том числе прогестероном. В 2005 году Др. Гари Оувен из Чили и Ян Брозенс из Великобритании обнаружили увеличение почти в 18 раз особенного тканевого фактора (ТФ), способствующего росту злокачественных клеток, всего через 6 часов лечения прогестероном. Этот фактор повышает также выработку медиаторов роста сосудов (васкулярный эндотелиальный фактор роста), которые принимают участие в развитии рака. ТФ может соединяться с VII фактором свертываемости крови, который участвует в клеточной смерти, поэтому у раковых клеток повышается уровень «выживаемости». В этой книге уже упоминалось, что прогестерон улучшает «выживаемость» эндометрия, что наблюдается во время беременности, и предохраняет его от некротизации (омертвления) и отторжения. И прогестерон, и прогестины повышают сигнализацию эпидермального фактора роста (ЭФР), что также увеличивает устойчивость раковых клеток к защитным силам организма. Исследования влияния эстрадиола, прогестерона и прогестинов на разные линии раковых клеток молочной железы (с эстрогенными и прогестероновыми рецепторами) показали, что васкулярный эндотелиальный фактор роста (ВЭФР) увеличивается под влиянием прогестерона и прогестина, но не меняется после воздействия эстрадиола. С момента появления прогестерона вплоть до 2005 года этот гормон не входил в список канцерогенов, хотя с 1999 года начали появляться публикации результатов исследований, в основном эпидемиологических, которые изучали распространенность ряда «женских» раков и их связь с приемом прогестерона и прогестинов. Большинство исследований было посвящено гормональным контрацептивам, содержащим только прогестин, и гормональной заместительной терапии, состоящей из комбинации эстрогенов и прогестерона. ЗГТ применялась у женщин в климактерическом периоде. Исследования эффективности прогестерона в лечении ряда других женских заболеваний учитывали только кратковременные побочные эффекты и не рассматривали появление новообразований через более продолжительный период времени (10–20 лет, что обычно требуется для роста раковой клетки до размера опухоли, которую можно обнаружить методами диагностики). Первые клинические исследования, которые учитывали риск развития рака молочной железы и эндометрия на фоне приема или после приема прогестиновых контрацептивов, включали в основном молодую популяцию женщин, поэтому связь между прогестинами и раком груди и эндометрия была под знаком вопроса. Начиная с 1990-х годов стали появляться публикации о небезопасности прогестерона, особенно в связи с возможностью развития рака, но они оставались без внимания как общественности, так и врачей. Эти публикации освещали результаты исследований, проводимых в разных уголках мира, в том числе и США, где началось рекламирование использования прогестерона, особенно женщинами в предменопаузе и менопаузе. В 1993 году исследователи из Университета Южной Калифорнии подробно описали связь между возникновением рака молочной железы и использованием комбинации эстрогенов и прогестеронов с целью заместительной гормональной терапии у женщин предклимактерического периода. В этот период у женщин все еще наблюдается циклическая выработка собственных гормонов, в то время как в постменопаузе уровни гормонов значительно понижаются (на 2/3 — эстрогены и почти до нуля — прогестерон) и скачки гормонов не наблюдаются. Поэтому женщины в предклимактерическом периоде имеют больший риск развития рака, чем в климактерическом. Но после 2002 года начали появляться данные, свидетельствующие о риске развития рака молочной железы при длительном использовании прогестиновых контрацептивов у женщин старше 40 лет. Последние данные клинических исследований подтверждают, что эстроген-прогестероновая комбинация, которая используется с целью контрацепции или как заместительная гормональная терапия, повышает риск развития рака молочной железы, шейки матки и печени. Риск развития рака эндометрия при использовании прогестерона понижается. В отношении влияния прогестинов на рак эндометрия данные спорные. Также появляется все больше убедительных данных, что между раком толстого кишечника (аденокарциномой) и прогестероном может существовать связь.15.5. Прогестерон и другие канцерогены
Коканцерогены тоже участвуют в развитии рака, усиливая действие канцерогенов и ускоряя процесс развития злокачественных опухолей. Большое количество коканцерогенов образуется при обмене разных органических веществ, в том числе в результате их распада как внутри человеческого тела, так и в окружающей среде. Например, метилхолантрен считается сильнейшим канцерогеном, который образуется при сгорании топлива, мусора, входит в состав сигаретного дыма и смога. Он также образуется при нарушениях обмена холестерина и причастен к образованию рака простаты у мужчин. В комбинации с другими веществами (коканцерогенами) негативное воздействие прогестерона увеличивается. Исследования показали, что в комбинации с прогестероном метилхолантрен ускоряет процесс развития рака молочных желез и репродуктивной системы у животных. Если учесть тот факт, что этим канцерогеном значительно загрязнена окружающая среда индустриальных и городских зон и он легко попадает в организм женщины, риск развития рака молочных желез и других органов в комбинации с длительным приемом прогестерона значительно повышается. Эстроген тоже считается канцерогеном уже немало лет. В комбинации с прогестероном разграничить канцерогенное действие двух гормонов непросто. Но доказано, что заместительная гормональная терапия, когда используется комбинация эстрогенов и прогестерона (и прогестинов) повышает риск развития рака у женщин в менопаузе. Коль мы заговорили о канцерогенах, важно вспомнить акриламид. В 2002 году шведские ученые опубликовали данные, что акриламид, который считался канцерогеном и который находили в табачном дыме и ряде производственных отходов, часто содержится в хлебе и других хлебобулочных изделиях. Акриламид также находили и в жареных продуктах питания. Оказалось, что в большом количестве этот канцероген имеется в продуктах быстрого питания (fast food), особенно в жареном картофеле (френч фрайз), картофельных чипсах, сухих завтраках (cereal), в том числе готовых растворимых овсяных кашах, кофе (потому что зерна часто жареные и пережаренные — dark roast), гамбургерах и других продуктах питания быстрого приготовления. Исследования на животных показали, что акриламид вызывает несколько видов рака гормонально-чувствительных тканей, в том числе молочных желез. Но уровни этого вещества в пище, которая давалась животным, были в 1000—10 000 раз больше уровней в обычной человеческой еде. Поэтому возникли споры, что причастность акриламида к возникновению рака является всего лишь фальсификацией научных фактов. Для решения этих споров было проведено несколько клинических исследований, изучавших влияние определенных видов диет, в том числе содержащих акриламид, на развитие рака яичников, матки и молочных желез у женщин. Однако эти исследования внесли больше путаницы, чем ясности. В данных, которые описывали канцерогенный эффект, часто звучало слово «акрилальдегид» (акролеин), который образуется в небольшом количестве при сгорании жиров. Но, как говорят химики, между акриламидом и акриальдегидом и их влиянием на организм существует разница. Таким образом, вопрос о том, нарушается ли обмен половых гормонов и прогестерона при большом поглощении продуктов, насыщенных акриламидом, до сих пор остается спорным. Связь между этим канцерогеном и раком молочных желез у людей не доказана, однако связь между возникновением рака яичников и эндометрия все же не опровергается и поддерживается результатами некоторых исследований.15.6. Прогестерон и рак молочной железы
Рак молочной железы является одним из самых распространенных видов рака и лидирующей причиной смертности женщин (от рака) по всему миру. Среди всех видов злокачественных новообразований он занимает второе место по уровню смертности (10.9 %). Число случаев рака груди составляет 23 % (почти 1.4 млн. человек в год) от всех новых случаев диагностированных раковых процессов. Каждый год от этого вида рака умирает почти полмиллиона людей — 14 % случаев смерти от всех видов рака. Многие годы ошибочно считалось, что повышение риска развития рака молочной железы связано с высоким уровнем эстрадиола, его резкими скачками в предклимактерическом периоде, а прогестерон рассматривался как антиэстрогенный препарат, поэтому рекомендовался для «нейтрализации» действия эстрогенов. Это ложное убеждение распространено среди многих врачей до сих пор.15.6.1. Возраст и рак молочной железы
Если посмотреть на графики, отражающие зависимость распространенности заболевания раком молочной железы и выявление новых случаев этого заболевания от возраста, то интенсивный стабильный подъем диагностируемых случаев рака молочной железы наблюдается после 35–40 лет. Максимальное количество достигается в 65–75 лет у женщин, живущих в развитых странах. После 80 лет заболеваемость резко понижается. К 50 годам, когда у большинства женщин возникает менопауза, уровень риска возникновения рака груди повышается почти в 200 раз по сравнению с уровнями этого заболевания в 25 лет. Обычно о раке молочной железы начинают говорить тогда, когда у женщин наступает менопауза. Но нужно указать на один серьезный факт: на развитие (рост) опухоли уходит от 15 до 20 лет, поэтому, когда рак диагностируют, это далеко не начало злокачественного процесса. Это стадия клинического рака. Начало же необходимо искать задолго до менопаузы. И как раз интенсивный рост случаев рака после 35 лет большинством врачей и женщин не замечается. Возрастное окно в 35–55 лет остается без должного внимания в отношения рака груди. Если принять во внимание возраст, когда кривая роста новых случаев рака молочной железы (35 лет) начинает кардинально подниматься вверх, важно задуматься над тем, что до этого возраста женщина могла неоднократно подвергать себя влиянию многих веществ, в том числе гормонов, которые играют роль в развитии рака молочной железы. И необоснованный прием прогестерона в молодом возрасте может быть одним из факторов, провоцирующих развитие рака у женщин в более зрелом возрасте.15.6.2. Почему рак молочной железы чаще диагностируется в постменопаузе
В постменопаузе уровень эстрогенов низкий, уровень прогестерона почти нулевой. По идее, низкое содержание гормонов должно затормозить процесс пролиферации и подавить рост любых раковых клеток. Почему же в таком случае частота рака молочной железы повышается в климактерическом периоде? То, что эстроген может вызывать пролиферацию клеток молочной железы, известно давно. И на фоне чрезвычайно низкого уровня прогестерона даже пониженный уровень эстрогенов имеет определенное стимулирующее действие на деление клеток молочной железы. Но как показывают исследования, именно комбинация эстрогенов и прогестерона вызывает еще большую пролиферацию этих клеток. Опять же, почему на фоне низких уровней эстрогенов и прогестерона возникает рак молочных желез? Ответ на этот вопрос кроется в прошлом: длительном периоде времени, предшествующем менопаузе. Действительно, эстрогены без прогестерона не будут оказывать такого негативного действия на ткани молочной железы, поэтому гипотеза «вредной поддержки эстрогенов прогестероном» себя оправдывает. В ранней менопаузе риск развития рака молочной железы на самом деле понижается в связи с понижением уровня гормонов. Периоды ановуляции, когда уровень прогестерона низкий (в два раза ниже, чем при овуляторном цикле в лютеиновую фазу), что часто сопровождается лишним весом тела, тоже значительно понижают риск развития рака молочной железы. Проблема современной медицины состоит в том, что до сих пор в отношении развития различных видов рака упускается поиск взаимосвязи между многими факторами и раком задолго до появления клинической формы рака. Такая взаимосвязь найдена между курением и раком легких. Найдена взаимосвязь между гормональными контрацептивами и предраковым и раковым состояниями шейки матки. И все же, в отношении многих злокачественных процессов женского организма существует пробел в поиске причинно-следственных связей. Хотя имеется колоссальный прогресс в изучении вопросов развития рака молочной железы, но до сих пор мало кто из врачей проводит поиск причины этого заболевания через призму всей жизни женщины, начиная с момента ее полового созревания, а может, и раньше. Изучение влияния прогестерона на развитие рака молочных желез отдельно, вне действия других гормонов, особенно тех, которые тоже вовлечены в развитие этого заболевания, затруднено. Среди этих веществ внимания заслуживают факторы роста и пролактин.15.6.3. Вес и рак молочной железы
Существует не только зависимость между возрастом и ростом случаев рака молочной железы, но также и между весом и раком. Как известно, вес тела увеличивается с возрастом у большинства женщин. Триада «гипертония, сахарный диабет и ожирение» являются раковой триадой, и она встречается среди людей после 35 лет в современном мире очень часто. У женщин в постменопаузе риск развития рака увеличивается в 2.1 раза в год. Но в отношении ожирения наблюдается интересная тенденция: полнота до климакса понижает риск развития рака молочной железы, в то время как лишний вес (ожирение) с наступлением климакса повышает риск развития этого заболевания. Между развитием рака молочной железы и набором веса во время беременности найдена определенная связь, то есть большая прибавка в весе повышает риск развития рака груди. Но причастны ли к этому гормоны, которые тоже повышаются при беременности? Значит ли это, что чем больше прибавка веса, тем выше уровни гормонов? Несколько клинических исследований этого вопроса в разных регионах мира показали, что уровень эстрогенов не зависит от веса беременной женщины и ее прибавки в весе. Уровень прогестерона, наоборот, немного выше у женщин с большей прибавкой веса. Однако до сих пор неизвестно, отражается ли такое повышение на развитии рака молочной железы в будущем или существуют другие факторы беременности, причастные к развитию рака.15.6.4. Факторы риска рака молочной железы
Исследования показывают, что уровень риска развития рака молочной железы зависит от длительности воздействия половых и стероидных гормонов на женский организм. Риск рака молочной железы повышается у женщин с ранним появлением менархе и поздней менопаузой, так как увеличивается количество менструальных циклов. Другими словами, чем больше у женщины менструальных циклов, тем больший риск развития рака молочной железы. Это связано с тем, что митотическое деление эпителиальных клеток желез и протоков молочной железы активируется во время лютеиновой фазы (на пике выработки прогестерона), поэтому считается, что такие колебания прогестерона оказывают негативное влияние на молочные железы. У ряда женщин синхронизация пролиферации и самоуничтожения клеток молочной железы может быть нарушена, что приводит к выраженному воспалительному процессу тканей молочной железы, который сопровождается болью в молочных железах, их отечностью и повышенной чувствительностью (врачи старого поколения называют такое состояние мастопатией). Прогестерон может взаимодействовать с рецепторами факторов роста, поддерживая деление и рост клеток. Прогестерон также повышает активность инсулиновых рецепторов. Исследования показали, что введение прогестерона с инсулином значительно повышает уровень деления раковых клеток молочной железы. У женщин в постменопаузе имеется тесная взаимосвязь между приемом гормональной заместительной терапии, возникновением рака молочной железы и активностью прогестероновых рецепторов. Если женщины принимают эстроген и его синтетические заменители (монотерапия), риск развития рака молочной железы повышается в 1.3 раза, в то время как комбинация эстрогенов с прогестинами повышает риск в 2 раза.15.6.5. Беременность и рак молочной железы
Беременности в молодом возрасте (до 30 лет) оказывают защитный эффект на молочную железу, особенно в отношении развития аденокарциномы с положительной активностью прогестероновых рецепторов. Беременности в более позднем возрасте понижающего эффекта на риск развития этого заболевания не оказывают. Так как между прогестероном и развитием рака молочной железы существует взаимосвязь, ученых интересует вопрос, почему беременность может понижать риск возникновения рака груди. Ведь при беременности уровни прогестерона чрезвычайно высокие. Если рассматривать влияние беременности на возникновение рака молочной железы, то необходимо учитывать короткий и продолжительный эффект, то есть каков риск повышения рака груди в первые годы после беременности и через несколько лет после родов. Исследования показали, что в целом показатели в отношении развития рака молочной железы почти одинаковы у женщин в конце первых двух лет после родов и у женщин через 6 лет после беременности. Однако если разделить этих женщин по количеству беременностей и родов, показатели значительно отличаются. Оказалось, что беременность повышает риск развития рака молочной железы, но этот эффект наблюдается кратковременно — во время беременности и в первые два года после родов. Беременности являются фактором риска развития рака молочной железы, причем беременности, закончившиеся родами. Чем быстрее закончилась беременность, тем меньший риск развития рака молочной железы, то есть потери беременности на ранних сроках не повышают риск, а даже незначительно понижают. Объяснить такое явление можно тем, что при беременности наблюдается значительный рост (пролиферация) молочных желез — высокие уровни прогестерона не проходят бесследно для организма женщины. Но как же появилось утверждение, что у женщин с несколькими родами и периодами лактации после них риск развития рака молочной железы понижается? Необходимо вспомнить физиологические изменения в послеродовом периоде. Уровни гормонов, в том числе прогестерона, значительно понижаются. Но защитным эффектом обладает лактация. Она не только подавляет овуляцию и вызывает длительный (6 месяцев и даже больше) период ановуляции и отсутствия менструальных циклов. С лактацией удаляются поврежденные и патологические клетки эпителия протоков и молочных желез, и среди них те, которые в будущем могли бы быть потенциально раковыми клетками. Поэтому, если состояние беременности повышает риск развития рака, длительное грудное вскармливание компенсирует этот риск и даже понижает его. В недалеком прошлом считалось, что эстроген увеличивает рост предраковых клеток молочной железы. Однако рак молочной железы, имеющий связь с беременностями, часто эстроген-нечувствительный или негативный. Некоторые ученые считают, что триггером возникновения рака молочной железы может быть повышенный уровень пролактина. Как известно, уровень пролактина также повышается с возрастом женщины. Но если рассматривать уровни пролактина, то самые высокие из них наблюдаются не после родов, в период лактации, а в третьем триместре беременности, ближе к родам — до 200 нг/мл. После родов, если женщина не кормит грудью, уровень пролактина быстро понижается и в течение 8–10 недель может достичь уровня гормона до беременности. У кормящих грудью матерей выработка пролактина зависит от количества и продолжительности кормлений. Буквально через 45 минут после кормления уровень пролактина удваивается и начинается выработка молока до следующей сессии кормления. Но, несмотря на такие повышения и понижения пролактина в крови женщины, все его уровни не достигают уровней при беременности. Даже у кормящих матерей уровень гормона постепенно понижается. В первые 3–6 месяцев он не превышает 100–110 нг/мл (у небеременных женщин уровни пролактина не повышаются выше 25–30 нг/мл), но как только появляются менструальные циклы, уровень гормона падает до 50–70 нг/мл и последующие месяцы кормления обычно не превышает 50 нг/мл. Таким образом, скорее всего, комбинация высокого уровня прогестерона и пролактина во время беременности может быть триггером развития рака молочной железы.15.6.6. Рак молочной железы и прогестероновые рецепторы
Рак молочной железы является комплексным заболеванием и по причинам возникновения, и по проявлению, и по протеканию, и по реакции на лечение. В зависимости от генной классификации рак молочной железы делят на несколько категорий. Более в 70 % случаев опухоль имеет рецепторы к эстрогену (ERa), поэтому она чувствительна к антиэстрогенным препаратам (тамоксифен, фазлодекс). Частично эти виды карцином могут содержать рецепторы прогестерона (PRs), однако роль этих рецепторов в развитии рака, а также лечении, неизвестна. Низкий уровень обоих гормонов внутри опухолевых тканей стимулирует рост раковых клеток. Прогестероновые рецепторы могут активироваться как ответная реакция на активность эстрогенных рецепторов, но также независимо от них. В молочной железе имеется два вида прогестероновых рецепторов, ПР-А и ПР-В, но для их активации обычно требуется эстроген. Поэтому рассматривать действие прогестерона без взаимосвязи с эстрогеном невозможно. Изучение роли прогестероновых рецепторов в возникновении рака молочной железы началось тогда, когда после применения химиотерапии в течение нескольких лет выяснилось, что не все опухоли чувствительны к антиэстрогенным лекарственным препаратам, несмотря на то, что в их структуре имеются рецепторы к эстрогенам и прогестерону. Но так как между возникновением рака молочной железы и прогестероном найдена взаимосвязь, врачи-ученые начали исследовать влияние препаратов с антипрогестероновым действием на регресс ракового процесса. ПР-В регулируют экспрессию васкулярного эндотелиального фактора роста (ВЭФР) в раковых клетках, а так как количество этих рецепторов тоже увеличено в таких клетках, автоматически вырабатывается и больше ВЭФР. Доказано, что и эстрогены, и прогестерон (натуральный и синтетический) стимулируют выработку ВЭФР, который поддерживает рост раковых клеток. ВЭФР является очень важным веществом, стимулирующим рост новых сосудов — процесс ангиогенеза. Как известно, ангиогенез играет важную роль в росте и разрастании раковых тканей, а также в процессе метастазирования. Существует несколько факторов, которые повышают выработку этого вещества: гипоксия (тканевое кислородное голодание), онкогены, кислотно-щелочное состояние (рН) и стероидные гормоны. В ткани молочной железы при поражении раковым процессом уменьшается также уровень и активность ферментов, расщепляющих и нейтрализующих прогестерон. Из-за этого уровень прогестерона увеличивается, и в комбинации с большим количеством прогестероновых рецепторов увеличивается также и воздействие этого гормона на гены, что приводит к повышенному митотическому делению клеток. Многочисленные исследования на животных и людях показали, что сам по себе эстроген не вызывает пролиферацию клеток, в то время как комбинация эстрогена с прогестероном является отличным стимулятором пролиферации клеток, особенно раковых. Интересно, что роль прогестероновых рецепторов в развитии рака молочной железы доказана на животных моделях, однако до сих пор не удается найти четкую связь между ПР и раком груди у женщин, несмотря на многочисленные публикации о функции ПР в модуляции рака молочной железы с биологической точки зрения. Использование антагонистов прогестерона (мифепристона) в лечении рака молочной железы оказалось малоэффективным и вызвало немало серьезных побочных эффектов. Современный поиск лекарственных препаратов для лечения этого опасного заболевания основан на создании препаратов из группы селективных модуляторов прогестероновых рецепторов, которые смогут взаимодействовать с ядерными и мембранными прогестероновыми рецепторами раковых клеток, а также блокировать не только прогестероновые рецепторы, но и эстрогенные, понижая выработку особых веществ — киназ, участвующих в усвоении стероидных гормонов.15.7. Прогестерон и рак яичников
Рак яичников занимает пятое место по уровню смертности женщин и чаще всего возникает у женщин в климактерическом периоде, обычно уже на поздних стадиях. В последнее время наблюдается рост уровня рака яичников, особенно у более молодой категории женщин, что связано с использованием вспомогательных репродуктивных технологий, когда интенсивно применяются препараты для стимуляции и индукции овуляции. Рак яичников чаще всего возникает из клеток поверхностного эпителия, которые представляют собой один слой мезотелиальных кубических клеток, покрывающих яичник снаружи. Этот слой клеток прилегает к базальной мембране и легко повреждается во время овуляции. Фактически разрыв фолликула и выход яйцеклетки за пределы яичника в брюшную полость сопровождается постоянным повреждением поверхностной оболочки яичника. Если бы она была толстой, овуляция была бы невозможной. В течение всей жизни женщины такая физиологическая поломка наблюдается при каждом менструальном цикле, то есть до 400 раз. В участке поврежденной оболочки возникает воспалительный процесс с вовлечением ряда иммунологических факторов. Поэтому между раком яичников и овуляцией существует связь, так как овуляция — это натуральный воспалительный процесс. Известно, что женщины, у которых овуляция подавлена беременностью, грудным вскармливанием, гормональными контрацептивами, меньше подвержены риску развития рака яичников. И наоборот, факторы, которые усиливают воспалительный процесс, повышают риск развития рака яичников, и к этим факторам часто относят эндометриоз, кисты яичников, гипертиреоидизм, а также использование талька (его часто использовали в производстве перчаток, а также в процессе их обработки). Беременность, которая завершилась родами в срок, особенно многоплодная беременность, оказывает защитный эффект на яичники. Многочисленные исследования показывают, что применение экзогенного прогестерона понижает риск развития рака яичников как у животных, так и у людей. Рак маточных труб, который возникает очень редко и который часто относят к группе рака яичников, тоже чувствителен к уровню прогестерона, так как в маточных трубах имеются прогестероновые рецепторы.15.8. Прогестерон и рак эндометрия
Рак эндометрия — редкое заболевание, тем не менее, в списке злокачественных заболеваний он занимает четвертое место по распространенности среди всех видов рака, от которых страдают женщины. Считается, что раннее лечение злокачественных опухолей гарантирует лучший прогноз, что частично является верным. Однако для каждого вида злокачественного образования существует своя статистика выживаемости, и эти показатели неодинаковы. Например, по данным американской статистики, которая совпадает с европейской, 5-летняя выживаемость после лечения рака простаты составляет почти 100 %, для рака молочной железы — около 90 %, меланомы — 95–99 % (речь идет о нераспространенных формах рака, о первых двух стадиях). Но для рака эндометрия, несмотря на его раннее выявление, показатели выживаемости за последние 30 лет значительно ухудшились и составляют 84 %. Без лечения степень выживаемости низкая. Механизм развития рака эндометрия не изучен до сих пор, однако в 80 % случаев его появление связывают с гормональными нарушениями, дисбалансом между эстрогенами и прогестероном: либо слишком повышен уровень эстрогенов, либо наблюдается нехватка прогестерона. Эстрогены вызывают рост эндометрия (пролиферацию), в том числе раковых клеток, посредством прямой и непрямой регуляции транскрипции генов. Если прогестерон вызывает пролиферацию эпителия молочных желез, на эндометрий он влияет противоположным образом — подавляет его рост и повышает его дифференциацию. Злокачественные клетки характеризуются низкой дифференциацией, когда исчезает специфичность клеток по их строению и функции. Прогестерон тоже повышает дифференциацию раковых клеток, подавляет клеточный цикл и процесс их деления, повышает апоптоз, а также понижает воспалительный процесс. Чем выше дифференциация раковых клеток, тем обычно лучше прогноз. Благодаря подавляющему эффекту на растущий эндометрий, прогестерон и его синтетические заменители используют в лечении гиперплазии и аденокарцином эндометрия.АНТИПРОГЕСТИНЫ
Если есть прогестерон и прогестины, существуют ли антипрогестерон или антипрогестины, то есть такие вещества, которые могут подавлять воздействие прогестерона и его синтетических форм путем конкурентного влияния на прогестероновые рецепторы? Как упоминалось выше в главе о прогестероновых рецепторах, воздействие прогестерона и ему подобных на ткани-мишени происходит через рецепторы. Без соединения с рецепторами прогестерон остается неактивным, клеткой и ядром не усваивается, не проявляет воздействия. Чтобы заблокировать прогестероновые рецепторы и не позволить им связаться с прогестероном, антипрогестерон должен иметь похожее с гормоном строение, фактически быть его «родственником». Такие вещества существуют и их называют селективными модуляторами прогестероновых рецепторов (SPRM, или СМПР). Для чего нужны антипрогестины? В первую очередь для блокировки воздействия прогестерона на уровне клеточных мембран, особенно тех клеток, которые причастны к возникновению заболеваний, в частности рака молочной железы. Так как пропорция двух видов ПР в раковых клетках нарушена и в них доминируют более агрессивные стабильные и более активные ПР-А, которые могут блокировать действие других важных стероидных рецепторов, а также «поглощать» большее количество прогестерона, важно вовремя подавить действие этих рецепторов. В этом и заключается роль антипрогестинов. Существует три группы антипрогестинов. В состав СМПР первого типа входит онапристон (ONA). Он связывается с ПР, но не с ДНК клетки. Онапристон был снят с производства из-за вредного влияния на печень (гепатотоксичности). СМПР второго типа включают всем известный мифепристон (МФП, MFP, RU-486), самый первый искусственно созданный антипрогестин. В комплексе с рецепторами это вещество может связываться с генами, которые регулируют действие прогестерона. Мифепристон обладает двояким действием, то есть в зависимости от условий и наличия определенных веществ он может быть агонистом прогестерона, а не антагонистом, и подавлять ПР-В, когда важно подавить ПР-А, а также иметь слабый антиглюкокортикоидный эффект. МФП нашел широкое применение в акушерстве для подготовки шейки матки к родам, реже для индукции и стимуляции родов, так как у этого препарата побочные эффекты слабее по сравнению с простагландинами. Для проведения медицинского аборта МФП начали использовать с 1981 года. Также этот препарат пытались использовать (и до сих пор используют в ряде стран) для лечения некоторых видов злокачественных процессов: рака молочной железы, рака шейки матки, лейомиосаркомы, менингиомы, рака простаты и др. Интересно, что мифепристон нашел применение в лечении психиатрических заболеваний. К этой группе относят также аглепристон, который используют в ветеринарии чаще всего для контроля беременности, лечения фибромиом у собак и фиброаденом молочных желез у котов. Третий тип СМПР включает лонапризан, который тоже может связываться с ДНК, но его действие обычно слабое. Это препарат нового поколения со слабым антиглюкокортикоидным эффектом. Положительная сторона его состоит в том, что он не подавляет ПР-В, что важно в лечении рака молочной железы. Во всем мире идет разработка и испытание новых видов антипрогестинов, которые будут иметь воздействие на рецепторы молочных желез и матки как антагонисты, а на рецепторы яичников — как агонисты. Применение СМПР в гинекологии и онкологии ограничено в силу новизны этих видов препаратов и нехватки клинически обоснованных данных об их пользе и вреде. Многие врачи-ученые, занимающиеся вопросами лечения рака молочной железы, считают, что у антипрогестинов есть большой потенциал стать препаратами будущего для лечения этого серьезного заболевания. Важно правильно определять контингент больных женщин с учетом пропорции разных видов прогестероновых рецепторов в раковых тканях. Методы подсчета таких рецепторов уже разработаны и проходят испытания. Ученые ведут также поиск новых биохимических маркеров, которые бы характеризовали повышенную активность ПР-А, что может быть признаком злокачественного процесса.Послесловие
Вот и подошли мы к концу книги о прогестероне. Благодарю всех моих читателей за то, что осилили этот труд, несмотря на сложность некоторых тем, множество медицинских терминов, научных данных, замысловатых схем и порой сложных для понимания объяснений. Это далеко не вся информация о прогестероне, с которой мне бы хотелось поделиться с вами. Но учитывая то, что эта книга предназначена для широкого круга читателей, мне не хотелось превращать ее в сухой научный трактат. Как прародитель всех стероидных гормонов прогестерон играет чрезвычайно большую роль в жизни женщин и мужчин. Его действительно можно назвать гормоном беременности, но это не означает, что он действует как гормон беременности вне самой беременности. К сожалению, мы знаем о прогестероне все еще очень мало — ничтожную частичку того, что еще предстоит открыть и изучить. Тем не менее, несмотря на значимость прогестерона в жизни людей, в эпоху прогресса науки и новых достижений медицины не должно быть места прогестероновой нации — нации женщин, преклоняющихся перед прогестероном, зависящих от его приема уже психологически, боящихся быть здоровыми женщинами, способными вынашивать самостоятельно здоровое потомство — без дополнительного прогестерона или его синтетических форм. Ибо с приемом гормона начинается цепная реакция приема десятка других лекарственных препаратов, которые обычно больше вредят, чем помогают. Прогестероновая нация — это «захимиченная» нация их потомства, подвергающаяся дальнейшему бесконечному обследованию и лечению, основанному на аргументе, что «сейчас здоровые дети не рождаются», что «если беременность протекала тяжело, со страшными угрозами, то неудивительно, что ребенок родился с проблемами». Так, может быть, здоровые дети и не рождаются потому, что здоровую беременность превращают в патологическую, причем с такой агрессией, словно избавляют женщин от злокачественных образований? В нашу современную эпоху не должно быть места тем врачам, которые «выращивают» прогестероновую нацию, назначая гормон чуть ли не при всех женских проблемах женщинам любых возрастов. Прогестерон действительно нашел место в лечении многих заболеваний и состояний, а не только женских болезней (о чем говорится в книге). Однако он не должен превращаться в панацею или орудие запугивания («если не будете принимать, то беременности не будет или она сорвется»). Прогестероновая нация — это не прогресс общества, а его деградация, отражающая деградацию системы здравоохранения и покорно принимающая в свою жизнь эту деградированную систему, от которой зависит здоровье и жизнь членов нации. Если эта нация не откроет глаза на суть вещей, не начнет думать и анализировать, не вырвется из оков мифов, страхов, предрассудков, ее ждет обыкновенное самоуничтожение, что фактически уже происходит (достаточно сравнить уровни смертности и рождаемости в бывших постсоветских странах с мировыми показателями). Не превращайте свою жизнь и жизнь других людей в зависимость от прогестерона! Думайте и не идите на поводу у страхов!Долой прогестероновую нацию!
Список терминологии
Аборт — прерывание беременности, искусственное или естественное (обычно до 20 недель беременности) Абсцесс — гнойный процесс Автономно — независимо Агонист — вещество, которое, связываясь с рецепторами клеток, повышает их функцию. Адаптация — приспособление Акне — угревые прыщи кожи Акросома — особая часть головки сперматозоида, принимающая участие в его проникновении в яйцеклетку Активатор — вещество, усиливающее воздействие чего-то (катализатор, фермент) на скорость химической реакции Акушерство — наука о помощи при родах и беременности и заболеваниях, связанных с беременностью Алиментарный — «через рот», пищевой Аменорея — отсутствие менструации Аминокислоты — органические соединения, входящие в состав белков и других веществ Анатомия — наука о строении тела и органов Ангиогенез — процесс формирования и роста кровеносных сосудов Андрогены — мужские половые гормоны Ановуляторный — цикл без созревания женской половой клетки (без овуляции) Ановуляция — отсутствие овуляции Аногенитальный — участок между заднепроходным отверстием (анусом) и наружными половыми органами (гениталиями) Антагонист — вещество, которое, связываясь с рецепторами клеток, понижает их функцию. Антиандрогенный — подавляющий действие андрогенов Антибиотики — лекарственные вещества, подавляющие рост определенных микроорганизмов или вызывающие их гибель Антиген — любая молекула, которая специфично связывается с антителом Антикоагулянты — вещества, понижающие свертываемость крови (образование тромбов) Антиминералокортикоидный — подавляющий действие минералокортикоидов Антитела — иммуноглобулины, особый вид белка, участвующего в защитной реакции организма Антиэстрогенный — подавляющий действие эстрогенов Антропология — наука о человеке, его происхождении Апоптоз — программированная клеточная гибель Атипичный — нетипичный Атрезия — врожденное отсутствие или заращение естественных отверстий и каналов в организме Атрофия — обратное развитие, исчезновение Бактерицидный — убивающий бактерии Биология — наука о живых существах Биопсия — взятие тканей на исследование Бластоциста — стадия развития эмбриона Васкуляризация — обеспечение кровеносными сосудами органов и частей тела Вирилизация — появление мужских черт в оволосении, строении тела, голосе и т. д. Гаметы — половые клетки Гемодинамика — состояние циркуляции крови Геморрагия — кровотечение Ген — структурная и функциональная единица наследственности живых организмов, участок ДНК, несущий информацию о строении белка Гениталии — женские и мужские наружные половые органы Генотип — индивидуальный набор генов Гестация — беременность Гинекологический — связанный с вопросами гинекологии, женский Гиперплазия — усиленное деление клеток без увеличения их размеров, разрастание тканей Гипертензия — повышенное давление Гипертония — повышенное артериальное давление Гипоксия — кислородное голодание Гипоталамус — нейроэндокринная железа Гипофиз — эндокринная железа, центральный орган эндокринной системы Гирсутизм — избыточный рост волос у женщин по мужскому типу Гистология — наука о строении клеток и тканей живых организмов Глюкокортикоиды — гормональные вещества, вырабатываемые корой надпочечников или получаемые синтетически Гонады — яичники у женщин, яички у мужчин Диалектический — противоположный, двойной Дискомфорт — ощущение неудобства, тревоги, беспокойства Диспропорция — нарушение пропорции Дисфункция — нарушение функции Дифференциация — различие, отличие; процесс формирования различий Дифференцировать — различать, отличать Иммунная система — защитная система Иммуноглобулины — см. выше Антитела Иммунологический — защитный Имплантация — внедрение, врастание во что-либо Инвазивный — проникающий внутрь (клетки, органа, организма) Инвазия — проникновение Ингибитор — вещество, которое замедляет или предотвращает какой-то процесс или функцию клеток, тканей, органов Индукция — вызов (искусственная стимуляция процесса) Инсульт — острое нарушение мозгового кровообращения Истмус — перешеек Капацитация — активация сперматозоидов во влагалище после эякуляции Капилляры — мелкие кровеносные сосуды Кариотип — набор хромосом в ядре клетки, присущий данному биологическому виду Кариотипирование — определение набора хромосом Катализатор — вещество, ускоряющее химическую реакцию Коагуляция — процесс свертываемости крови Коитус — сношение Кольпоскопия — осмотр шейки матки и влагалища при помощи кольпоскопа — устройства, представляющего собой бинокуляр и осветительный прибор Конверсия — превращение Концентрация — определенное количество одного вещества в другом Концепция — зачатие Конъюгированный — связанный Копуляция — совокупление; слияние двух половых клеток Лактация — выработка молочными железами молока Лапароскопия — малая полостная операция, с применением лапароскопа — телескопической трубки с видеокамерой Лапаротомия — операция с разрезом передней стенки живота Лейкоциты — белые кровяные тельца, защищающие организм от патогенных агентов Лимфоциты — разновидность лейкоцитов Липиды — жиры Липофильный — свойство вещества, означающее его химическое сродство к жирам Маскулинизация — развитие мужских признаков у женщин Медитация — разновидность психических упражнений для достижения внутреннего сосредоточения или расслабленности Мейоз — деление клетки с уменьшением числа хромосом в два раза. В результате мейоза образуются половые клетки Мембрана — полупроницаемая пленка в живом организме, разделяющая две разные среды, может служить оболочкой Менархе — первая менструация Менструация — месячные Метаболизм — обмен веществ, процесс распада или синтеза вещества Метаболит — вещество, образующееся при распаде другого вещества, часто как промежуточный продукт Метастазы — очаги злокачественной опухоли за пределами органа, в котором возникла опухоль Микрофлора — совокупность микроорганизмов, живущих в определенной среде Миометрий — мышечный слой матки Митоз — непрямое деление клеток Модератор — вещество, контролирующее что-то (действие другого вещества, функцию клетки и т. д.) Морула — стадия развития эмбриона Морфология — структура, строение чего-то (клетки, ткани, организма) Мутагенный — приводящий к изменениям в генах (мутациям) Нейрон — нервная клетка, нервное окончание Неконъюгированный — свободный Некроз — омертвление Неоплазия — рост клеток и тканей, выходящий за пределы нормы, новообразование Обсервация — наблюдение Овуляторный — связанный с овуляцией Овуляция — созревание яйцеклетки и ее выход в брюшную полость из фолликула Олигоспермия — уменьшение выделяемого во время эякуляции общего объема спермы Онкологический — злокачественный, раковый Оогенез — созревание яйцеклеток Ооцит — яйцеклетка, женская половая клетка Парентеральный — введение в организм препаратов не через ЖКТ, а другими способами: через инъекции, ингаляции, электрофорез и поверхностное нанесение препаратов на кожу и слизистые оболочки Патологический — нездоровый, вне нормы Перинатология — наука, которая изучает перинатальный период — от 28 (22) недель беременности, включающий роды и заканчивающийся через 7 дней после рождения Периферический — находящийся «на окраине», вне центра Перфорация — прокол Плацебо — пустышка Плацента — детское место Половая детерминация — процесс развития организма в зависимости от половой принадлежности Популяция — население определенной местности или группа людей, которых объединяет какой-то признак или группа признаков Прогестины — синтетические гормоны с прогестероновым действием Протеин — белок Реабсорбция — обратное всасывание Регенерация — восстановление Резистентность — устойчивость Релаксация — расслабление Репродуктивная система — система, отвечающая за детородную функцию женщины или мужчины Репродуктивные технологии — процедуры и мероприятия, помогающие семейным парам зачать и выносить потомство Репродукция — воспроизведение потомства Ретроплацентарный — позади плаценты Ригидный — нерастяжимый Седация — успокоение Секрет — жидкость, выделяемая клетками и содержащая биологически активные вещества Секреция — выделение, выработка жидкости (секрета) Симптом — признак Симптоматика — набор признаков, характеризующих заболевание Синдром — набор симптомов, характеризующих состояние или заболевание Синехии — спайки Синтез — выработка, производство Социология — наука об обществе Сперма — жидкость, выделяемая при эякуляции самцами животных; состоит из сперматозоидов и семенной жидкости Сперматогенез — процесс развития мужских половых клеток Сперматозоиды — мужские половые клетки Стероиды — вещества животного или растительного происхождения, обладающие высокой биологической активностью; содержат конденсированную тетрациклическую систему гонана (прежнее название — стеран) Стимулятор — вещество, которое усиливает или повышает функцию клеток, тканей, органов Тахикардия — учащенное сердцебиение Телархе — начало роста молочных желез как признак начала полового созревания Токсин — яд биологического происхождения Токсический — ядовитый, вызывающий отравление Транскрипция — (переписывание) процесс синтеза РНК с использованием ДНК в качестве матрицы, т. е. перенос генетической информации с ДНК на РНК Трансмембранный — проходящий через оболочку (мембрану) Трансплантация — пересадка тканей, органов Транссудат — выпот Трансформация — превращение, переход Триместр — один из трех периодов беременности Тромбоциты — кровяные пластинки, участвующие в свертываемости крови Трофобласт — часть плодного яйца, из которого формируется детское место Уретра — мочевыводящее отверстие Утилизация — использование Феминизация — развитие женских признаков у особи мужского пола Фенотип — внешние и внутренние признаки, определяющиеся набором генов (генотипа) Фермент — энзим, вещество, участвующее в биохимической реакции Фертилизация — оплодотворение Фертильный — плодовитый Фетальный — относится к плоду, плодный Физиологический — природный, естественный Физиология — наука о процессах в живых существах Фимбрии — отростки маточных труб маточных труб Фолликул — яйцеклетка, окруженная слоем эпителиальных клеток и двумя слоями соединительной ткани Фолликулогенез — процесс роста фолликулов, завершающийся созреванием половой клетки и процессом овуляции Фракция — часть Химиотерапия — применение ряда лекарственных препаратов, подавляющих рост опухолевых клеток Хромосома — структурная единица клеточного ядра, содержащая генетическую информацию Цервикальный — шеечный Цервикс — шейка матки Цитология — наука о клетках Эволюция — развитие Экзогенный — внешний, внешнего происхождения, наружный Экспрессия — ответная генетическая реакция (обычно синтез белка) Экспрессия генов — процесс преобразования наследственной информации в генах через выработку белков или РНК Эластичный — растяжимый Электролитный — солевой Эмбрион — плод на ранней стадии своего развития (обычно до 12 недель беременности) Эндогенный — внутренний, внутреннего происхождения Эндокринный — гормональный Эндометрий — внутренняя выстилка полости матки Энзимы — ферменты Эпидемиология — наука, изучающая причины, условия, паттерн и влияние заболеваний и здоровья на население (местности, страны мира). Эпителий — покровная ткань Эритроциты — красные кровяные тельца Эстрадиол — женский половой гормон, один из разновидностей эстрогенов Эстрогены — стероидные гормоны, производимые в основном в яичнике у женщин Этиология — наука о причинах заболеваний Эякулят — сперма, семенная жидкостьСписок используемых аббревиатур
AAG — α1-кислотный гликопротеин (белок, связывающий прогестерон) CBG — белок, связывающий кортикостероиды FDA — Food and Drug Administration, Федеральная лекарственная администрация США GABA — гамма-аминобутировая кислота HLA 1 — человеческий лейкоцитарный антиген класса 1 Ig — иммуноглобулины, антитела IgG — иммуноглобулины класса G IgM — иммуноглобулины класса М 17-OHP — 17-Hydroxyprogesterone (17-оксипрогестерон) P4 — прогестерон PGRMC1 — прогестероновый рецепторный мембранный компонент 1 PIBF — прогестерон индуцированный блокирующий фактор SHBG — sex-hormone binding globulin, белок, связывающий половые гормоны SPRM — селективные модуляторы прогестероновых рецепторов uNK — маточные натуральные киллеры USP — United States PharmacopeiaА — андростендион АКР — альдо-кето-редуктаза, особый вид фермента, участвующего в обмене прогестерона АКТГ — адренокортикотропный гормон, кортикотропин АМГ — Антимюллеров гормон АПД — аутоиммунный прогестероновый дерматит АФП — альфа-фетопротеин, белок, вырабатываемый плодом БГТ — биоидентичная гормональная терапия ВИЧ — вирус иммунодефицита человека ВОЗ — Всемирная Организация Здравоохранения ВПЧ — вирус папилломы человека ВЭФР — васкулярный эндометральный фактор роста г — грамм ДНК — дезоксирибонуклеиновая кислота ЗГТ — заместительная гормональная терапия ИППП — инфекции, передающиеся половым путем КБГТ — комбинированная биоидентичная гормональная терапия л — литр ЛГ — лютеинизирующий (лютеиновый, лютеотропный) гормон мНК — маточные натуральные киллеры 17-ОПГ — 17-гидроксипрогестерон, 17-оксипрогестерон ПМА — предменструальная астма ПМДР — предменструальное дисфорическое расстройство ПМС — предменструальный синдром ПР — прогестероновые рецепторы ПЯЛ — полиморфноядерные лейкоциты РНК — рибонуклеиновая кислота РПК — Ретроплацентарный комплекс РС — рассеянный склероз РФ — ревматоидный фактор см — сантиметр СМПР — селективные модуляторы прогестероновых рецепторов СПКЯ — синдром поликистозных яичников СССР — Союз Советских Социалистических республик США — Соединенные Штаты Америки ТК — тканевой фактор 7TM-рецепторы — семь-трансмембранные рецепторы ТСГ — тиреостимулирующий гормон ТТГ — тиреотропный гормон УЗИ — ультразвуковое исследование ФСГ — фолликулостимулирующий гормон ХГЧ — хорионический гонадотропин человека ЧЛА 1 — человеческий лейкоцитарный антиген класса 1 ЭКГ — электрокардиограмма ЭКО — экстракорпоральное оплодотворение
Список литературы
Aarskog D. Maternal progestins as a possible cause of hypospadias. N. Engl. J. Med., 1979; 300:75–78. Aboulghar M. A., et al. Prospective randomized study comparing luteal phase support for ICSI patients up to the first ultrasound compared with an additional three weeks. Hum. Reprod., 2008; 23:857–862. Abplanalp J. M., et al. Cortisol and growth hormone responses to psychological stress during the menstrual cycle. Psychosom. Med., 1977; 39:158–177. Abuzeid M. I., Sasy M. A. Elevated progesterone levels in the late follicular phase do not predict success of in vitro fertilization-embryo transfer. Fertil. Steril. 1996; 65:981–985. ACOG Committee on Gynecologic Practice. ACOG Committee Opinion #322: Compounded bioidentical hormones. Obstet. Gynecol., 2005; 106 (5, pt1):1139–1140. Adlercreutz H., Martin F. Biliary excretion and intestinal metabolism of progesterone and estrogens in man. J. Steroid. Biochem., 1980; 13:231–244. Aghajanova L., Velarde M. C., Giudice L. C. Altered gene expression profiling in endometrium: evidence for progesterone resistance. Seminars in Reproductive Medicine 2010; 28:51–58. Aghajanova L., Velarde M. C., Giudice L. C. The progesterone receptor coactivator Hic-5 is involved in the pathophysiology of endometriosis. Endocrinol., 2009; 150:3863–3870. Alam V., Vega M., Risquez F. Luteal phase support. Reprod. Biomed. Online, 2001; 3:250–262. Al-Asmakh M. Reproductive functions of progesterone. East Fertility Society Journal, 2007; 12 (3):147–152. Albrektsen G., et al. Breast cancer risk by age at birth, time since birth and time intervals between births: exploring interaction effects. Br. J. Cancer., 2005; 92:161–175. Albrektsen G., et al. Clinical stage of breast cancer by parity, age at birth, and time since birth: a progressive effect of pregnancy hormones? Cancer Epidemiol. Biomarkers Prev., 2006;15:65–69. Albrektsen G., et al. Pregnancy Levels of Estrogen and Progesterone: The Double-Edged Sword. Cancer Epidemiol. Biomarkers Prev., 2007; 16:634–635. Allen E., Doisy E. A.: An ovarian hormone: Preliminary report on its localization, extraction and action in test animals. JAMA, 1923; 81:819–821. Allen W. M. Recollections of My Life with Progesterone. Gynecol. Invest., 1974; 5:142–182. Allen W. M. The isolation of crystalline progestin. Science, 1935; 82 (2118):89–93. Allred K. F., et al. Trigonelline Is a Novel Phytoestrogen in Coffee Beans. J. Nutr., 2009; 139:1833–1838. Al-Sabbagh M., Lam E., Brosens J. J. Mechanisms of endometrial progesterone resistance. Mol. Cel. Endocrinol., 2012; 358: 208–215. Ambhaikar M., Pur C. Cell surface binding sites for progesterone on human spermatozoa. Mol. Hum. Reprod., 1998; 4:413–421. American College of Obstetricians and Gynecologist. Use of progesterone to reduce preterm birth: ACOG committee opinion, No. 2919. Obstet Gynecol, 2003; 102:1115–1116. American College of Obstetricians and Gynecologist. Use of progesterone to reduce preterm birth: ACOG committee opinion, No. 419. Obstet. Gynecol., 2008; 112:963. American College of Obstetricians and Gynecologists (ACOG). ACOG practice bulletin. Management of recurrent early pregnancy loss. Int. J. Gynecol. Obstet., 2002; 78:179–190. American College of Obstetricians and Gynecologists (ACOG). Early pregnancy loss. ACOG technical bulletin. No. 212. Washington DC: American College of Obstetricians and Gynecologists, 1995. American College of Obstetricians and Gynecologists. Compounded bioidentical hormones. ACOG Committee Opinion. No. 322. Obstet. Gynecol., 2005; 106 (1):1139–1140. American College of Obstetricians and Gynecologists. Premenstrual Syndrome. ACOG Practice Bulletin. No. 15. Washington, DC: American College of Obstetricians and Gynecologists, 2000. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, 4th ed., Text Revision. Washington, DC: American Psychiatric Association, 2000. Andersen A. N., et al. Progesterone supplementation during early gestations after IVF or ICSI has no effect on the delivery rates: a randomized controlled trial. Hum Reprod, 2002; 17:357–361. Andréen L., et al. Pharmacokinetics of progesterone and its metabolites allopregnanolone and pregnanolone after oral administration of low-dose progesterone. Maturitas, 2006; 54:238–244. Angst J., et al. The epidemiology of premenstrual psychological symptoms. Acta Psychiatr. Scand., 2001; 104:110–116. Anserini P., et al. Luteal phase support in assisted reproductive cycles using either vaginal (Crinone 8) or intramuscular (Prontogest) progesterone: results of a prospective randomized study. Minerva Ginecol., 2001; 53:297–301. Antonipillai J., et al. The origin of plasma deoxycorticosterone in men and in women during the menstrual cycle. J. Clin. Endocrinol. Metab., 1983; 56:93–98. Aoki K., et al. Preconceptional natural killer cell activity as a predictor of miscarriage. Lancet, 1995; 345:1340–1342. Apter D., Vihko R. Early menarche, a risk factor for breast cancer, indicates early onset of ovulatory cycles. J. Clin. Endocrinol. Metab.,1983; 57:82–86. Apter D. Serum steroids and pituitary hormones in female puberty: a partly longitudinal study. Clin. Endocrinol. (Oxf), 1980; 12:107–120. Archer D. F., et al. Initial and steady-state pharmacokinetics of a vaginally administered formulation of progesterone. Am. J. Obstet. Gynecol., 1995; 173:471–477; discussion, 477–478. Archer D. F. The effect of the duration of progestin use on the occurrence of endometrial cancer in postmenopausal women. Menopause, 2001; 8:245–251. Arck P. Stress and embryo implantation. J. Gynecol. Obstet. Biol. Reprod., 2004; 33:S40-S42. Armon L., Eisenbach M. Behavioral Mechanism during Human Sperm Chemotaxis: Involvement of Hyperactivation. PLoS ONE, 2011; 6 (12):e28359. Arredondo F., Noble L. S. Endocrinology of recurrent pregnancy loss. Semin Reprod Med 2006; 24:33–39. Arthur A. A., Daniel J. C. Progesterone regulation of blastokinin production and maintenance of rabbit blastocysts transferred into uteri of castrate recipients. Fert. Steril., 1972; 23:115–122. Asso D. The Real Menstrual Cycle. New York: John Wiley & Sons; 1983. Attia G. R., et al. Progesterone receptor isoform A but not B is expressed in endometriosis. J. Clin. Endocrinol. Metab., 2000; 85:2897–2902. Aufrere M. B., Benson H. Progesterone: an overview and recent advances. J. Pharm. Sci. 1976; 65:783–800. Aupperlee M., et al. Progestins and breast cancer. Breast Disease, 2005; 24:37–57. Ayoubi J. M., et al. Uterorelaxing effects of vaginal progesterone: comparison of two methodologies for assessing uterine contraction frequency on ultrasound scans. Fertil. Steril., 2001; 76:736–740. Azem F., et al. Does high serum progesterone level on the day of human chorionic gonadotropin administration affect pregnancy rate after intracytoplasmic sperm injection and embryo transfer? Gynecological Endocrinology, 2008; 24 (7):368–372. Azziz R. PCOS: a diagnostic challenge. Reprod Biomed Online, 2004; 8:644–648. Backer Jr. M. H. Isopregnenone (Duphaston): a new progestational agent. Obstet. Gynecol., 1962; 19:724–729. Backstrom T., et al. Mood, sexuality, hormones and the menstrual cycle. II. Hormone levels and their relationship to the premenstrual syndrome. Psychosomatic Medicine, 1983; 45:503–507. Baerwald A. R., Adams G. P., Pierson R. A. A new model for ovarian follicular development during the human menstrual cycle. Fertil. Steril., 2003; 80:116–122. Bagga D., et al. Effects of a very low fat, high fiber diet on serum hormones and menstrual function: implications for breast cancer prevention. Cancer, 1995; 76:2491–2496. Bahat A., et al. Thermotaxis of mammalian sperm cells: A potential navigation mechanism in the female genital tract. Nature Med., 2003; 9:149–150. Baird D. D., et al. Application of a method for estimating day of ovulation using urinary estrogen and progesterone metabolites. Epidemiology, 1995; 6:547–550. Baird D. D., et al. Using the ratio of urinary oestrogen and progesterone metabolites to estimate day of ovulation. Stat. Med., 1991; 10:255–266. Bakker G. H., et al. Treatment of breast cancer with different antiprogestins: preclinical and clinical studies. Journal of Steroid Biochemistry and Molecular Biology, 1990; 37:789–794. Bakos O., et al. Ultrasonographical and hormonal description of the normal ovulatory menstrual cycle. Acta Obstet. Gynecol. Scand. 1994; 73:790–796. Balasch J. Sex steroids and bone: current perspectives. Hum. Reprod. Update, 2003; 9:207–222. Baldi E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 1991; 12:323–330. Baldi E., et al. Nongenomic activation of spermatozoa by steroid hormones: facts and fictions. Mol. Cell Endocrinol., 2009; 308:39–46. Baldi E., et al. Progesterone and spermatozoa: a long-lasting liaison comes to definition. Human Reproduction, 2011; 26 (11):2933–2934. Ball B., Miller P., Daels P. Influence of exogenous progesterone on early embryonic development in the mare. Theriogenology, 1992; 38:1055–1063. Baranczuk R. J., Fainstat T. Progesterone-induced ovulation of the hamster ovary in vitro. J. Endocrinol., 1976; 70:317–318. Barnard K., et al. Health status among women with menstrual symptoms. Journal of Women’s Health, 2003; 12:911–919. Barron A. M., Pike C. Sex hormones, aging, and Alzheimer’s disease. Front Biosci (Elite Ed), 2013; 4:976–997. Baruffi R., et al. Effects of vaginal progesterone administration starting on the day of oocyte retrieval on pregnancy rates. J. Assist. Reprod. Genet., 2003; 20:517–520. Baskin L. S., Himes K., Colborn T. Hypospadias and endocrine disruption: is there a connection? Environ Health Perspect, 2001; 109:1175–1183. Bayard F., et al. Cytoplasmic and nuclear estradiol and progesterone receptors in human endometrium. J. Clin. Endocrinol. Metab., 1978; 46:635–648. Bazer F. W., et al. Select nutrients, progesterone, and interferon tau affect conceptus metabolism and development. Ann. NY Acad. Sci., 2012; 1271:88–96. Bazer F. W., Slayden O. D. Progesterone-induced gene expression in uterine epithelia: a myth perpetuated by conventional wisdom. Biol. Reprod., 2008; 79,1008–1009. Beckmann M. W. et al. Influence of steroid hormones on 5 alpha-reductase activity in female and male genital skin fibroblasts in culture. Acta Endocrinol. (Copenh), 1993; 128:161–167. Bedford J. M. Site of the mammalian sperm physiological acrosome reaction. Proc. Natl. Acad. Sci., USA, 2011; 108:4703–4704. Bedu-Addo, et al. Mobilisation of stored calcium in the neck region of human sperm — a mechanism for regulation of flagellar activity. Int. J. Dev. Biol., 2008; 52:615–626. Beir H. M. A hormone-sensitive endometrial protein in blastocysts development. Biochim. Biophys. Acta, 1968; 160:239–291. Beleut M., et al. Two distinct mechanisms underlie progesterone-induced proliferation in the mammary gland. Proc. Natl. Acad. Sci., USA, 2010; 107:2989–2994. Benagiano G., Bastianelli C., Farris M. Selective progesterone receptor modulators: use in oncology, endocrinology and psychiatry. Expert Opinion on Pharmacotherapy, 2008; 9:2487–2496. Beral V., Bull D., Reeves G. Million Women Study Collaborators. Endometrial cancer and hormone-replacement therapy in the Million Women Study. Lancet, 2005; 365:1543–1551. Beral V. Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet, 2003; 362:419–427. Beral V. Million Women Study Collaborators. Ovarian cancer and hormone replacement therapy in the Million Women Study. Lancet, 2007; 369:1703–1710. Bercovici J. P., Darragon T. Administration route of natural sex steroids (estradiol, progesterone, testosterone). Nouv Presse Med., 1980; 9:179–183. Berga S., Naftolin F. Neuroendocrine control of ovulation. Gynecol. Endocrinol., 2012; 28 (S (1)):9–13. Bergeron C. Morphological changes and protein secretion induced by progesterone in the endometrium during the luteal phase in preparation for nidation. Hum. Reprod., 2000;15:119–128. Bergqvist A., Bergqvist D., Ferno M. Estrogen and progesterone receptors in vessel walls. Biochemical and immunochemical assays. Acta Obstet. Gynecol., 1993; 72:10–16. Bergqvist A., Rybo G. Treatment of menorrhagia with intrauterine release of progesterone. Br. J. Obstet. Gynecol., 1983; 90:255–258. Beta J., et al. Maternal Serum Progesterone-Induced Blocking Factor at 11–13 Weeks’ Gestation in Spontaneous Early Preterm Delivery. Fetal. Diagn.Ther., 2011; 29:197–200 Bhatia S. C., Bhatia S. K. Diagnosis and treatment of premenstrual dysphoric disorder. Am. Fam. Physician, 2002; 66 (7):1239–1248. Biddie S. C, John S., Hager G. L. Genome-wide mechanisms of nuclear receptor action. Trends in Endocrinology and Metabolism, 2010; 21:3–9. Bielefeldt K., Waite L., Abooud F., Conklin J. Nongenomic effects of progesterone on human intestinal smooth muscle cells. Am. J. Physiol., 1996; 271 (2 pt 1):G370–G376. Biggers J. D., Borland R. M. Physiological aspects of growth and development of the preimplantation mammalian embryo. Ann. Rev. Physiol., 1976; 38:95–119. Biggs W. S., Demuth R. H. Premenstrual Syndrome and Premenstrual Dysphoric Disorder. Am. Fam. Physician, 2011; 84 (8):918–924. Biskind G. R., Glick D. Studies in histochemistry. V. The vitamin C concentration of the corpus luteum with reference to the stage of the estrous cycle and pregnancy. J. Biol. Chem., 1936; 27:113–134. Bixo M., et al. Progesterone, 5-α-pregnane-3,20-dione and 3α-hydroxy-5-α-pregnane-20-one in specific regions of the human female brain in different endocrine states. Brain Research, 1997; 764 (1–2):173–178. Blake E. J., et al. Single and multidose pharmacokinetic study of a vaginal micronized progesterone insert (Endometrin) compared with vaginal gel in healthy reproductive-aged female subjects. Fertil. Steril. Published online July 14, 2009. Blengini C. S., et al. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian. Journal of Andrology, 2011; 13:769–773. Bloch M., et al. Effects of gonadal steroids in women with a history of postpartum depression. Am. J. Psychiatry, 2000; 157:924–930. Bloch M., Schmidt P. J., Rubinow D. R. Premenstrual syndrome: evidence for symptom stability across cycles. A. J. Psych., 1997; 154:1741–1746. Blois S. M., et al. Depletion of CD8þ cells abolishes the pregnancy protective effect of progesterone substitution with dydrogesterone in mice by altering the Th1/Th2 cytokine profile. J. Immunol., 2004; 172:5893–5899. Bogart M. H. Sex determination: a hypothesis based on steroid ratios. J. Theor. Biol., 1987; 128 (3):349–357. Bonen A., et al. Effects of menstrual cycle on metabolic responses to exercise. J. Appl. Physiol. 1983; 55:1506–1513. Boothby L. A., Doering P. L., Kipersztok S. Bioidentical hormone therapy: a review. Menopause, 2004; 11:356–367. Boothby L. A., Doering P. L. Bioidentical hormone therapy: a panacea that lacks supportive evidence. Curr. Opin. Obstet. Gynecol., 2008; 20:400–407. Borland R. M., Erickson G., Ducibella T. Accumulation of steroids in rabbit preimplantation blastocysts. J. Reprod. Fert., 1977; 49:219–224. Borna S., Sahabi N. Progesterone for maintenance tocolytic therapy after threatened preterm labor: a randomized controlled trial. Aust. N. Z. J. Obstet. Gynecol., 2008; 48:58–63. Borrelli P. T., et al. Human Chorionic Gonadotropin Isoform in the diagnosis of ectopic pregnancy. Clin. Chem., 2003:13. Bosch E., et al. Circulating progesterone levels and ongoing pregnancy rates in controlled ovarian stimulation cycles for in vitro fertilization — analysis of over 4000 cycles. Hum. Reprod. 2010; 25:2092–2100. Bosch E., et al. Premature luteinisation during gonadotropin-releasing hormone antagonist cycles and its relationship with in vitro fertilization outcome. Fertil. Steril., 2003; 80:1444–1449. Bosch E. Comment on: is progesterone elevation on the day of human chorionic gonadotrophin administration associated with the probability of pregnancy in in vitro fertilization? A systematic review and meta-analysis. By Venetis et al. (2007). Hum. Reprod. Update, 2008; 14:194–5; author reply 195–196. Bouckaert Y., et al. Acute eosinophilic pneumonia associated with intramuscular administration of progesterone as luteal phase support after IVF: case report. Hum. Reprod., 2004; 19:1806–1810. Bowden H., Tesh J., Ross F. Effects of female sex hormones in whole embryo culture. Toxicol. In Vitro, 1993; 7:799–802. Bowman P., McLaren A. Cleavage rate of mouse embryos in vivo and in vitro. J. Embryol. Exp. Morph., 1970; 24:203–207. Brady B. M., et al. Demonstration of progesterone receptor-mediated gonadotrophin suppression in the human male. Clin. Endocrinol. (Oxf), 2003; 58:506–512. Brandon D. D., et al. Progesterone receptor messenger ribonucleic acid and protein are over expressed in human uterine leiomyomas. Am. J. Obstet. Gynecol., 1993; 169:78–85. Brent R. L. Nongenital malformations following exposure to progestational drugs: the last chapter of an erroneous allegation. Birth Defects Res. A Clin. Mol. Teratol., 2005; 73:906–918. Brezina P. R., et al. The impact of luteal phase support on endometrial estrogen and progesterone receptor expression: a randomized control trial. Reprod. Biol. Endocrinol., 2012; 10:16. Briggs M. H. Hypospadias, androgen biosynthesis, and synthetic progestogens during pregnancy. Int. J. Fertil., 1982; 27:70–72. Brincat M., et al. Subcutaneous hormone implants for the control of climacteric symptoms. A prospective study. Lancet, 1984; 1:16–18. Brinton R. D., et al. Progesterone receptors: form and function in brain. Front Neuroendocrinol, 2008; 29:313–339. Britt K., Ashworth A., Smalley M.: Pregnancy and the risk of breast cancer. Endocr. Relat. Cancer, 2007; 14 (4):907–933. Broekmans F. J. M., et al. The antral follicle count: practical recommendations for better standardization. Fertil. Steril., 2010; 94:1044–1051. Brosens J. J., et al. Steroid receptor action. Best Practice and Research in Clinical Obstetrics and Gynecology, 2004; 18:265–283. Brosens J. J., et al. A role for menstruation in preconditioning the uterus for successful pregnancy. Am. J. Obstet. Gynecol., 2009b; 200:615:e611–616. Brosens J. J., et al. Proteomic analysis of endometrium from fertile and infertile patients suggests a role for apolipoprotein A-I in embryo implantation failure and endometriosis. Mol. Human. Reproduc., 2009a; 16:273–285. Brosens J. J., et al. Steroid receptor action. Best practice and research clinical obstetrics and gynecology, 2004; 18:265–283. Brosens J. J., Gellersen B. Death or survival — progesterone-dependent cell fate decisions in the human endometrial stroma. J. Mol. Endocrinol., 2006; 36:389–398. Brosens J. J., Hayashi N., White J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinol., 1999; 140:4809–4820. Brosens J. J., Pijnenborg R., Brosens I. A. The myometrial junctional zone spiral arteries in normal and abnormal pregnancies: a review of the literature. Am. J. Obstet, Gynecol., 2002; 187:1416–1423. Brown A. J., et al. Progestin intrauterine device in an adolescent with grade 2 endometrial cancer. Obstet. Gynecol., 2012; 119 (2 Pt 2):423–426. Buhrdel P., Willgerodt H., Theile H. Gestation time prolonging effect of progesterone and various synthetic gestagens in the rat]. Acta Biol. Med. Ger., 1974; 32:193–198. Bulletti C., et al. Uterine contractility during the menstrual cycle. Hum. Reprod., 2000; 15:81–89. Bulun S., et al. Progesterone resistance in endometriosis: Link to failure to metabolize estradiol. Mol. Cell. Endocrinol., 2006 248:94–103. Bulun S. E. Endometriosis. New England Journal of Medicine, 2009; 360:268–279. Burger H. G., et al. A review of hormonal changes during the menopausal transition: focus on findings from the Melbourne Women’s Midlife Health Project. Hum. Reprod. Update, 2007; 13:559–565. Burkman L. J. Characterization of hyperactivated motility by human spermatozoa during capacitation: comparison of fertile and oligozoospermic sperm populations. Arch. Androl. 1984; 13:153–165. Burney R. O., et al. Gene expression analysis of endometrium reveals progesterone resistance and candidate susceptibility genes in women with endometriosis. Endocrinol., 2007; 148:3814–3826. Burstein R., Wasserman H. C. The effect of provera on the fetus. Obstet. Gynecol., 1964; 23:931–934. Busacca M., Vignali M. Endometrioma Excision and Ovarian Reserve: A Dangerous Relation. Journal of Minimally Invasive Gynecology, 2009; 16:142–148. Butenandt A., Westphal U. Zur Isolierung und Charakterisierung des Corpus luteum Hormons. Berichte Deu0tsche chemische Gesellschaft, 1934; 67 (8):1440–1442. Buvat J., et al. Luteal support after luteinizing hormone releasing hormone agonist for in vitro fertilization; superiority of human chorionic gonadotropin over oral progesterone. Fertil. Steril., 1990; 53:490–494. Calaf G. M. Susceptibility of human breast epithelial cells in vitro to hormones and drugs. International. J. Oncol., 2006; 28:285–295. Calzolari E., et al.Aetiological factors in hypospadias. J. Med. Genet., 1986; 23:333–337. Cameron I. T., Irvine G., Norman J. E. Menstruation. In Scientific essentials of reproductive Medicine, Eds SG Hiller, HC Kitchener and JP Neilson. London: W.B.Saunders, 1996. Campagnoli C., et al. Progestins and progesterone in hormone replacement therapy and the risk of breast cancer. J. Steroid. Biochem. Mol. Biol., 2005; 96:95–108. Canfield R. E., et al. Development of an assay for a biomarker of pregnancy and early fetal loss. Environ Health Perspec, 1987; 74:57–66. Canonico M., et al. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens. Circulation, 2007; 115 (7):840–5. Carmichael S. L., et al. Maternal progestin intake and risk of hypospadias. Arch. Pediatr. Adolesc. Med., 2005; 159:957–962. Carp H. Cytokines in recurrent miscarriage. Lupus, 2004; 13:630–634. Carson-Jurica M. A., Schrader W. T., O’Malley B. W. Steroid receptor family: structure and functions. Endocr. Rev., 1990; 11:201–220. Case A. M., Reid R. L. Effects of the menstrual cycle on medical disorders. Arch. Inter. Med., 1998; 158:1405–1412. Casey M. L., MacDonald P. C. Formation of deoxycorticosterone from progesterone in extraadrenal tissues: demonstration of steroid 21-hydroxylase activity in human aorta. J. Clin. Endocrinol. Metab., 1982; 55:804–806. Casey M. L., Winkel C. A., MacDonald P. C. Conversion of progesterone to deoxycorticosterone in the human fetus: steroid 21-hydroxyase activity in fetal tissues. J. Steroid. Biochem., 1983; 18:449–452. Cassidenti D. L., et al. Ef fects of sex steroids on skin 5 alpha-reductase activity in vitro. Obstet. Gynecol., 1991; 78:103–107. Casson P., et al. Lasting response to ovariectomy in severe intractable premenstrual syndrome. Am. J. Obstet. Gynecol., 1990; 162:99–105. Catt K. J. ABC of endocrinology. I. Hormones in general. Lancet, 1970; 1:763–765. Caufriez A., et al. Progesterone Prevents Sleep Disturbances and Modulates GH, TSH, and Melatonin Secretion in Postmenopausal Women. J. Clin. Endocrinol. Metab., 2011;96:E614–E623. Cauley J. A., et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women’s Health Initiative randomized trial. JAMA, 2003; 290:1729–1738. Cavagna M., Mantese J. C. Biomarkers of endometrial receptivity — a review. Placenta, 2003; 24 (Suppl B):S39–S47. Celayir S., Ilce Z., Dervisoglu S. The sex hormone receptors in the bladder in childhood, I: preliminary report in male subjects. Eur. J. Pediatr. Surg., 2002; 12:312–317. Chabbert-Buffet N., et al. Selective progesterone receptor modulator and progesterone antagonist: mechanism of action and clinical application. Hum. Reprod. Update, 2005; 11:293–307. Chaffin C. L., Hess D. L., Stouffer R. L. Dynamics of periovulatory steroidogenesis in the rhesus monkey follicle after controlled ovarian stimulation. Hum. Reprod., 1999; 14:642–649. Chaffin C. L., Stouffer R. L. Expression of matrix metalloproteinases and their tissue inhibitor messenger ribonucleic acids in macaque periovulatory granulose cells: time course and steroid regulation. Biology of Reproduction, 1999; 61:14–21. Champagne J., et al. Progesterone and Cerebral Function during Emotion Processing in Men and Women with Schizophrenia. Hindawi Publishing Corporation, Schizophrenia Research and Treatment, 2012; 6. Chang R. J. Polycystic ovaries in 2001:physiology and treatment. J. Gynecol. Obstet. Biol. Reprod. (Paris), 2002; 31:1S15–1S19. Channing C. P., et al. Hormonal control of oocyte meiosis, ovulation and luteinization in mammals. Clin. Endocrinol. Metab., 1978; 7 (3):601–24. Channing C. P., et al. Ovarian follicular and luteal physiology. Int. Rev. Physiol.,1980; 22:117–201. Chantilis S. J., et al. Use of Crinone vaginal progesterone gel for luteal support in in vitro fertilization cycles. Fertil. Steril., 1999; 72:823–829. Chao K. H., et al. Decidual natural killer cytotoxity decreased in normal pregnancy but not in anembryonic pregnancy and recurrent spontaneous abortion. Am. J. Reprod. Immunol., 1995; 34:274–280. Chaouat G., et al. A brief review of recent data on some cytokine expressions at the materno-foetal interface that might challenge the classical Th-1/Th-2 dichotomy. J. Reprod. Immunol., 2002; 53:241–256. Charlesworth D. Plant sex determination and sex chromosomes. Heredity, 2002; 88:94–101. Check J. H., et al. Evidence that high serum progesterone (P) levels on day of human chorionic gonadotropin (hCG) injection have no adverse effect on the embryo itself as determined by pregnancy outcome following embryo transfer using donated eggs. Clin. Exp. Obstet. Gynecol., 2010; 37:179–180. Check J. H., et al. Pregnancy rates in donors versus recipients according to the serum progesterone level at the time of human chorionic gonadotropin in a shared oocyte program. Fertil. Steril., 1994; 61:262–264. Check J. H., et al. Progesterone therapy to decrease first-trimester spontaneous abortions in previous aborters. Int. J. Fertil., 1987; 33:192–199. Check J. H., Rankin A., Teichman M. The risk of fetal anomalies as a result of progesterone therapy during pregnancy. Fertil. Steril., 1986; 45:575–577. Check J. H. Th1 and Th2 cytokine profiles in recurrent aborters may merely reflect progesterone status. Hum. Reprod., 2002; 17:1669–1674. Cheng C. M., et al. Estrogen augments glucose transporter and IGF1 expression in primate cerebral cortex. FASEB J., 2001; 15:907–915. Cheremisinoff N. P., King J. A., Boyko R. Dangerous Properties of Industrial and Consumer Chemicals. M. Dekker, 1994:779. Chetkowski R. J., Kiltz R. J., Salyer W. R. In premature luteinization, progesterone induces secretory transformation of the endometrium without impairment of embryo viability. Fertil. Steril., 1997; 68:292–297. Chhabra S., et al. Progesterone inhibition of the hypothalamic gonadotropinreleasing hormone pulse generator: evidence for varied effects in hyperandrogenemic adolescent girls. J. Clin. Endocrinol. Metab., 2005; 90:2810–2815. Chlebowski R. T., et al. Estrogen plus progestin and breast cancer incidence and mortality in postmenopausal women. JA MA,2010; 304:1684–1692. Choi B. C., et al. Progesterone inhibits in vitro embryotoxic Th1 cytokine production to trophoblast in women with recurrent pregnancy loss. Hum. Reprod., 2000; 15:46–59. Chrisler J. C., Caplan P. The strange case of Dr. Jekyll and Ms. Hyde: how PMS became a cultural phenomenon and a psychiatric disorder. Annual Review of Sex Research, 2002; 13:274–306. Christian M., et al. Mechanisms of decidualization. Reproductive Biomedicine. Online, 2002a; 4 (Suppl. 3):24–30. Christiansen O. B., et al. Evidence-based investigations and treatments of recurrent pregnancy loss. Fertil. Steril., 2005; 83:821–839. Christiansen O. B. A fresh look at the causes and treatment of recurrent miscarriage, especially its immunological aspects. Hum. Reprod. Update, 1996; 2:271–293. Christow A., Sun X., Gemzell-Danielsson K. Effect of mifepristone and levonorgestrel on expression of steroid receptors in the human Fallopian tube. Mol. Hum. Reprod., 2002;8:333–340. Chumlea W. C., et al. Age at menarche and racial comparisons in US girls.Pediatrics, 2003; 111:110–113. Chwalisz K., et al. Selective progesterone receptor modulator development and use in the treatment of leiomyomata and endometriosis. Endocrine Reviews, 2005; 26:423–438. Cicinelli E., et al. Direct transport of progesterone from vagina to uterus. Obstet. Gynecol., 2000; 95:403–406. Cicinelli E., et al. Effects of progesterone administered by nasal spray on the human postmenopausal endometrium. Maturitas, 1993; 18:65–72. Cicinelli E., et al. Effects of the repetitive administration of progesterone by nasal spray in postmenopausal women. Fertil. Steril., 1993; 60:1020–1024. Cirigliano M. Bioidentical hormone therapy: a review of the evidence. J. Womens Health (Larchmt), 2007; 16:600–631. Clark C. L., Sutherland R. L. Progestin regulation of cellular proliferation. Endocrine Review, 1990; 11:266–301. Clark D. A., Arck P. C., Chaouat G. Why did your mother reject you? Immunogenetic determinants of the response to environmental selective pressure expressed at uterine level. Am. J. Reprod. Immunol., 1999; 41:5–22. Clark D. A., et al. The emerging role of immunoregulation of fibrinogen-related procoagulant Fgl2 in the success or spontaneous abortion of early pregnancy in mice and humans. Am. J. Reprod. Immunol., 1999; 42:37–42. Clark D. A., et al. Unexplained sporadic and recurrent miscarriage in the new millenium: a critical analysis of immune mechanisms and treatments. Hum. Reprod. Update, 2001; 7:501–511. Clark R. Endpoints of reproductive system development. An evaluation and interpretation of reproductive endpoints for human health risk assessment. Washington, DC: International Life Sciences Institute, 1998; 10–27. Clarke C. L., Sutherland R. L. Progestin regulation of cellular proliferation. Endocr. Rev., 1990; 11:266–301. Clauberg C. Physiologie und Pathologie der Sexualhormone, im Besonderen des Hormons des Corpus luteum. I. Der biologische Test fu¨r das Luteumhormon (das spezielle Hormon des Corpus luteum) am infantilen Kaninchen. Z. Gyna¨kol., Leipzig, 1930; 54:2757–2770. Clausen H. Effect of progesterone and desoxycorticosterone on accessory sex organs of the castrate male guinea pig. Endocrinol., 1942; 31:187–190. Clifford K., Flanagan A. M., Regan L. Endometrial CD56þ natural killer cells in women with recurrent miscarriage: a histomorphometric study. Hum. Reprod.,1999; 14:2727–2730. Clifford K., Rai R., Regan L. Future pregnancy outcome in unexplained recurrent first trimester miscarriage. Hum. Reprod., 1997; 12:387–389. Cloke B., et al. The androgen and progesterone receptors regulate distinct gene networks and cellular functions in decidualizing endometrium. Endocrinol., 2008; 149:4462–4474. Cocuroccia B., et al. Autoimmune progesterone dermatitis Gynecol. Endocrinol., 2006; 22 (1):54–56. Colditz G. A., et al. Risk factors for breast cancer according to estrogen and progesterone receptor status. J. Natl. Cancer Inst., 2004; 96:218–228. Cole L. A., et al. Hyperglycosylated hCG (invasive trophoblast antigen, ITA) a key antigen for early pregnancy detection. Clin. Biochem., 2003; 36:647–655. Cole L. A. Predicting spontaneously aborted (SAB) pregnancies. human chorionic gonadotropin (hCG). Elsevier Inc., 2010; 287–294. Conaway E. Bioidentical Hormones: An Evidence-Based Review for Primary Care Providers. J. Am. Osteopath. Assoc., 2011; 111 (3):153–164. Conneely O. M., Habenicht U. F., Aitken R. J. (eds.). Progesterone Receptors and Ovulation. Fertility Control, Handbook of Experimental Pharmacology 198, Springer Verlag Berlin Heidelberg, 2010: 37–44. Conneely O. M., et al. Reproductive functions of progesterone receptors. Recent Prog. Horm. Res., 2002; 57:339–355. Conneely O. M., et al. Reproductive functions of the progesterone receptor isoforms: lessons from knock-out mice. Mol. Cell. Endocrinol., 2001; 179:97–103. Conneely O. M., Jericevic B. M., Lydon J. P. Progesterone receptors in mammary gland development and tumorigenesis. J. Mamm. Gland. Biol. Neoplas., 2003a; 8:205–214. Conneely O. M., Lydon J. P. Progesterone receptors in reproduction: functional impact of the A and B isoforms. Steroids, 2000; 65:571–577. Conneely O. M., Mulac-Jericevic B., Lydon J. P. Progesterone-dependent regulation of female reproductive activity by two distinct progesterone receptor isoforms. Steroids, 2003b; 68:771–778. Coomarasamy A., et al. Progesterone for the prevention of preterm birth: a critical evaluation of evidence. Eur. J. Obstet. Gynecol. Reprod. Biol., 2006; 129:111–118. Cooper A., et al. Systemic absorption of progesterone from Progest cream in postmenopausal women [letter]. Lancet, 1998; 351:1255–1256. Corner G. W., Allen W. M. Physiology of the corpus luteum. Am J Physiol 1929;88:326–346. Coutifaris C., et al. Histological dating of timed endometrial biopsy tissue is not related to fertility status. Fertil Steril 2004;82:1264–1272. Cowan B. D., Manes C., Hagerman D. D. Progesterone concentration in rabbit uterine flushings before implantation. J. Reprod. Fert., 1976; 47:359–361. Cramer D. W., et al. Human progesterone receptor polymorphisms and implantation failure during in vitro fertilization. Am. J. Obstet. Gynecol., 2003; 189:1085–1092. Critchley H. O., et al. Antiprogestins as a model for progesterone withdrawal. Steroids, 2003; 68:1061–1068. Critchley H. O., et al. Role of inflammatory mediators in human endometrium during progesterone withdrawal and early pregnancy. J. Clin. Endocrino. Metab., 1999; 84:240–248. Critchley H. O., et al. Sex steroid regulation of leukocyte traffic in human decidua. Hum. Reprod. 1996; 11:2257–2262. Critchley O. D., Healy D. L. Effects of estrogens and progesterone on the endometrium. In: Estrogens and progestogens in clinical practice, pp. 145–161. Ed. Ian S.Fraser. London, UK: Churchill Livingstone, 1998. Crombie D. L., et al. Anti-progesterone effects on maternal recognition and behaviour imprinted during first pregnancy in mice. J. Endocrinol., 1995; 147:331–337. Cronje W. H., Vashisht A., Studd J. W. Hysterectomy and bilateral oophorectomy for severe premenstrual syndrome. Hum. Reprod., 2004; 19:2152–2155. Crosby T. F., et al. Effects of exogenous progesterone on gestation length, foetal survival and colostrum yield in ewes. Theriogenology, 2005; 64:1121–1129. Crow J., et al. Mast cells in the female genital tract. Int. J. Gynecol. Pathol., 1991; 10:230–237. Croxatto H. B., Diaz S. The place of progesterone in human contraception. J. Steroid Biochem., 1987; 27:991–994. Csapo A. I., et al. The significance of the human corpus luteum in pregnancy maintenance. I. Preliminary studies. Am. J. Obstet. Gynecol., 1972; 112:1061–1067. Csapo A. I., Pulkkinen M. O., Kaihola H. L. The effect of luteectomy-induced progesterone-withdrawal on the oxytocin and prostaglandin response of the first trimester pregnant human uterus. Prostaglandins, 1973; 4:421–429. Csapo A. I., Pulkkinen M. O., Wiest W. G. Effect of luteectomy and progesterone replacement therapy in early pregnant patient. Am. J. Obstet. Gynecol., 1973; 115:759–765. Csapo A. I., Resch B. Prevention of implantation by antiprogesterone. J. Steroid Biochem., 1979; 11:963–969. Csapo A. I. The «ovariectomy syndrome» and the initiation of labor: International Symposium on Prenatal Life: Biological and Clinical Prospectives. Detroit: Thomas; 1967. Csapo A. I. The luteo-placental shift: the guardian of prenatal life. Postgrad. Med. J., 1969; 45:57–64. Cumming D. C., et al. The late luteal phase in infertile women: comparison of simultaneous endometrial biopsy and progesterone levels. Fertil. Steril., 1985; 43:715–719. Current National legislation relationg to use of certain hormones in animal production. http://www.fao.org/docrep/004/X6533E/X6533E03.htm Curry T. E. Jr., Osteen K. G. The matrix metalloproteinase system: changes, regulation, and impact throughout the ovarian and uterine reproductive cycle. Endocrine Review, 2003; 24:428–465. Czeizel A., Toth J., Erodi E. Aetiological studies of hypospadias in Hungary. Hum. Hered., 1979; 29:166–171. Czeizel A., Toth J. Correlation between the birth prevalence of isolated hypospadias and parental subfertility. Teratology, 1990; 41:167–172. da Fonseca E. B., Damião R., Nicholaides K. Prevention of Preterm Birth Based on Short Cervix: Progesterone. Semin. Perinatol., 2009; 33:334–337. da Fonseca E. B., et al. Prophylactic administration of progesterone by vaginal suppository to reduce the incidence of spontaneous preterm birth in women at increased risk: a randomized placebo-controlled double-blind study. Am. J. Obstet. Gynecol., 2003; 188:419–424. Dahmoun M., et al. Apoptosis, proliferation, and sex hormone receptors in superficial parts of human endometrium at the end of the secretory phase. J. Clin. Endocrinol. Metab., 1999; 84:1737–1743. Dal Prato L., Borini A. Use of antagonists in ovarian stimulation protocols. Reprod. Biomed. Online, 2005; 10:330–338. Dalton K. Ante-natal Progesterone and Intelligence. BJP, 1968; 114:1377–1382. Dalton K. Prenatal progesterone and educational attainments. BJP, 1976; 129:438–442. Daneshmand S., et al. Very early hCG dynamics predict pregnancy loss at up to 10 weeks gestation. Fertil. Steril., 2007; 88:S159. Danilenko K., Sergeeva O., Verevkin E. Menstrual cycles are influenced by sunshine. Gynecol. Endocrinol., 2011; 27 (9):711–716. Das R. M., Martin L. Progesterone inhibition of mouse uterine epithelial proliferation. J. Endocrinol. 1973; 59:205–206. Davies J., Kadir R. A. Endometrial haemostasis and menstruation. Rev. Endocr. Metab. Disord., 2012; 13:289–299. Davison S. Salivary testing opens a Pandora’s box of issues surrounding accurate measurement of testosterone in women. Menopause, 2009; 16:630–631. Dawood M. Y. Corpus luteal insufficiency. Curr. Opin. Obstet. Gynecol., 1994; 6:121–127. Dawson R. F. Diosgenin Production in North America: A Brief History. American Society for Horticultural Science. HortTechnology, 1991; 1:22–27. Daya S., Gunby J. Luteal phase support in assisted reproduction cycles. Cochrane Database Syst. Rev., 2004; 3:CD004830. Daya S. Efficacy of progesterone support for pregnancy in women with recurrent miscarriage. A meta-analysis of controlled trials. Br. J. Obstet. Gynecol., 1989; 96:257–260. Daya S. Evaluation and management of recurrent spontaneous abortion. Curr. Opin. Obstet. Gynecol., 1993; 8:188–192. Daya S. Human chorionic gonadotropin increase in normal early pregnancy. Am. J. Obstet. Gynecol., 1987; 156:286–290. Daya S. Immunotherapy for unexplained recurrent spontaneous abortion. Infertil. Reprod. Med. Clin. North. Am., 1997; 8:65–77. Daya S. Issues in the etiology of recurrent spontaneous abortion. Curr. Opin. Obstet. Gynecol., 1994; 6:153–159. De Geyter, et al. Progesterone serum level during the follicular phase of the menstrual cycle originate from crosstalk between the ovaries and adrenal cortex. Human Reproduction, 2002; 17:4:933–939. De Lignieres B., et al. Indluence of route administration on progesterone metacolism. Maturitas, 1995; 21:251–257. de Lignieres B. Oral micronized progesterone. Clin. Ther., 1999; 21:41–60; discussion 1–2. De Souza A., et al. Genital anomalies with maternal exposure to progesterone in mice. American Urological Society Annual Meeting, San Francisco, May 8–13, 2004. De Vivo I., et al. A functional polymorphism in the promoter of the progesterone receptor gene associated with endometrial cancer risk. Proc. Natl. Acad. Sci. USA, 2002; 99:12263–12268. Dean H. J., Winter J. S. The effect of five synthetic progestational compounds on 5-alpha-reductase activity in genital skin fibroblast monolayers. Steroids, 1984; 43:13–24. DeFranco E. A., et al. Vaginal progesterone is associated with a decrease in risk for early preterm birth and improved neonatal outcome in women with a short cervix: a secondary analysis from a randomized, double-blind, placebo-controlled trial. Ultrasound Obstet. Gynecol., 2007;30:697–705. Dennerstein L., et al. Mood and the menopausal transition. J. Nerv. Ment. Dis.,1999;187:685–691. Dennis C. L., Ross L. E., Herxheimer A. Oestrogens and progestins for preventing and treating postpartum depression. Cochrane Database Syst. Rev., 2008; 4:CD001690. Derry P. S., Derry G. N. Menstruation, Perimenopause, and Chaos Theory. Perspectives in Biology and Medicine, 2012; 55 (1):26–42. Desreux J., et al. Progesterone receptor activation: an alternative to SERMs in breast cancer. Eur. J. Cancer, 2000; 36 (sup. 4):90–91. Dey S. K., et al. Molecular cues to implantation. Endocrine Reviews, 2004; 25:341–373. Di Carlo C., et al. Use of leuprolide acetate plus tibolone in the treatment of severe premenstrual syndrome. Fertil. Steril., 2001; 76:850–852. Di Paolo T., et al. Effect of acute and chronic 17-beta-estradiol treatment on serotonin and 5-hydroxyindole acetic acid content of discrete brain nuclei of ovariectomized rat. Exp. Brain. Res., 1983; 51:73–76. Di Renzo G. C., et al. Progesterone and pregnancy. Curr. Opin. Obstet. Gynecol., 2005; 17: 589–600. Di Renzo G. C., et al. The role of progesterone in maternal and fetal medicine. Gynecol. Endocrinol., 2012; 28 (11):925–932. Di Zerega G. S., Hodgen G. D. Folliculogenesis in the primate ovarian cycle. Endocr. Rev., 1981; 2:27–49. Diamond M., LLacuna A., Wong C. L. Sex behavior after neonatal progesterone, testosterone, estrogen, or antiandrogens. Horm. Behav., 1973; 4:73–88. Dickens C. Household words. 1852; 95:385–389. Dilley A., et al. von Willebrand disease and other inherited bleeding disorders in women with diagnosed menorrhagia. Obstet. Gynecol., 2001; 97:630–636. Ding Y. Q., et al. Progesterone stimulates calcitonin gene expression in the uterus during implantation. Endocrinol., 1994; 135:2265–2274. Dodd J. M., et al. Prenatal administration of progesterone for preventing preterm birth [review]. Cochrane Database Syst. Rev., 2006; 2:CD004947. Dodd J. M., et al. Progesterone for the prevention of preterm birth. Obstet. Gynecol., 2008; 112:127–134. Dodd J. M., et al. Progesterone supplementation for preventing preterm birth: a systematic review and meta-analysis. Acta Obstet Gynecol Scand 2005;84:526–533. Doglioni C, et al. Immunocytochemical localization of progesterone receptors in endocrine cells of the human pancreas. Am. J. Pathol., 1990; 137:999–1005. Doldi N., et al. Polycystic ovary syndrome: anomalies in progesterone production. Hum. Reprod., 1998; 13:290–293. Domenice S., et al. Mutations in the SRY, DAX1, SF1 and WNT4 genes in Brazilian sex-reversed patients. Braz. J. Med. Biol. Res., 2003; 36 (12):145–150. Dong Y. L., et al. Regulation of inducible nitric oxide synthase messenger ribonucleic acid expression in pregnant rat uterus. Biol. Reprod., 1998; 59:933–940. Donnet M. L., et al. Return of ovarian function following spontaneous abortion. Clin. Endocrinol. (Oxf.), 1990; 33:13–20. Doody K. J., et al. Endometrin for luteal phase support in a randomized, controlled, open-label, prospective IVF clinical trial using a combination of Menopur and Bravelle. Fertil. Steril., 2009; 91:1012–1017. Doyle E. FRI Briefings, Human safety of hormone implants used to promote growth in cattle. Food Research Institute, University of Wisconsin, Madison, 2000. Dressing G. E., et al. Progesterone receptors act as sensors for mitogenic protein kinases in breast cancer models. Endocrine Related Cancer, 2009; 16:351–361. Druckmann R., Druckmann M. A. Progesterone and the immunology of pregnancy. J. Steroid. Biochem. Mol. Biol., 2005; 97:389–396. Drummond-Robinson G., Asdell S. A. The relation between the corpus luteum and the mammary glan. J. Physiol., 1926, August 6; 61 (4):608–614. Dube J., Ngo-Thi N., Tremblay R. In vivo effects of steroid hormones on the testosterone 5-alpha-reductase in rat skin. Endocrinol., 1975; 97:211–214. Duggavathi R., Murphy D. B. Ovulation Signals. Science, 2009; 324:890–891. Dutt R. H., Casida L. E. Alteration of the estrual cycle in sheep by use of progesterone and its effect upon subsequent ovulation and fertility. Endocrin., 1948; 43:208. Eblen A. C., et al. Alterations in humoral immune responses associated with recurrent pregnancy loss. Fertil. Steril., 2000; 73:305–313. Echternkamp S. E., Lunstra D. D. Relationship between LH and testicular development in progesterone-implanted prepubertal ram lambs. J. Anim. Sci., 1984; 59:441–453. Edefonti V., et al. Nutrient dietary patterns and the risk of breast and ovarian cancers. Int. J. Cancer, 2008; 122:609–613. Edelstein M. C., et al. Progesterone levels on the day of human chorionic gonadotropin administration in cycles with gonadotropin-releasing hormone agonist suppression are not predictive of pregnancy outcome. Fertil. Steril., 1990; 54:853–857. Edgren R. A., Stanczyk F. Z. Nomenclature of the Gonane Progestins. Contraception, 1999; 60 (6):313. Edlund M., Andersson E., Fried G. Progesterone withdrawal causes endothelin release from cultured human uterine microvascular endothelial cells. Hum. Reprod., 2004; 19 (6):1272–1280. Edson M. A. et al. The mammalian ovary from genesis to revelation. Endocrine Reviews, 2009; 30 (6):624–712. Eisenbach M., Giojalas L. C. Sperm guidance in mammals — an unpaved road to the egg. Nature Rev. Mol. Cell. Biol., 2006; 7:276–285. Eldred S. M. Menstruation Myths. New Moon, 1998; 5.6:40. Elovainio M., et al. Depressive symptoms as predictors of discontinuation of treatment of menorrhagia by levonorgestrel-releasing intrauterine system. Int. J. Behav. Med., 2007; 14:70–75. El-Zibdeh M. Y. Dydrogesterone in the reduction of recurrent spontaneous abortion. J. Steroid. Biochem. Mol. Biol., 2005; 97:431–434. Emera D., Romero R., Wagner G. The evolution of menstruation: A new model for genetic assimilation. Bioessays, 2011; 34: 26–35. Endocrine Society. Bioidentical hormones: position statement. 2006. http://www.endosociety.org/advocacy/policy Ericson A., Kallen B. Congenital malformations in infants born after IVF: a population-based study. Hum. Reprod., 2001; 16:504–509. Ertman N., Andreano J. M, Cahill L. Progesterone at encoding predicts subsequent emotional memory. Learn Mem., 2011; 18:759–763. Esplin M. S., et al. Estimating recurrence of spontaneous preterm delivery. Obstet. Gynecol., 2008 112 (3):516–523. Evans J., Salamonsen L. A. Inflammation, leukocytes and menstruation. Rev. Endocr. Metab. Disord., 2012; 13:277–288. Evans R. M. The steroid and thyroid hormone receptor superfamily. Science, 1988;240:889–895. Facchinetti F., et al. Cervical length changes during preterm cervical ripening: effects of 17-alpha-hydroxyprogesterone caproate. Am. J. Obstet. Gynecol., 2007; 196 (5):453.e1–453.e4. Falsetti C., et al. Decreased responsiveness to progesterone of spermatozoa in oligozoospermic patients. J. Androl., 1993; 14:17–22. Fanchin R., et al. Transvaginal administration of progesterone. Obstet. Gynecol., 1997; 90:396–401. Fanchin R., et al. Hormonal influence on the uterine contractility during ovarian stimulation. Hum. Reprod., 2000; 15:90–100. Fanchin R., et al. Uterine contractions at the time of embryo transfer alter pregnancy rates after in-vitro fertilization. Hum. Reprod.,1998; 13:1968–1974. Fanhin R., et al. Premature elevation of plasma progesterone alters pregnancy rates of in vitro fertilization and embryo transfer. Fertil. Steril., 1993; 59:1090–1094. Farine D., Mundle W. R., Dodd J. The use of progesterone for prevention of preterm birth. J. Obstet. Gynecol. Can., 2008; 30:67–71. Farquaharson R. G., Klopper A. I. Progesterone concentrations in maternal and fetal blood. BJOG, 1984; 91:133–137. Fatemi H. M., et al. An update of luteal phase support in stimulated IVF cycles. Hum. Reprod. Update, 2007; 13:581–590. Fauser B. C., Devroey P. Reproductive biology and IVF: ovarian stimulation and luteal phase consequences. Trends Endocrinol. Metab., 2003; 14:236–242. Faust Z., et al. Progesterone induced blocking factor inhibits degranulation of NK cells. Am. J. Reprod. Immunol., 1999; 42:71–75. Fazleabas A. T. Progesterone resistance in a baboon model of endometriosis. Sem. Reproduc. Med., 2010; 28:75–80. Fechner P. Y., et al. The role of the sex-determining region Y gene in the etiology of 46,XX maleness. J. Clinical Endocrine Metabolism, 1993; 76:690–695. Ferencz C., et al. Maternal hormone therapy and congenital heart disease. Teratology, 1980; 21:225–239. Ferin M. Neuroendocrine control of ovarian function in the primate. J. Reprod. Fertil., 1983; 69:369–81. Ferre F., et al. Oral administration of micronized natural progesterone in late human pregnancy. Effects on progesterone and estrogen concentrations in the plasma, placenta, and myometrium. Am. J. Obstet. Gynecol., 1984; 148:26–34. Ferretti G., Felici A., Cognetti F. The protective side of progesterone. Breast Cancer Research, 2007; 9:402. Fetal effects of exogenous progesteroine. Birth Defects Research (Part B), 2006; 77:455–470. Fiad T. M., Cunningham S. K., McKenna T. J. Role of P deficiency in the development of luteinizing hormone and androgen abnormalities in polycystic ovary syndrome. Eur. J. Endocrinol., 1996; 135:335–339. Files J. A., Ko M. G., Pruthi S. Bioidentical Hormone Therapy Concise review for clinicians. Mayo Clin. Proc., 2011; 86 (7):673–680. Filicori M., Butler J. P., Crowley W. F. Jr. Neuroendocrine regulation of the corpus luteum in the human. Evidence for pulsatile progesterone secretion. J. Clin. Invest., 1984; 73:1638–1647. Fisch H., et al. Maternal age as a risk factor for hypospadias. J. Urol., 2001; 165:934–936. Fitzpatrick L. A., Good A. Micronized progesterone: clinical indications and comparison with current treatments. Fertil. Steril., 1999; 72:389 –97. Fitzpatrick L. A., Pace C., Wiita B. Comparison of regimens containing oral micronized progesterone or medroxyprogesterone acetate on quality of life in postmenopausal women: a cross-sectional survey. J. Womens Health Gend. Based Med., 2000; 9 (4):381–7. Fleming R., et al. Spontaneous follicular and luteal function in infertile women with oligomenorrhoea: role of luteinizing hormone. Clin. Endocrinol. (Oxf), 1995; 43:735–739. Fomin V., Cox B., Word R. Effect of progesterone on intracellular Ca (2+) homeostasis on human myometrial smooth muscle cells. Am. J. Physiol., 1999; 276 (2, pt.1):C379–C385. Fonseca E. B., et al. Fetal Medicine Foundation Second Trimester Screening Group. Progesterone and the risk of preterm birth among women with a short cervix. N. Engl. J. Med., 2007; 357 (5):462–469. Food and Drug Administration. Bio-identicals: sorting myth from fact. US Food and Drug Administration. Web site. http://www.fda.gov/ForConsumers/ConsumerUpdates/ucm049311.htm. Food and Nutrition Board. Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients). Washington, DC: Institute of Medicine, 2005. Foote W., Foote L. Influence of certain natural and synthetic steroids on genital development in guinea pigs. Fertil. Steril., 1964; 19:606–615. Ford O., et al. Progesterone for premenstrual syndrome. Cochrane Database of Systematic Reviews, 2009. Issue 2. Art. No.:CD003415. Fournier A., et al. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort. Int. J. Cancer, 2005; 114 (3):448–54. Fowler R. E., et al.The progesterone content of rabbit uterine flushings. J. Reprod. Fert., 1977; 50:301–308. Fraenkel L. Die Function des Corpus Luteum, Arch. f.Gyn, 1903; 68:438. Franchimont P., et al. Correlation between follicular fluid content and the results of in vitro fertilization and embryo transfer. I. Sex steroids. Fertil. Steril., 1989; 52:1006–1011. Franco H. L., et al. In vivo analysis of progesterone receptor action in the uterus during embryo implantation. Seminars in Cell & Developmental Biology, 2008; 19:178–186. Frank R. T. The Ovary and the Endocrinologist. JAMA, 1922; 78:181. Freedman D. S., et al. Relation of age at menarche to race, time period, and anthropometric dimensions: the Bogalusa Heart Study. Pediatrics, 2002; 110:e43. Freeman E. W. Premenstrual syndrome and premenstrual dysphoric disorder: definitions and diagnosis. Psychoneuroendocrinology, 2003; 28:25–37. Friedler S., et al. Luteal phase characteristics following GnRH antagonist or agonist treatment — a comparative study. Reprod. Biomed., Online, 2006; 12:27–32. Friedman C. I., Kim M. H. Obesity and its effect on reproductive function. Clin. Obstet. Gynecol., 1985; 28:645–663. Frisch R. E., Revelle R. Height and weight at menarche and a hypothesis of critical body weights and adolescent events. Science, 1970; 169:397–399. Frisch R. E. Body fat, menarche, fi tness and fertility. Hum. Reprod., 1987; 2:521–533. Frishman G. N., Hackett R. J., McGrath M., Metheny W. P. Evaluation of the prognosis of in vitro fertilization pregnancies with initially low serum human chorionic gonadotropin levels. Am. J. Obstet. Gynecol., 2001; 185:2392–2395. Frobenius W. Ludwig Fraenkel: ’spiritus rector’ of the early progesterone research. Europ. J. Obstet. Gynecol. Reproduc. Biol., 1999; 83:115–119. Frye C. A., Walf A. A. Estrogen and/or progesterone administered systemically or to the amygdala can have anxiety-, fear-, and pain-reducing effects in ovariectomized rats. Behavioral Neuroscience, 2004; 118:306–313. Furukawa K., et al. Hormonal pregnancy tests and congenital malformation. Nature, 1967; 216:83. Gallagher E. J. Application of likelihood ratios to clinical decision rules: defining the limits of clinical expertise. Ann. Emerg. Med., 1999; 34:664–667. Gallaway M. S. The association between maternal use of spermicides, condoms, intra-uterine devices or progesterone and major structural birth defects. The University od Texas School of Public Health. Houston, 2008;139. Gambrell Jr. R. D. Prevention of endometrial cancer with progestogens. Maturita, 1986;8:159–168. Gann P. H., et al. The effects of a lowfat/high-fiber diet on sex hormone levels and menstrual cycling in premenopausal women: a 12-month randomized trial (the diet and hormone study). Cancer, 2003; 98:1870–1879. Garcia E., et al. Use of immunocytochemistry of progesterone and estrogen receptors for endometrial dating. J. Clin. Endocrinol. Metab., 1988; 67:80–87. Garde R. V., Saner C. N., Price T. M. Discovery of a truncated progesterone receptor (PR-M) in the mitochondria; Plenary Oral Presentation, Wyeth Presidential Award, Society for Gynecological Investigation at the 53rd Annual Meeting; Toronto, Canada. March 2006. Gardill B. R., et al. Corticosteroid-Binding Globulin: Structure-Function Implications from Species Differences. PLoS ONE, 2012; 7 (12):e52759. Garn S. M., LaVelle M. Reproductive histories of low weight girls and women. Am. J. Clin. Nutr., 1983; 37:862–6. Gaskins A. J., et al. Effect of daily fiber intake on reproductive function: the BioCycle Study1–3. Am. J. Clin. Nutr., 2009; 90:1061–1069. Gauche´-Cazalis C., et al. Endometriosis and implantation: Myths and facts. Middle East Fertility Society Journal, 2012; 17:79–81. Gavrilova-Jordan L. P., et al. Expression of a truncated progesterone receptor isoform (PR-M) in pregnant and laboring myometrium. Reprod. Sci., 2009; 16 (3 suppl):114A. Gavrilova-Jordan L. P., et al. Expression of a truncated progesterone receptor (PR-M) correlates with mitochondrial content in human tissues. Reprod. Sci., 2009; 16 (3 suppl):189A. Gelle P., Schaeffer P. Apropos of the use of dydrogesterone in gynecology and obstetrics; clinical experience. Bull. Fed. Soc. Gynecol. Obstet. Lang. Fr., 1965; 17:369–370. Gellersen B., Brosens I. A., Brosens J. J. Decidualization of the human endometrium: mechanisms, functions, and clinical perspectives. Sem. Reproduc. Med., 2007; 25:445–453. Gellersen B., Brosens J. Cyclic AMP and progesterone receptor cross-talk in human endometrium: a decidualizing affair. J. Endocrinol., 2003; 178:357–372. Gellersen B., Fernandes M. S., Brosens J. J. Non-genomic progesterone actions in female reproduction. Human Reproduction Update, 2009; 15:119–138. Gemmell R. T. A comparative study of the corpus luteum. Reprod. Fertil. Dev., 1995; 7:303–312. Genazzani A. R., et al. Progesterone, progestagens and the central nervous system. Hum. Reprod., 2000; 15 Suppl 1:14–27. Gerhard I., et al. Doubleblind controlled trial of progesterone substitution in threatened abortion. Biol. Res. Pregnancy Perinatol.,1987; 8:26–34. Gharabaghi P., et al. Comparing the levels of ßHCG, progesterone and estradiol between ectopic pregnancy and normal intrauterine pregnancy.Iranian Journal of Reproductive Medicine, 2007; 5 (4):187–190. Giangrande P. H., et al. The opposing transcriptional activities of the two isoforms of the human progesterone receptor are due to differential cofactor binding. Mol. Cell. Biol.,2000; 20:3102–3115. Gibaldi M., Boyes R. N., Feldman S. Influence of first-pass effect on availability of drugs on oral administration. J. Pharm. Sci., 1971; 60:1338–1340. Gill J. The effect of moderate alcohol consumption on female hormone lebels and reproductive function. Alcohol & Alcoholism, 2000; 35 (5):417–423. Gillet J. Y., et al. Induction of amenorrhea during hormone replacement therapy: optimal micronized progesterone dose. A multicenter study. Maturitas, 1994; 19:103–115. Ginsberg K. A., Dinsay R. In: Ransom S. B., ed. Practical Strategies in Obstetrics and Gynecology. Philadelphia: W.B. Saunders; 2000:684–9. Giudice L. C., Kao L. C. Endometriosis. Lancet, 2004; 364:1789–1799. Giudice L. C. Genes associated with embryonic attachment and implantation and the role of progesterone. J. Reprod. Med., 1999; 44:165–171. Giudice L. C. Implantation and endometrial function. In: Reproductive medicine Molecular, cellular and genetic fundamentals, Ed. B.C.Fauser. Lancaster: Parthenon, 2002; 439–461. Givens C. R., et al. Elevated serum progesterone levels on the day of human chorionic gonadotropin administration do not predict outcome in assisted reproduction cycles. Fertil. Steril., 1994; 62:1011–1017. Goktolga U., et al. Assessment of the predictive value of serum progesterone levels on early pregnancy prognosis in spontaneous twin gestations: A prospective study. Europ. J. Obstet. Gynecol. Reprod. Biol., 2008; 137:185–188. Goldenberg R. L., et al. Epidemiology and causes of preterm birth. Lancet, 2008; 371:75–84. Goldman A. S., Bongiovanni A. M. Induced genital anomalies. Ann. NY Acad. Sci.,1967; 142:755–767. Goldman S., et al. Progesterone receptor expression in human decidua and fetal membranes before and after contractions: possible mechanism for functional progesterone withdrawal. Mol. Hum. Reprod., 2005; 11:269–277. Goldstein P., et al. A meta-analysis of randomized control trials of progestational agents in pregnancy. Br. J. Obstet. Gynecol., 1989; 96:265–274. Goldzieher J. W. Double-blind trial of a progestin in habitual abortion. JAMA, 1964; 188:651–654. Goletiani N. V., Keith D. R., Gorsky S. J. Progesterone: Review of Safety for Clinical Studies. Experimental and Clinical Psychopharmacology, 2007; 15 (5):427–444. Golub M. S., et al. ’Natural’ Progesterone: Information on Fetal Effects Birth Defects Research (Part B), 2006; 77:455–470. Golub M. S., et al. Evidence on developmental and reproductive toxicity of progesterone. Reproductive and Cancer, Hazard Assessment Section, August 2004. Gómez E., Tarín J. J., Pellicer A. Oocytes maturation in humans: the role of gonadotrophins and growth factors. Fertil. Steril., 1993; 60:40–46. Gonda X., et al. Patterns of Mood changes throughout the reproductive cycle in healthy women without premenstrual dysphoric disorders. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 2008; 32:1782–1788. Gonzalez-Arenas A., et al. Regulation of progesterone receptor isoforms expression by sex steroids in the rat lung. J. Steroid Biochem. Mol. Biol., 2003; 85:25–31. Gorodeski G. I. Is progesterone a vasodilator? Menopause, 2004; 11 (3):242–243. Gottschall J. A., Gottschall T. A. Are per-incident rape-pregnancy rates higher than per-incident consensual pregnancy rates? Human Nature, 2003; 14:1–20. Goyeneche A. A., Caron R. W., Telleria C. M. Mifepristone inhibits ovarian cancer cell growth in vitro and in vivo. Clinical Cancer Research, 2007; 13:3370–3379. Gracia C. R., Barnhart K. T. Diagnosing ectopic pregnancy: decision analysis comparing six strategies. Obstet. Gynecol., 2001; 97:464–470. Graham J. D., Clarke C. L. Physiological action of progesterone in target tissues. Endocrine Reviews, 1997; 18:502–519. Graham J. D., et al. Characterization of progesterone receptor A and B expression in human breast cancer. Cancer Research, 1995; 55:5063–5068. Graham J. D., et al. DNA replication licensing and progenitor numbers are increased by progesterone in normal human breast. Endocrinol., 2009; 150:3318–3326. Gray S. H., et al. Salivary Progesterone Levels Before Menarche: A Prospective Study of Adolescent Girls. J. Clin. Endocrinol. Metab., 2010; 95:3507–3511. Graziottin A., Serafini A. Depression and the menopause: why antidepressants are not enough? Menopause Int., 2009; 15:76–81. Greendale G. A., et al. Symptom relief and side effects of postmenopausal hormones: results from the Postmenopausal Estrogen/Progestin Interventions Trial. Obstet. Gynecol., 1998; 2 (6):982–8. Greene R., Burrill M., Ivy A. Progesterone is androgenic. Endocrinol., 1939; 24:351–357. Gregoire A. J., et al. Transdermal oestrogen for treatment of severe postnatal depression. Lancet, 1996; 347:930–933. Gruber C. J., Huber J. C. Differential effects of progestins on the brain. Maturitas, 2003; 46 (Suppl 1):71–75. Gruber C. J., Huber J. C. The role of dydrogesterone in recurrent (habitual) abortion. J. Ster. Biochem. Mol. Biol., 2005; 97:426–430. Gruber I., Just A., Birner M., Lo¨sch A. Serum estradiol/progesterone ratio on day of embryo transfer may predict reproductive outcome following controlled ovarian hyperstimulation and in vitro fertilization. J. Exp. Clin. Assist. Reprod., 2007; 4:1. Grumbach M., Ducharme J., Moloshok R. On the fetal masculinising action of certain oral progestins. J. Clin. Endocrinol. Metab., 1959; 19:1369–1380. Guapo V. G., et al. Effects of sex hormonal levels and phases of the menstrual cycle in the processing of emotional faces. Psychoneuroendocrinology, 2009; 34 (7):1087–1094. Gude N. M., et al. Growth and function of the normal human placenta. Thromb Res., 2004; 114:397–407. Guerra J. A., López-Muñoz F., Álamo C. Progestins in Combined Contraceptives. J. Exp. Clin. Med., 2013; 5 (2):51–56. Guo S. W. Epigenetics of endometriosis. Mol. Human. Reproduc., 2009; 15:587–607. Gupta S., et al. Pathogenic mechanisms in endometriosis-associated infertility. Fertil. Steril., 2008; 90:247–257. Haines C. J., Emes A. L. The relationship between follicle diameter, fertilization rate and microscopic embryo quality. Fertil. Steril., 1991; 55:205–207. Halbreich U., Borenstein J., Pearlstein T., Kahn L. S. The prevalence, impairment, impact, and burden of premenstrual dysphoric disorder (PMS/PMDD). Psychoneuroendocrinology, 2003; 28 (Suppl 3):1–23. Halbreich U., et al. Premenstrual changes and changes in gonadal hormones. Acta Psychiatrica Scandinavica, 1986; 74:576–586. Hampton A. L., Salamonsen L. A. Endometrial expression of messenger ribonucleic acid encoding matrix metalloproteinases and their tissue inhibitors coincides with menstruation. J. Endocrinol., 1994; 141:R1–R3. Haney A. F., Hughes S. F., Hughes Jr. C. L. Synthetic estrogens suppress granulose cell progesterone production in vitro. Reproductive Toxicology, 1990; 4:3–10. Hardie E. A. Prevalence and predictors of cyclic and noncyclic affective change. Psychology of Women Quarterly, 1997; 21:299–314. Hargrove J. T., Maxson W. S., Wentz A. C. Absorption of oral progesterone is influenced by vehicle and particle size. Am. J. Obstet. Gynecol., 1989; 161:948–951. Harini C., et al. Progesterone administration induces preimplantation embryonic loss in mice. Fertil. Steril., 2009; 91:2137–2141. Harlap S., Prywes R., Davies A. M. Letter: Birth defects and oestrogens and progesterones in pregnancy. Lancet, 1975; 1:682–683. Harper C. V., et al. Encoding of progesterone stimulus intensity by intracellular [Ca2+] ([Ca2+] i) in human spermatozoa. Biochem. J., 2003; 372:407–417. Harrison W. M., et al. Characteristics of women seeking treatment for premenstrual syndrome. Psychosomatics, 1989a; 30:405–411. Hartmann M., Wettstein A. Ein krystallisiertes Hormon aus Corpus luteum. Helvetica Chimica Acta, 1934; 17:878–882. Haskins A. L., Taubert S. D. Progesteron transportation in blood. JACOG, 1963; 21 (4):395–399. Hawgood B. J. Karl Heinrich Slotta (1895–1987) biochemist: snakes, pregnancy and coffee. Toxicon, 2001; 39:1277–1282. Hayashi A., et al. Dienogest increases the progesterone receptor isoform B/A ratio in patients with ovarian endometriosis. Journal of Ovarian Research, 2012; 5:31–39 Hayles A. B., Nolan R. B. Female pseudohermaphroditism; report of case in an infant born of a mother receiving methyltestosterone during pregnancy. Mayo Clin. Proc., 1957; 32:41–44. Heikinheimo O., et al. Estrogen and progesterone receptor mRNA are expressed in distinct pattern in male primate reproductive organs. J. Assist. Reprod. Genet., 1995; 12:198–204. Heinonen O. P., et al. Cardiovascular birth defects and antenatal exposure to female sex hormones. N. Engl. J. Med., 1977; 296:67–70. Henderson J. Ernest Starling and ’Hormones’: an historical commentary. Endocrinol., 2005; 184:5–10. Hendricks M. S., Chin H., Loh S. F. Treatment outcome of women with a single ovary undergoing in vitro fertilisation cycles/ Singapore Med. J., 2010; 51 (9):698. Hendrickx A. G., et al. Embryotoxicity of sex steroidal hormone combinations in nonhuman primates: L-Norethisterone acetate + ethinylestradiol and progesterone + estradiol benzoate (Macaca mulatta, Macaca fascicularis, and Papio cynocephalus). Teratology, 1987; 35:119–127. Henmi H., et al. Effects of ascorbic acid supplementation on serum progesterone levels in patients with a luteal phase defect. Fertil. Steril., 2003; 80 (2):459–461. Henriet P., Chevronnay H. P. G., Marbaix E. The endocrine and paracrine control of menstruation. Molecular and Cellular Endocrinology, 2012; 358:197–207. Hensleigh P. A., Fainstat T. Corpus luteum dysfunction: serum progesterone levels in diagnosis and assessment of therapy for recurrent and threatened abortion. Fertil. Steril., 1979; 32:715–719. Hermann A. C., et al. Over-the-counter progesterone cream produces significant drug exposure compared to a food and drug administration-approved oral progesterone product. J. Clin. Pharmacol., 2005; 45:614–619. Hermann W. L., Schlindler A. M. Wyss R., Bischoff P. Effects of anti-progesterone RU 486 in early pregnancy and during the menstrual cycle. In: Beaulieu E. E., Siegel S., editors. The Antiprogestin Steroid RU 486 and Human Fertility Control. New York: Plenum; 1985; 259–262. Hertig A. T. Allen and Doisy’s ’An Ovarian Hormone’. JAMA, 1983; 250 (19):2684–2688. Herzog A. G. Hormonal Therapies: Progesterone Neurotherapeutics: The Journal of the American Society for Experimental NeuroTherapeutics, 2009; 6:383–391. Herzog A. G. Progesterone therapy in complex partial and secondary generalized seizures. Neurology, 1995; 45:1660–1662. Herzog A. G. Progesterone therapy in women with epilepsy: a 3-year follow-up. Neurology, 1999; 52:1917–1918. Hewedi I. H., et al. Diagnostic value of progesterone receptor and p53 expression in uterine smooth muscle tumors. Diagnostic Pathology, 2012; 7:1. Hibbert M. L., et al. Midcycle administration of a progesterone synthesis inhibitor prevents ovulation in primates. Proceedings of the National Academy of Sciences of the United States of America, 1996; 93:1897–1901. Hickey M., et al. Long-term progestin-only contraceptives result in reduced endometrial blood flow and oxidative stress. J. Clin. Endocrinol. Metab., 2006; 91:3633–3638. Hicks C. W., Rome E. S. Menstrual manipulation: Options for suppressing the cycle. Cleveland Clinical Journal of Medicine, 2010; 77 (7):445–453. Hidalgo M., et al. Bleeding patterns and clinical performance of the levonorgestrel-releasing intrauterine system (Mirena) up to two years. Contraception. 2002; 65:129–132. Hildebrand M. S., et al. Genetic male infertility and mutation of CATSPER ion channels. Eur. J. Hum. Genet., 2010; 18:1178–1184. Hileman S. M., Pierroz D. D., Flier J. S. Leptin, Nutrition, and Reproduction: Timing is Everything. J. Clin. Endocrinol. Metab., 2000; 85:804–807. Hill M., et al. Reduced Progesterone Metabolites in Human Late Pregnancy. Physiol. Res., 2011; 60:225–241. Hill P., et al. Diet and follicular development. Am. J. Clin. Nutr., 1984; 39:771–777. Hillard P. Menstruation in adolescents, what’s normal, what’s not. Ann. N. Y. Acad. Sci., 2008; 1135:29–35. Hillier S. G. Sex steroid metabolism and follicular development in the ovary. Oxf. Rev. Reprod. Biol., 1985; 7:168–222. Hillman D. Fetal masculinization with maternal progesterone therapy. Can. M. A. J., 1959; 80:200–201. Hodges Y. K., et al. Variant estrogen and progesterone receptor messages in human vascular smooth muscle. Circulation, 1999; 99 (20):2688–2693. Hofmann G. E., et al. Evaluation of the reproductive performance of womenwith elevated day 10 progesterone levels during ovarian reserve screening. Fertil. Steril., 1995; 63:979–983. Holmes P. V., et al. Effects of high and low preovulatory concentrations of progesterone on ovulation from the isolated perfused rabbit ovary. J. Reprod. Fertil., 1985; 75,393–399. Holtorf K. The bioidentical hormone debate: are bioidentical hormones (estradiol, estriol, and progesterone) safer or more efficacious than commonly used synthetic versions in hormone replacement therapy? Postgrad. Med., 2009; 121:73–85. Homan G., et al. Human chorionic gonadotropin as a predictor of outcome in assisted reproductive technology pregnancies. Fertil. Steril., 2000; 73:270–274. Hopp T. A., et al. Breast cancer patients with progesterone receptor PR-A-rich tumors have poorer disease-free survival rates. Clinical Cancer Research, 2004; 10:2751–2760. Horta J. L., et al. Direct evidence of luteal insufficiency in women with habitual abortion. Obstet. Gynecol., 1977; 49:705–708. Hsieh C. C., et al. Age at menarche, age at menopause, height and obesity as risk factors for breast cancer: associations and interactions in an international casecontrol study. Int. J. Cancer, 1990; 46:796–800. Huber J. C., Ott J. The dialectic role of progesterone. Maturitas, 2009; 62:326–329. Hudson R., Pharriss B. B., Tillson S. A. Preclinical evaluation of intrauterine progesterone as a contraceptive agent. III. Embryology and toxicology. Contraception, 1978; 17:489–497. Hughes G. C. Progesterone and autoimmune disease. Autoimmunity Reviews, 2012; 11:A502–A514. Hugues J. N. Impact of ’LH activity’ supplementation on serum progesterone levels during controlled ovarian stimulation: a systematic review. Human Reproduction, 2012; 27 (1):232–243. Hull E. M. Effects of neonatal exposure to progesterone in sexual behavior of male and female rats. Physiol. Behav., 1981; 26:401–405. IARC (International Agency for Research on Cancer). Overall evaluation of carcinogenicity: an updating of IARC monographs volumes 1–42: Progestins; combined oral contraceptives. Suppl. 7. Albany, NY: WHO Publications Centre USA, 1987. Iftikhar S., et al. Use of bioidentical hormones for menopausal concerns: cross sectional survey in an academic menopause center. J. Women s Health, 2011; 20:559–565. Igarashi M. Augmentive effect of ascorbic acid upon induction of human ovulation in clomiphene-ineffective anovulatory women. Int. J. Fertil., 1977; 22:168–173. Ikka T., Kawashima K. Studies on the virilizing activities of synthetic hormones in female rat fetuses: IV. Synergic effect of estrogens on the vrilizing activity of gestagens. Congen Anomalies, 2001; 41:269. IngamellsIain S., Cameron I. T. Disorders of ovulation. Women’s Health Medicine, 2006; 3:3:109–112. Inoue T., et al. Spatial and topological distribution of progesterone receptor A and B isoforms during human development. Mol. Cell. Endocrinol., 2001; 182:83–89. Insler V. Corpus luteum defects. Curr. Opin. Obstet. Gynecol., 1992; 4:203–211. Isaacs J. D., Whitworth N. S., Cowan B. D. Relative operating characteristic analysis in reproductive medicine: comparison of progesterone and human chorionic gonadotropin doubling time as predictors of early gestational normalcy. Fertil. Steril., 1994; 62:452–445. Ishikawa H., et al. Progesterone Is Essential for Maintenance and Growth of Uterine Leiomyoma. Endocrinol., 2010; 151 (6):2433–2442. Israel R., et al. Single luteal phase serum progesterone assay as an indicator of ovulation. Am. J. Obstet. Gynecol., 1972; 112:1043–1046. Jabbour H. N., Critchley H. O. Potential roles of decidual prolactin in early pregnancy. Reproduction, 2001; 121:197–205. Jabbour H. N., et al. Endocrine Regulation of Menstruation. Critchley Endocrine Reviews, 2006; 27 (1):17–46. Jacob A., et al. Human sperm non-nuclear progesterone receptor expression is a novel marker for fertilization outcome. Mol. Hum. Reprod., 1998; 4:533–542. Jacobsen B. M., Horwitz K. B. Progesterone receptors, their isoforms and progesterone regulated transcription. Molecular and Cellular Endocrinology, 2012; 357:18–29. Jaiswal B. S., Eisenbach M. Capacitation. In: Hardy D. M., ed. Fertilization. San Diego: Academic Press, 2002; 57–117. Jamain M. & Grenet C. Utilization of 6-dehydro-retroprogesterone in obstetrics: indications; results. Bull. Fed. Soc. Gynecol. Obstet. Lang. Fr., 1969; 21:26–31. James A., Matchar D. B., Myers E. R. Testing for von Willebrand disease in women with menorrhagia: a systematic review. Obstet. Gynecol., 2004; 104:381–388. James W. J. Women’s hormone concentrations and the increasing rates of ectopic pregnancy. Hum. Reprod., 1996; 11:233–235. Janeczko A., Skoczowski A. Mammalian sex hormones in plants. Folia Histochem. Cytobiol., 2005; 43 (2):71–79. Jemal A., et al.Global cancer statistics. CA Cancer J. Clin., 2011; 61:69–90. Jenkins R. L., et al. Androstenedione and progesterone in the sediment of a river receiving paper mill effluent. Toxicol. Sci., 2003; 73:53–59. Jensen M. B., Publicover S. J. Progesterone and CatSper dependency. International Journal of Andrology, 2012; 35:631–632. Jerry D. J. Roles for estrogen and progesterone in breast cancer prevention. Breast Cancer Res., 2007; 9:102. Jin M., et al. Most fertilizing mouse spermatozoa begin their acrosome reaction before contact with the zona pellucida during in vitro fertilization. Proc. Natl. Acad. Sci. USA, 2011; 108:4892–4896. Joachim R., et al. The progesterone derivative dydrogesterone abrogates murine stress-triggered abortion by inducing a Th2 biased local immune response. Steroids, 2003; 68:931–940. Johnson M. H., Everitt B. J. Adult ovarian function. In Essential Reproduction. Oxford: Blackwell Science, 2000; 5:74–75. Johnson W. S., Gravestock M. B., McCarry B. E. Acetylenic bond participation in biogenic like olefinic cyclizations. II. Synthesis of dl-Progesterone. JACS, 1971; 4332–4334. Jones H. W. Jr., Wilkins L. The genital anomaly associated with prenatal exposure to progestogens. Fertil. Steril., 1960; 11:148–156. Jones L. A., Bern H. A. Cervicovaginal and mammary gland abnormalities in BALB/cCrgl mice treated neonatally with progesterone and estrogen, alone or in combination. Cancer Res., 1979; 39:2560–2567. Jones L. A., Bern H. A. Long-term effects of neonatal treatment with progesterone, alone and in combination with estrogen, on the mammary gland and reproductive tract of female BALB/cfC3H mice. Cancer Res., 1977; 37:67–75. Jones L. A., et al. Prevention by progesterone of cervicovaginal lesions in neonatally estrogenized BALB/c mice. Cancer Lett., 1984; 23:123–128. Jordan V. C. Long-term adjuvant tamoxifen therapy for breast cancer. Breast Cancer Research and Treatment, 1990; 15:125–136. Joshi P. A., et al. Progesterone induces adult mammary stem cell expansion. Nature, 2010; 465:803–807. Jukic A. M., et al. Lifestyle and reproductive factors associated with follicular phase length. J. Women s Health (Larchmt), 2007; 16:1340–1347. Jukica A. M. Z., et al. Effects of early pregnancy loss on hormone levels in the subsequent menstrual cycle. Gynecol. Endocrinol., 2010; 26 (12):897–901. Junkmann K., Neumann F. The mechanism of action of progestational hormones in the anti-masculine effect on fetal rats. Acta Endocrinol. (Copenh), 1964; 45 (Suppl 90):139–153. Jurkowski J. E., et al. Ovarian hormonal responses to exercise. J. Appl. Physiol.,1978;44:109–114. Kadohama N., et al. Inhibitory effects of some steroidal 6-methylene derivatives on 5-alpha-reductase activity in human and rat prostate. J. Steroid. Biochem.,1983; 18:551–558. Kalantaridou S. N., et al. Stress and the female reproductive system. J. Reprod. Immunol., 2004; 62:61–68. Kalinka J., Szekeres-Bartho J. The impact of dydrogesterone supplementation on hormonal profile and progesterone-induced blocking factor concentrations in women with threatened abortion. Am. J. Reprod. Immunol., 2005; 53:166–171. Kallen B., et al. A joint international study on the epidemiology of hypospadias. Acta Paediatr. Scand. Suppl., 1986; 324:1–52. Kallen B., et al. Hormone therapy during pregnancy and isolated hypospadias: an international case-control study. Int. J. Risk. Safe. Med., 1992; 3:183–198. Kallen B., et al. Oral contraceptives in the etiology of isolated hypospadias. Contraception, 1991b; 44:173–182. Kallen B., et al. Parental fertility and infant hypospadias: an international case-control study. Teratology, 1991a; 44:629–634. Kallen B., Winberg J. An epidemiological study of hypospadias in Sweden. Acta Paediatr. Scand. Suppl., 1982; 293:1–21. Kallen B. Case control study of hypospadias, based on registry information. Teratology, 1988; 38:45–50. Kanaley J. A., et al. Cortisol levels during prolonged exercise the influence of menstrual phase and menstrual status. Int. J. Sports. Med., 1992; 13:332–336. Kaorea S. N., et al. Novel actions of progesterone: what we know today and what will be the scenario in the future? Royal Pharmaceutical Society Journal of Pharmacy and Pharmacology, 2012; 64:1040–1062. Kaplowitz P. B., et al. Earlier onset of puberty in girls: relation to increased body mass index and race. Pediatrics, 2001; 108:347–353. Karas R. H., et al. A complex role for the progesterone receptor in the response to vascular injury. J. Clin. Invest., 2001; 108:611–618. Karita M., et al. Does advanced-stage endometriosis affect the gene expression of estrogen and progesterone receptors in granulosa cells? Fertil. Steril., 2011; 95:889–894. Kasahara M., et al. Studies on the virilizing activities of synthetic hormones in female rat fetuses: III. Structure activity of various hormones. Cong. Anomalies, 2001; 41:268–269. Kashani H. H., et al. Pharmacological properties of medicinal herbs by focus on secondary metabolites. Life Science Journal, 2012; 9 (1):509–520. Katz Z., et al. Teratogenicity of progestogens given during the first trimester of pregnancy. Obstet. Gynecol., 1985; 65:775–780. Kawashima K., et al. Virilizing activities of various steroids in female rat fetuses. Endocrinol. Jpn., 1977; 24:77–81. Kawashima K. Studies on the virilizing activities of synthetic hormones in female rat fetuses: III. Structure activity of various hormones. Cong. Anomalies, 2001; 41:268–269. Kawashima S., et al. Histometric study of the pituitary in mice treated neonatally with steroids and the relationship between prolactin cells and mammary tumorigenesis. Endocrinol. Jpn., 1978; 25:341–348. Keating E., et al. Progesterone Inhibits Folic Acid Transport in Human Trophoblasts. J. Membrane Biol., 2007; 216:143–152. Kelemen K., et al. A progesterone-induced protein increases the synthesis of asymmetric antibodies. Cell. Immunol., 1996; 167:129–134. Kelemen K., Paldi A., Tinneberg H., et al. Early recognition of pregnancy by the maternal immune system. Am. J. Reprod. Immunol., 1998; 39:351–355. Kenyon A. P., Peebles D. Myth: Tocolysis for prevention of preterm birth has a major role in modern obstetrics. Seminars in Fetal & Neonatal Medicine, 2011; 16:242–246. Khan A. M., et al. Acute eosinophilic pneumonia with intramuscular progesterone after in vitro fertilization. Fertil. Steril., 2008; 90:1200.e3–6. Kiguchi M., et al. Studies on virilizing activities of synthetic hormones in female rat fetuses: II. Progesterone and derivatives. J. Toxicol. Sci., 2001; 26:262. Kilic F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. J. Am. Chem. Soc., 2009; 131:4027–4030. Kim J. J., Kurita T., Bulun S. E. Progesterone action in endometrial cancer, endometriosis, uterine fibroids, and breast cancer. Endocr. Rev., 2013; 34 (1):130–162. King A., et al. Functions of human decidual NK cells. Am. J. Reprod. Immunol., 1996; 35:258–260. King A., et al. Human uterine lymphocytes. Hum. Reprod. Update, 1998; 4:480–485. King A., Gardner L., Loke Y. W. Evaluation of oestrogen and progesterone receptor expression in uterine mucosal lymphocytes. Hum. Reprod., 1996; 11:1079–1082. King A. Uterine leukocytes and decidualization. Hum. Reprod. Update, 2000; 6:28–36. King A. E., Critchley H. O. Oestrogen and progesterone regulation of inflammatory processes in the human endometrium. J. Steroid. Biochem. Mol. Biol., 2010; 120 (2–3):116–126. Kinnunen T. I., et al. Pregnancy weight gain and breast cancer risk. BMC Women s Health 2004; 4; 7:1–10. Klebanov P. K., Jemmot J. B. Effects of expectations and bodily sensations on self-reports of premenstrual symptoms. Psychology of Women Quarterly, 1992; 16:289–310. Klijn J. G., Setyono-Han B., Foekens J. A. Progesterone antagonists and progesterone receptor modulators in the treatment of breast cancer. Steroids, 2000; 65:825–830. Kline L. W., Karpinski E. Progesterone inhibits gallbladder motility through multiple signaling pathways. Steroids, 2005; 70 (9):673–679. Knackstedt M. K., et al. Th1 cytokines and the prothrombinase fgl2 in stress-triggered and inflammatory abortion. Am. J. Reprod. Immunol., 2003; 49:210–220. Knight C. Menstruation as medicine. Soc. Sci. Med., 1985; 21 (6):671–683. Kocer A., et al. Germ cell sex determination in mammals. Mol. Human. Reprod., 2009; 15 (4):205–213. Kol S., Humaidan P., Itskovitz-Eldor J. GnRH agonist ovulation trigger and hCG-based, progesterone-free luteal support: a proof of concept study. Human Reproduction, 2011; 26 (10):2874–2877. Kolibianakis E. M., Devroey P. The luteal phase after ovarian stimulation. Reprod. Biomed. Online, 2002; 5:26–35. Kolibianakis E. M., et al. Abnormal endometrial development occurs during the luteal phase of non supplemented donor cycles treated with recombinant follicle-stimulating hormone and gonadotropin-releasing hormone antagonists. Fertil. Steril., 2003; 80:464–466. Kolpin D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999–2000: a national reconnaissance. Environ Sci. Technol., 2002; 36:1202–1211. Komatsu T., et al. Expression of class I human leukocyte antigen (HLA) and β2-microglobulin is associated with decidualization of human endometrial stromal cells. Hum. Reprod., 1998; 13:2246–2251. Kondo I., Suganuma N. Embryo quality in failed in vitro fertilization patients. Hum. Reprod., 1994; 4:80–84. Konno T., et al. Subfertility Linked to Combined Luteal Insufficiency and Uterine Progesterone Resistance. Endocrinol., 2010; 151:4537–4550. Korownyk C., Allan M., McCormack J. Bioidentical hormone micronized progesterone. Can. Fam. Physic, 2012; 58:755. Kousta E., et al. Sex determination and disorders of sex development according to the revised nomenclature and classification in 46,XX individuals. Hormones (Athens), 2010; 9 (3):218–232. Kramer M. M., Harman M. T., Brill A. K. Disturbances of reproduction and ovarian changes in the guinea-pig in relation to vitamin C deficiency. Am. J. Physiol., 1933; 106:611–622. Krassas G. E. Thyroid Disease and Female Reproduction. Fertil. Steril., 2000; 74:1063–1070. Krausz C., et al. Two functional assays of sperm responsiveness to progesterone and their predictive values in in-vitro fertilization. Hum. Reprod., 1996; 11:1661–1667. Krikun G., Schatz F., Lockwood C. J. Endometrial angiogenesis: from physiology to pathology. Ann. N. Y. Acad. Sci., 2004; 1034:27–35. Kubasick N. K., Hallawer G. D., Brodows R. G. Evaluation of a direct solid phase radioimmunoassay for progesterone. Clin. Chem., 1984; 30:284–286. Kugaya A., et al. Increase in prefrontal cortex serotonin 2A receptors following estrogen treatment in postmenopausal women. Am. J. Psychiatry, 2003; 160:1522–1524. Kuhl H. Pharmacology of estrogens and progestogens: influence of different routes of administration. Climacteric, 2005; 8 (suppl 1):3–63. Kunz G., et al. Adenomyosis as a disorder of the early and late human reproductive period. Reproductive Biomedicine Online, 2007; 15:681–685. Kunz G., et al. Adenomyosis in endometriosis — prevalence and impact on fertility. Evidence from magnetic resonance imaging. Human Reproduc., 2005; 20:2309–2316. Kupperman H. Progesterone and related steroids in the management of abortion. In: Barnes A., editor. Progesterone. Augusta, MI: Brook Lodge Press, 1961;105–117. Kurita T., et al. Stromal progesterone receptors mediate the inhibitory effects of progesterone on estrogen-induced uterine epithelial cell deoxyribonucleic acid synthesis. Endocrinology, 1998; 139:4708–4713. Kurokawa J., Furukawa T. Non-genomic Action of Sex Steroid Hormones and Cardiac Repolarization. Biol. Pharm. Bull., 2013; 36 (1):8–12. Kwak-Kim J. Y., et al. Increased T helper 1 cytokine responses by circulating T cells are present in women with recurrent pregnancy losses and in infertile women with multiple implantation failures after IVF. Hum. Reprod., 2003; 18:767–773. Kyrou D., et al. Does cessation of progesterone supplementation during early pregnancy in patients treated with recFSH/GnRH antagonist affect ongoing pregnancy rates? A randomized controlled trial. Human Reproduction, 2011; 26 (5):1020–1024. Labarta E., et al. Endometrial receptivity is affected in women with high circulating progesterone levels at the end of the follicular phase: a functional genomics analysis. Human Reproduction, 2011; 26 (7):1813–1825. Laflamme N., et al. Expression and neuropeptidergic characterization of estrogen receptors (ERalpha and ERbeta) throughout the rat brain: anatomical evidence of distinct roles of each subtype. J. Neurobiol., 1998; 36:357–378. Lagiou P., et al. Diet during pregnancy and levels of maternal pregnancy hormones in relation to the risk of breast cancer in the offspring. Eur. J. Cancer Prev., 2006; 15 (1):20–26. Lainea M. A., Ojanotko A. O. Progesterone metabolism in human saliva in vitro. Journal of Steroid Biochemistry and Molecular Biology, 1999; 70:109–113. Laitinen J., Power C., Järvelin M. R. Family social class, maternal body mass index, childhood body mass index, and age at menarche as predictors of adult obesity. Am. J. Clin. Nutr., 2001; 74:287–94. Lambert J. J., et al. Neurosteroid modulation of GABAA receptors. Prog. Neurobiol., 2003; 71:67–80. Lanari C., et al. Antiprogestins in breast cancer treatment: are we ready? Endocrine-Related Cancer, 2012; 19:R35–R50. Landau R. L., Lugibihl K. Inhibition of the sodium retaining influence of aldosterone by progesterone. J. Clin. Endocrinol. Metab., 1958; 18:1237–1245. Lange C., Yee D. Progesterone and breast cancer. Women’s Health, 2008; 4 (2):151. Lange C. A., et al. Progesterone receptor action: translating studies in breast cancer models to clinical insights. Advances in Experimental Medicine and Biology, 2008; 630:94–111. Larsen B., Hwang J. Progesterone Interactions with the Cervix: Translational Implications for Termand Preterm Birth. Hindawi Publishing Corporation. Infectious Diseases in Obstetrics and Gynecology, 2011; Article ID 353297:13. Lassek W. D., Gaulin S. J. Brief communication: menarche is related to fat distribution. Am. J. Phys. Anthropol., 2007; 133:1147–51. Lavoie J. M., et al. Menstrual cycle phase dissociation of blood glucose homeostasis during exercise. J. Appl. Physiol., 1987; 62:1084–1089. Laycock J. F., Wise P. H. Essential endocrinology. Oxford, UK: Oxford University press, 1996. Le Vine L. Habitual abortion: a controlled clinical study of progestational therapy. West J. Surg., 1964; 72:30–36. Leather A. T., et al. The prevention of bone loss in young women treated with GnRH analogues with ’add-back’ estrogen therapy. Obstet. Gynecol., 1993; 81:104–107. Leather A. T., et al. The treatment of severe premenstrual syndrome with goserelin with and without ’add-back’ estrogen therapy: a placebo-controlled study. Gynecol. Endocrinol., 1999; 13:48–55. Ledee-Bataille N., et al. A new role for natural killer cells, interleukin (IL) -12, and IL-18 in repeated implantation failures after in vitro fertilization. Fertil. Steril., 2004; 81:59–65. Lee J. Natural Progesterone: the multiple roles of a remarkable hormone. Sebastopol, CA: BLL Publishing, 1999. Lee S. J., et al. The effect of age on the cyclical patterns of plasma LH, FSH, oestradiol and progesterone in women with regular menstrual cycles. Hum. Reprod., 1988; 3:851–855. Lei K., et al. Uterine Stretch and Progesterone Action. J. Clin. Endocrinol. Metab., 2011; 96:E1013–E1024. Lenković M., et al. Effect of Progesterone and Pregnancy on the Development of Varicose Veins. Acta Dermatovenerol Croat, 2009; 17 (4):263–267. Lenton E. A., Landgren B. M., Sexton L. Normal variation in the length of the luteal phase of the menstrual cycle: identification of the short luteal phase. Br. J. Obstet. Gynecol., 1984; 91:685–689. Lerner L. J., et al. Comparison of the acetophenone derivative 16alpha,17alpha — dihydroxyprogesterone with other progestational steroids for masculinisation of the rat fetus. Endocrinology, 1962; 71:448–451. Lesny P., et al. Uterine junctional zone contractions during assisted reproduction cycles. Hum. Reprod. Update, 1998; 4:440–445. Lessey B. A., et al. Immunohistochemical analysis of human uterine estrogen and progesterone receptors throughout the menstrual cycle. J. Clin. Endocrinol. Metab., 1988; 67:334–340. Lessey B. A. Endometrial responsiveness to steroid hormones: a moving target. J. Soc. Gynecol. Investig., 2004; 11:61–62. Lethaby A., et al. Hormone replacement therapy for cognitive function in postmenopausal women. Cochrane Database Syst. Rev., 2008; (1):CD003122. Letters to the editors. Menopause: The Journal of The North American Menopause Society, 2003; 10 (4):373–381. Levine H., Watson N. Comparison of the pharmacokinetics of Crinone 8 % administered vaginally versus prometrium administered orally in postmenopausal women. Fertil. Steril., 2000;73:516–521. Levine J. E., et al. Progesterone receptors as neuroendocrine integrators. Front Neuroendocrinol, 2001; 22:69–106. Levy C., et al. Estradiol and progesterone receptors in human endometrium: normal and abnormal menstrual cycles and early pregnancy. Am. J. Obstet. Gynecol., 1980; 136:646–651. Levy E. P., Cohen A., Fraser F. C. Hormone treatment during pregnancy and congenital heart defects. Lancet, 1973; 1:611. Lewis J. G., et al. Caution on the use of saliva measurements to monitor absorption of progesterone from transdermal creams in postmenopausal women. Maturitas, 2002; 41 (1):1–6. Li Q., et al. The antiproliferative action of progesterone in uterine epithelium is mediated by Hand2. Science, 2011; 331:912–916. Li T., Cooke I. Chronological and histological dating of the endometrial biopsy. Obstet. Gynecol., 1989; 1:266–272. Li T. C. Guidelines for practitioners. Recurrent miscarriage: principles of management. Hum. Reprod., 1998; 13:478–482. Li X., O’Malley B. W. Unfolding the action of progesterone receptors. J. Biol. Chem., 2003; 278:39261–39264. Lianne G. The end of menstruation. Maclean’s, 2005; 118:50:41. Lin Y. S., Liu C. H. Prediction of early pregnancy outcomes. Intern. J. Gynecol. Obstet., 1995; 51:33–38. Lindenfeld E. A., Langer R. D. Bleeding patterns of the hormone replacement therapies in the postmenopausal estrogen and progestin interventions trial. Obstet. Gynecol., 2002; 100 (5 Pt 1):853–63. Lishko P. V., Botchkina I. L., Kirichok Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature, 2011; 471:387–391. Lissoa B. P., Sauer H. D. Progesterone metabolism in the human myometrium. J. Sreroid. Biochem., 1975; 6:1137–1144. Little B., et al. In vivo aspects of progesterone distribution and metabolism. Am. J. Obstet. Gynecol., 1975; 123:527–534. Liu D. T. Y., Jeavons B., Preston C., Pearson D. A prospective study of spontaneous miscarriage in ultrasonically normal pregnancies and relevance to chorionic villus sampling. Prenat. Diagn., 2005;b 7:22–37. Liu X. R., et al. The optimal duration of progesterone supplementation in pregnant women after IVF/ICSI: a meta-analysis. Reprod. Biol. Endocrinol., 2012; 10:107. Lobley A., et al. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reprod. Biol. Endocrinol., 2003; 1: 53. Lockwood C. J., et al. Progestational regulation of human endometrial stromal cell tissue factor expression during decidualization. J. Clin. Endocrinol. Metab., 1993; 76:231–236. Lockwood C. J., et al. Progestin and thrombin regulate tissue factor expression in human term decidual cells. J. Clin. Endocrinol. Metab., 2009; 94:2164–2170. Lockwood C. J. Mechanisms of normal and abnormal endometrial bleeding. Menopause, 2011; 18 (4):408–411. Lodde V., Peluso J. J. A Novel Role for Progesterone and Progesterone Receptor Membrane Component 1 inRegulating Spindle Microtubule Stability During Rat and Human Ovarian Cell Mitosis. Biology of Reproduction, 2011; 84:715–722. Loeb L. Mechanism of sexual cycle with special reference to corpus luteum. Amer. J. Anat., 1923; 32:305. Lof M., et al. Dietary fat intake and gestational weight gain in relation to estradiol and progesterone plasma levels during pregnancy: a longitudinal study in Swedish women. BMC Women’s Health, 2009; 9:10. Logue C. M., Moos R. H. Perimenstrual symptoms: prevalence and risk factors. Psychosomatic Medicine, 1986; 48:388–414. Loke Y. W., King A. Human implantation. Cambridge, UK: Cambridge University Press, 1995. Lonard D. M., O’Malley B. W. The expanding cosmos of nuclear receptor coactivators. Cell., 2006; 125:411–414. London S., et al. Alcohol and other dietary factors in relation to serum hormone concentrations in women at climacteric. Am. J. Clin. Nutr., 1991; 53:166–171. Loutradis D., et al. Preovulatory effects of the progesterone antagonist mifepristone (RU486) in mice. Hum. Reprod., 1991; 6:1238–1240. Lowry O. H., et al. Protein measurements with the folin phenol reagent. J. Biol. Chem., 1951; 193:265–275. Lozeau A. M., Potter B. Diagnosis and Management of Ectopic Pregnancy. Am. Fam. Phys., 2005; 72 (9):1707–1714. Luck M. R., Jeyaseelan I., Scholes R. A. Ascorbic acid and fertility. Biol. Reprod., 1995; 52:262–266. Luconi M., et al. Identification and characterization of functional nongenomic progesterone receptors on human sperm membrane. J. Clin. Endocrinol. Metab., 1998; 83:877–885. Ludwig M., Diedrich K. Evaluation of an optimal luteal phase support protocol in IVF. Acta Obstet. Gynecol. Scand., 2001; 80:452–466. Lydon J. P., Edwards D. P. Finally! A model for progesterone receptor action in normal human breast. Endocrinol, 2009; 150:2988–2990. Lydon J. P., et al. Mice lacking progesterone receptor exhibit pleiotropic reproductive abnormalities. Genes Development, 1995; 9:2266–2278. Mackenzie R., et al. Progesterone for the prevention of preterm birth among women at increased risk: a systematic review and meta-analysis of randomized controlled trials. Am. J. Obstet. Gynecol., 2006; 194:1234–1242. MacLennan A., Lester S., Moore V. Oral oestrogen replacement therapy versus placebo for hot flushes. Cochrane Database Syst. Rev., 2001; CD002978. Macnab A. J., Zouves C. Hypospadias after assisted reproduction incorporating in vitro fertilization and gamete intrafallopian transfer. Fertil. Steril., 1991; 56:918–922. Maddocks S., Hahn P., Moller F., Reid R. L. A double-blind placebo-controlled trial of progesterone vaginal suppositories in the treatment of premenstrual syndrome. Am. J. Obstet. Gynecol., 1986; 154:573–581. Mahesh V. B., Brann D. W., Hendry L. B. Diverse modes of action of progesterone and its metabolites. J. Steroid. Biochem. Mol. Biol., 1996; 56:209–219. Mahesh V. B. Hirsutism, virilism, polycystic ovarian disease, and the steroid gonadotropin-feedback system: a career retrospective. Am. J. Physiol. Endocrinol. Metab., 2012; 302: E4–E18. Makhseed M., et al. Pro-inflammatory maternal cytokine profile in preterm delivery. Am. J. Reprod. Immunol., 2003; 49:308–318. Makhseed M., et al. Th1 and Th2 cytokine profiles in recurrent aborters with successful pregnancy and with subsequent abortions. Hum. Reprod., 2001; 16:2219–2226. Malan Borel I., et al. IgG asymmetric molecules with antipaternal activity isolated from sera and placenta of pregnant human. J. Reprod. Immunol., 1991; 20:129–140. Malcolm C. E., Cumming D. C. Does anovulation exist in eumenorrheic women? Obstet. Gynecol., 2003; 102:317–318. Mangal R. K., et al. Differential Expression of Uterine Progesterone Receptor Forms A and B during the Menstrual Cycle. J. Steroid. Biochem. Molec. Biol., 1997; 63:4–6:195–202. Manson J. M., Carr M. C. Molecular epidemiology of hypospadias: review of genetic and environmental risk factors. Birth Defects Res. Part A. Clin. Mol. Teratol., 2003; 67:825–836. Manuck T. A., et al. Absence of Mitochondrial Progesterone Receptor Polymorphisms in Women With Spontaneous Preterm Birth. Reprod. Sci., 2010 October; 17 (10):913–916. Manyonda I. T. The immunology of recurrent spontaneous miscarriage. In: The Immunology of Human Reproduction. 1st edn. London: Taylor & Francis, 2006; 59–77. Marinari K. T., Leshner A. I., Doyle M. P. Menstrual cycle status and adrenocortical reactivity to psychological stress. Psychoneuroendocrinology, 1976; 1:213–218. Marks L. V. Sexual chemistry: a history of the contraceptive pill. New Haven, CT: Yale University Press, 2001. Marshall and Runciman: On the Ovarian Factor Concerned in the Recurrence of the Oestrous Cycle. J. Physiol., 1914; 49:17. Marshall G. J. A. Weird Animal Genomes and the Evolution of Vertebrate Sex and Sex Chromosomes. Annu. Rev. Genet., 2008; 42:565–586. Martin J. A., et al. Centers for Disease Control and Prevention National Center for Health Statistics. National Vital Statistics System births: final data for 2005. Natl. Vital. Stat. Rep., 2007; 56:1–103. Martin V. T., Behbehani M. Ovarian Hormones and Migraine Headache: Understanding Mechanisms and Pathogenesis — Part 2. Headache, 2006; 46 (3):365–386. Martin V. T., Behbehani M. Ovarian Hormones and Migraine Headache: Understanding Mechanisms and Pathogenesis — Part 1. Headache, 2006; 46 (1):3–23. Martinez F., et al. Serum progesterone concentrations on the day of HCG administration cannot predict pregnancy in assisted reproduction cycles. Reprod. Biomed. Online, 2004; 8:183–190. Martini L., Magnaghi V., Melcangi R. C. Actions of progesterone and its 5alpha-reduced metabolites on the major proteins of the myelin of the peripheral nervous system. Steroids, 2003; 68:825–829. Maskarinec G., et al. Alcohol and dietary fibre intakes affect circulating sex hormones among premenopausal women. Public Health Nutr., 2006; 9:875–881. Maskarinec G., et al. Trends of breast cancer incidence and risk factor prevalence over 25 years. Breast Cancer Res. Treat., 2006; 98:45–55. Mason P., et al. Induction of ovulation with pulsatile luteinising hormone releasing hormone. Br. Med. J. (Clin Res Ed), 1984; 288:181–5. Matsubara Y., Matsubara K. Estrogen and progesterone play pivotal roles in endothelial progenitor cell proliferation. Reprod. Biol. Endocrinol., 2012; 10:2. Mau G. Progestins during pregnancy and hypospadias. Teratology, 1981; 24:285–287. Mauvais-Jarvis P., et al. In vivo studies on progesterone metabolism by human skin. J. Clin. Endocrinol. Metab., 1969; 29:1580–1585. Mauvais-Jarvis P., Kuttenn F., Baudot N. Inhibition of testosterone conversion to dihydrotestosterone in men treated pecutaneously by progesterone. J. Clin. Endocrinol. Metab., 1974; 38:142–147. Mauvais-Jarvis P., Wepierre J., Vickers C. Percutaneous Absorption of Steroids. Academic Press, NY, 1980. Maxson W. S., et al. Textbook of Gynecology, 2nd ed. Philadelphia: W.B. Saunders, 2000:513–4. Maxson W. S., Hargrove J. T. Bioavailability of oral micronized progesterone. Fertil. Steril., 1985; 44:622–626. Maybin J. A., Critchley H. O. Progesterone: a pivotal hormone at menstruation. Ann. NY. Acad. Sci., 2011; 1221:88–97. Mayol J. M., et al. Progesterone Inhibits Chloride Transport in Human Intestinal Epithelial Cells. World. J. Surg., 2002; 26:652–656. McCarthy M. M. Estradiol and the developing brain. Physiol. Rev., 2008; 88:91–124. McCarthy S. M., Foote R. H., Maurer R. R. Embryo mortality and altered uterine luminal proteins in progesterone-treated rabbits. Fertil. Steril., 1977; 28:101–107. McCord M. L., et al. Single serum progesterone as a screen for ectopic pregnancy: exchanging specificity and sensitivity to obtain optimal test performance. Fertil. Steril., 1996; 66:513–516. McCracken J. A., Custer E. E., Lamsa J. C. Luteolysis: a neuroendocrine-mediated event. Physiol. Rev., 1999; 79 (2):263–323. McEwen B. S., Alves S. E. Estrogen actions in the central nervous system. Endocr. Rev., 1999; 20:279–307. McEwen B. S., et al. Ovarian steroids and the brain: implications for cognition and aging. Neurology, 1997; 48:S8–15. McEwen B. S. How do sex and stress hormones affect nerve cells? Ann. NY. Acad. Sci.,1994;743:1–16. McFarlane J. M., Williams T. M. Placing premenstrual syndrome in perspective. Psychology of Women Quarterly, 1994; 18:339–373. McLean C. P., Anderson E. R. Brave men and timid women? A review of the gender differences in fear and anxiety. Clinical Psychology Review, 2009; 29:496–505. Medina M., et al. Estradiol and progesterone receptors in mammary cancer. Arch. Invest. Med. (Mex), 1987; 18:235–240. Mehasseb M. K., et al. Enhanced invasion of stromal cells from adenomyosis in a three-dimensional coculture model is augmented by the presence of myocytes from affected uteri. Fertil. Steril., 2010; 94:2547–2551. Meis P. J., et al. Prevention of recurrent preterm delivery by 17-alpha-hydroxyprogesterone caproate. N. Engl. J. Med., 2003 348:2379–2385. Meites J., et al. Effects of corpora lutea removal and replacement with progesterone on pregnancy in goats. J. Anim. Sci., 1951; 10:411–416. Melcangi R. C., et al. Effects of neuroactive steroids on myelin of peripheral nervous system. J. Steroid. Biochem. Mol. Biol., 2003; 85:323–327. Mercola J. Complications regarding progesterone cream. www.mercola.com, 2004 Merlino A. A., et al. Nuclear progesterone receptors in the human pregnancy myometrium: evidence that parturition involves functional progesterone withdrawal mediated by increased expression of progesterone receptor-A. J. Clin. Endocrinol. Metab., 2007; 92 (5):1927–1933. Mertens H. J., Heineman M. J., Evers J. L. The expression of apoptosis-related proteins Bcl-2 and Ki67 in endometrium of ovulatory menstrual cycles. Gynecologic and obstetric investigation. 2002; 53:224–230. Mesiano S. Myometrial progesterone responsiveness and the control of human parturition. J. Soc. Gynecol. Investig., 2004; 11:193–202. Mesiano S. Myometrial progesterone responsiveness. Semin. Reprod. Med., 2007; 25 (1):5–13. Metcalf M. G., Evans J. J., Mackenzie J. A. Indices of ovulation: comparison of plasma and salivary levels of progesterone with urinary pregnanediol. J. Endocrinol., 1984; 100:75–80. Metzger D. A., et al. Association of endometriosis and spontaneous abortion: effect of control group selection. Fertil. Steril., 1986; 45:18–22. Meyers-Walen V.N. Genetic of sexual differentiation and anomalies in dogs and cats. J. Reprod. Fertil. Suppl., 1993; 47:441–452. Michaelis J., et al. Prospective study of suspected associations between certain drugs administered during early pregnancy and congenital malformations. Teratology, 1983; 27:57–64. Mikkelsen A. L., Smith S., Lindenberg S. Impact of estradiol and inhibin A concentrations on pregnancy rate in in-vitro oocyte maturation. Hum. Reprod., 2000; 15:1685–1690. Miles R. A., et al. Pharmacokinetics and endometrial tissue levels of progesterone after administration by intramuscular and vaginal routes: a comparative study. Fertil. Steril., 1994; 62:485–490. Mills A. A., et al. Characterization of progesterone receptor isoform expression in fetal membranes. Am. J. Obstet. Gynecol., 2006; 195 (4):998–1003. Minici F., et al. Endometriosis and human infertility: a new investigation into the role of eutopic endometrium. Human Reproduction, 2008; 23:530–537. Mishell D. R. Jr. Premenstrual disorders: epidemiology and disease burden. Am. J. Manag. Care, 2005; 11 (16 Suppl):S473–S479. Mitchell V. L., Gershwin L. J. Progesterone and environmental tobacco smoke act synergistically to exacerbate the development of allergic asthma in a mouse model. Clin. Exp/ Allergy, 2007; 37:276–286. Mittal K., Demopoulos R. I. MIB-1 (Ki-67), p53, estrogen receptor, and progesterone receptor expression in uterine smooth muscle tumors. Hum. Pathol., 2001; 32:984–987. Mittwoch U. Sex determination and sex reversal: genotype, phenotype, dogma and semantics. Hum. Genet., 1992; 89 (5):467–479. Moghadam B. K., Hersini S., Barker B. F. Autoimmune progesterone dermatitis and stomatits. Oral. Surg. Oral. Med. Oral. Pathol., 1998; 85:537–541. Moline M. L., Zendell S. M. Evaluating and managing premenstrual syndrome. Medscape Womens Health, 2000; 5 (2):1. Mollitch M. Hormonal changes and endocrine testing in pregnancy. In: Endocrinology. Edited by DeGroot L., Jameson J. Philadelphia: WB Saunders Company; 2001:2489–2490. Moltz H., Levin R., Leon M. Differential effects of progesterone on the maternal behavior of primiparous and multiparous rats. J. Comp. Physiol. Psychol., 1969; 67:36–40. Monteleone P., et al. Allopregnanolone concentrations and premenstrual syndrome. Europ. J. Endocr., 2000; 142:269–273. Montgomery J. C., et al. Effect of oestrogen and testosterone implants on psychological disorders in the climacteric. Lancet, 1987; 1:297–299. Morán C., et al. Estradiol and progesterone endometrial receptors and body fat distribution in obese women. Gynecol. Obstet. Invest., 1996; 23:771–772. Moran M. H., Goldberg M., Smith S. S. Progesterone withdrawal II: insensitivity to the sedative effects of a benzodiazepine. Brain Research, 1998; 807:91–100. Morishita S. Prompt effect of progesterone on the adrenergic response of smooth muscles. Jpn. J. Pharmacol., 1986; 42 (2):289–296. Morris D., Diskin M. Effect of progesterone on embryo survival. Animal, 2008; 2:8:1112–1119. Morris N. M., Udry J. R., Underwood L. E. A study of the relationship between coitus and the luteinizing hormone surge. Fertil. Steril., 1977; 28:440–442. Moskowitz D. A comprehensive review of the safety and efficacy of bioidentical hormones for the management of menopause and related health risks. Alt. Med. Rev., 2006; 11 (3):208–223. Moster D., Lie R. T., Markestad T. Long-term medical and social consequences of preterm birth. N. Engl. J. Med., 2008; 359:262–273. Mote P. A., et al. Colocalization of progesterone receptors A and B by dual immunofluorescent histochemistry in human endometrium during the menstrual cycle. J. Clin. Endocrino. Metab., 1999; 84:2963–2971. Mote P. A., et al. Heterogeneity of progesterone receptors A and B expression in human endometrial glands and stroma. Hum. Reprod., 2000; 15 (Suppl 3):48–56. Mote P. A., Graham J. D., Clarke C. L. Progesterone receptor isoforms in normal and malignant breast. Ernst Schering Foundation Symposium Proceedings, 2007; 77–107. Moyer D. L., Felix J. C. The effects of progesterone and progestins on endometrial proliferation. Contraception, 1998; 57:399–403. Mucci L. A., et al. Pregnancy estriol, estradiol, progesterone and prolactin in relation to birth weight and other birth size variables (United States). Cancer Causes Control, 2003; 14 (4):311–318. Mueller M. D., et al. Neutrophils infiltrating the endometrium express vascular endothelial growth factor: potential role in endometrial angiogenesis. Fertil. Steril., 2000; 74:107–112. Mui Lam P. O., et al. Effects of early luteal-phase vaginal progesterone supplementation on the outcome of in vitro fertilization and embryo transfer. Gynecol. Endocrinol., 2008; 24 (12):674–680. Mulac-Jericevic B., Conneely O. M. Reproductive tissue selective actions of progesterone receptors. Reproduction, 2004; 128:129–146. Mulac-Jericevic B., et al. Subgroup of reproductive functions of progesterone mediated by progesterone receptor-B isoform. Science, 2000; 289:1751–1754. Muleba N., et al. Human chorionic gonadotropin levels following spontaneous abortion in the first trimester. Am. J. Obstet. Gynecol., 2005; 193:S116–S117. Nagasawa H., et al. Ovarian dependence of the stimulatory effect of neonatal hormone treatment on plasma levels of prolactin in female mice. J. Endocrinol., 1978; 79:391–392. Nahoul K., et al. Profiles of plasma estrogens, progesterone and their metabolites after oral or vaginal administration of estradiol or progesterone. Maturitas, 1993; 16:185–202. Nakamura M. The mechanism of sex determination in vertebrates — are sex steroids the key-factor? J. Exp. Zool., 2010; 131A:381–398. Nappi R. E., et al. Luteal phase dysphoric disorder and premenstrual syndrome. It J. Psych., 2009; 28:27–33. Nappi R. E., Rivest S. Ovulatory cycle influences the stimulatory effect of stress on the expression of corticotropin-releasing factor receptor messenger ribonucleic acid in the paraventricular nucleus of the female rat hypothalamus. Endocrinology, 1995; 136:4073–4083. National Collaborating Centre for Women’s and Children’s Health. Fertility assessment and treatment for people with fertility problems (Commissioned by the National Institute for Clinical Excellence). RCOG press, 2004. Navot D., et al. Hormonal manipulation of endometrial maturation. J. Clin. Endocrinol. Metab., 1989; 68:801–807. Neal-Perry G., Nejat E., Dicken C. The neuroendocrine physiology of female reproductive aging: An update. Maturitas, 2010; 67:34–38. Near A. M., et al. Progesterone Receptor Gene Polymorphisms and Risk of Endometriosis: Results from an International Collaborative Effort. Fertil. Steril., 2011; 95 (1):40–45. Nedrow A., et al. Complementary and alternative therapies for the management of menopause-related symptoms. Arch. Intern. Med., 2006; 166 (14):1453–1465. Nelson M. M., Forfar J. O. Epidemiology of drug taken by pregnant women: drugs that may affect the fetus adversely. Clin. Pharmacol., 1971; 14:632–642. Neulen J., Breckwoldt M. Placental progesterone, prostaglandins and mechanisms leading to initiation of parturition in the human. Exp. Clin. Endocrinol., 1994; 102:195–202. Nillius S. J., Johansson E. D. B. Plasma progesterone levels after intramuscular or rectal administration of progesterone. Acta Obstet. Gynecol. Scand., 1971; 50:46. Nillni Y. I., et al. Anxiety sensitivity, the menstrual cycle, and panic disorder: a putative neuroendocrine and psychological interaction. Rohan Clin. Psychol. Rev., 2011 November; 31 (7):1183–1191. Niswender G. D., et al. Judge, jury and executioner: the auto-regulation of luteal function. Soc. Reprod. Fertil. Suppl., 2007; 64:191–206. Niswender G. D., et al. Mechanisms controlling the function and life span of the corpus luteum. Physiol. Rev., 2000; 80 (1):1–29. Niswender G. D. Molecular control of luteal secretion of progesterone. Reproduction, 2002; 123:333–339. Niu Z., et al. Progesterone levels on oocyte retrieval day can predict the quantity of viable embryos but not pregnancy outcome of intracytoplasmic sperm injection. Gynecol. Endocrinol., 2008; 24 (8):452–458. Nora A. H., Nora J. J. A syndrome of multiple congenital anomalies associated with teratogenic exposure. Arch. Environ. Health, 1975; 30:17–21. North American Menopause Society. Estrogen and progestogen use in postmenopausal women: 2010 position statement of The North American Menopause Society. Menopause, 2010; 17:242–255. Northen A. T., et al. National Institute of Child Health and Human Development (NICHD). Maternal-Fetal Medicine Units (MFMU). Network: follow-up of children exposed in utero to 17 alpha-hydroxyprogesterone caproate compared with placebo. Obstet. Gynecol., 2007; 110:865–872. Norwitz E. R., Caughey A. B. Progesterone Supplementation and the Prevention of Preterm Birth. Rev. Obstet. Gynecol., 2011; 4 (2):60–72. Norwitz E. R., Schust D. J., Fisher S. J. Implantation and the survival of early pregnancy. N. Engl. J. Med., 2001; 345:1400–1408. Nosarka S., Kruger T., Siebert I., Grové D. Luteal phase support in in vitro fertilization: meta-analysis of randomized trials. Gynecol. Obstet. Invest., 2005; 60:67–74. Novak E. An Appraisal of Ovarian Therapy. Endocrinology, 1922; 6:599. Nowak R. A. Novel therapeutic strategies for leiomyomas: targeting growth factors and their receptors. Environ Health Perspect, 2000; 108 Suppl 5:849–853. Ntrivalas E. I., et al. Status of peripheral blood natural killer cells in women with recurrent spontaneous abortions and infertility of unknown aetiology. Hum. Reprod., 2001; 16:855–861. Numan M. Progesterone inhibition of maternal behavior in the rat. Horm. Behav., 1978; 11:209–231. Nyboe Andersen A., et al. Progesterone supplementation during early gestation after IVF or ICSI has no effect on the delivery rates: a randomized controlled trial. Hum. Reprod 2002; 17:357–361. O’Brien J. M., et al. Progesterone vaginal gel for the reduction of recurrent preterm birth: primary results from a randomized, double-blind, placebo-controlled trial. Ultrasound Obstet. Gynecol., 2007; 30:687–696. Oates-Whitehead R. M., Haas D. M., Carrier J. A. K. Progestogen for preventing miscarriage. Cochrane Database Syst. Rev., 2003; 4:CD003511. Oehninger S., et al. A sequential analysis of the effect of progesterone on specific sperm functions crucial to fertilization in vitro in infertile patients. Hum. Reprod., 1994; 9:1322–1327. Office of Environmental Health Hazard Assessment (OEHHA). Evidence for Developmental and Reproductive Toxicity of Progesterone. 2004. Available at http://www.oehha.org/prop65/hazard_ident/pdf_zip/progeshid5.pdf. Ogihara T., Matsumoto S., Ohnishi S. Functional characterization of active transport of progesterone to adrenal cells. JPP, 2004; 56:79–84. Ojeda S. R. Female Reproductive Function. In Text Book Endocrine Physiology. Edited by: Graffin J. E. and Ojeda S.R. Oxford, New York: Oxford University Press; 5 2004:186–225. Okada A., et al. Ef fect of estrogens on ontogenetic expression of progesterone receptor in the fetal female rat reproductive tract. Mol. Cell. Endocrinol., 2002; 195:55–64. Omar M. H., et al. Dydrogesterone in threatened abortion: pregnancy outcome. J. Steroid. Biochem. Mol. Biol., 2005; 97:421–425. O’Neill T. Progesterone prophylaxis? BJP, 1990; 157:776–777. Oren-Benaroya R., et al. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod., 2008; 23:2339–2345. Osakay T., Kutluay L., Kaptanoglu A., Karabacak O. Autoimmune progesterone dermatitis. Eu. J. Dermatol., 2002; 6:589–591. Osman R. A., et al. Steroid induced exocytosis: the human sperm acrosome reaction. Biochem. Biophys. Res. Commun., 1989; 160:828–833. Osteen K. G., Bruner-Tran K. L., Eisenberg E. Reduced progesterone action during endometrial maturation: a potential risk factor for the development of endometriosis. Fertil. Steril., 2005; 83:529–537. Ottoson U. B., et al. Serum levels of progesterone and some of its metabolites including deoxycorticosterone after oral and parenteral administration. Br. J. Obstet. Gynecol., 1984; 91:1111–1119. Paitz R. T., et al. Progesterone metabolites, «xenobiotic-sensing» nuclear receptors, and the metabolism of maternal steroids. General and Comparative Endocrinology, 2010; 166:217–221. Pakulski C. Neuroprotective properties of sex hormones. Anaesthesiology Intensive Therapy, 2011; XLIII,2:102–106. Pall M., et al. Timedependent ovulation inhibition of a selective progesterone-receptor antagonist (Org 31710) and effects on ovulatory mediators in the in vitro perfused rat ovary. Biology of Reproduction, 2000; 63:1642–1647. Panay N., Studd J. Progestogen intolerance and compliance with hormone replacement therapy in menopausal women. Hum. Reprod. Update, 1997; 3:159–171. Panay N., Studd J. W. The psychotherapeutic effects of estrogens. Gynecol. Endocrinol., 1998; 12:353–365. Papanikolaou E. G., et al. Progesterone rise on the day of human chorionic gonadotropin administration impairs pregnancy outcome in day 3 single-embryo transfer, while has no effect on day 5 single blastocyst transfer. Fertil. Steril., 2009; 91:949–952. Parazzini F. Oestrogens and progesterone concentrations and risk of ectopic pregnancy: an epidemiological point of view. Hum. Reprod., 1996; 11:236–238. Park K.-H., et al. Ca2+ signaling tools acquired from prostasomes are required forprogesterone-induced sperm motility. Sci. Signal, 2011; 4:31. Pastor C. L., et al. Polycystic ovary syndrome: evidence for reduced sensitivity of the gonadotropin-releasing hormone pulse generator to inhibition by estradiol and progesterone. J. Clin. Endocrinol. Metab., 1998; 83:582–590. Pau K. Y., et al. Oestrogen upregulates noradrenaline release in the mediobasal hypothalamus and tyrosine hydroxylase gene expression in the brainstem of ovariectomized rhesus macaques. J. Neuroendocrinol, 2000; 12:899–909. Pauli B. D., et al. Infl uence of the menstrual cycle on airway function and normal subjects. Am. Rev., Respir. Dis., 1989; 140:358–362. Peacock A., Alvi N. S., Mushtaq T. Period problems: disorders of menstruation in adolescents. Arch. Dis. Child, 2012; 97:554–560. Peck J. D., et al.Steroid hormone levels during pregnancy and incidence of maternal breast cancer. Cancer Epidemiol. Biomarkers Prev., 2002; 11 (4):361–368. Peluso J. J. Multiplicity of progesterone’s actions and receptors in the mammalian ovary. Biol. Reprod., 2006; 75:2–8. Pensler J. M., et al. Osteoclasts isolated from membranous bone in children exhibit nuclear estrogen and progesterone receptors. J. Bone Miner Res., 1990 5:797–802. Penzias A. S., Alper M. M. Luteal support with vaginal micronized progesterone gel in assisted reproduction. Reprod. Biomed. Online, 2003; 6:287–295. Penzias A. S. Luteal phase support. Fertil. Steril., 2002; 77:318–323. Pereira Vega A., et al. Variability in the prevalence of premenstrual asthma. Eur. Respir. J., 2010; 35:980–986. Pereira-Vega A., et al. Premenstrual Asthma and Female Sex Hormones. J. Investig. Allergol. Clin. Immunol., 2012; 22 (6):437–459. Perheentupa A., Huhtaniemi I. Aging of the human ovary and testis. Molecular and Cellular Endocrinology, 2009; 299 (1):2–13. Perkins S. L., et al. Comparison of serum progesterone as an indicator of pregnancy nonviability in spontaneously pregnant emergency room and infertility clinic patient populations. Fertil. Sterilt., 2000; 73:499–504. Petrelli E. A., Forbes T. R. Toxicity of progesterone to mouse fetuses. Endocrinol., 1964; 75:145–146. Pfeifer S. M., Strauss J. F. III. Progestins In: Reproductive Endocrinology, surgery and technology, pp 495–503. Eds E. Y. Adashi, J. A. Rock and Z. Rosenwaks. Philadelphia: Lippincott-Raven, 1996. Piccinni M. P., et al. Progesterone favors the development of human T helper cells producing Th2-type cytokines and promotes both IL-4 production and membrane CD30 expression in established Th1 cell clones. J. Immunol., 1995; 155:128–133. Pichon M. F., et al. Prognostic value of progesterone receptors in primary breast cancer. Recent Results Cancer Res., 1984; 91:186–191. Picton H. M., et al. The in vitro growth and maturation of follicles. Reproduction, 2008; 136:703–715. Picton H. M. Activation of follicle development: the primordial follicule. Theriogenology, 2001; 55:1193–1210. Pierik F., et al. Environmental risk factors for cryptorchidism and hypospadias. Birth Defects Res. Part A, 2004; 70:293. Pincus G., et al. Fertility control with oral medication. Am. J. Obstet. Gynecol., 1958; 75:1333–1346. Pintiaux A., et al. Gynecological uses of a new class of steroids: the selective progesterone receptor modulators. Gynecol. Endocrinol., 2009; 25 (2):67–73. Piotrowski J. Experimental investigations on the effect of progesterone on embryonal development. Part II. Investigations carried out on rabbits. Folia Biol. (Krakow), 1968a; 16:335–342. Piotrowski J. The effect of progesterone on the foetal development of rats on the Wistar strain. Part 3. Folia Biol. (Krakow), 1968b; 16:343–353. Pitts C. J., Kearns A. E. Update on Medications With Adverse Skeletal Effects. Mayo Clin. Proc., 2011; 86 (4):338–343. Pointis G., et al. Ef fect of maternal progesterone exposure on fetal testosterone in mice. Biol. Neonate, 1984; 45:203–208. Pointis G., et al. Effect of natural progesterone treatment during pregnancy on fetal testosterone and sexual behavior of the male offspring in the mouse. Dev. Pharmacol. Ther., 1987; 10:385–392. Polednak A. P., Janerich D. T. Maternal characteristics and hypospadias: a case-control study. Teratology, 1983; 28:67–73. Polgar B, et al. Urinary progesterone-induced blocking factor concentration is related to pregnancy outcome. Biol Reprod 2004;71:1699–1705. Pollow K., et al. Gestodene: a novel synthetic progestin; characterization of binding to receptor and serum proteins. Contraception, 1989; 40:325–341. Polson D. W., et al. Vaginal progesterone as luteal phase support in an IVF/GIFT programme. Eur. J. Obstet. Gynecol. Reprod. Biol., 1992; 46:35–38. Ponnampalam A. P., et al. Molecular classification of human endometrial cycle stages by transcriptional profiling. Mol. Hum. Reprod.,2004; 10:879–893. Porter T. F., Scott J. R. Evidence-based care of recurrent miscarriage. Best Pract. Res. Clin. Obstet. Gynecol., 2005; 19:85–101. Potdar N., Konje J. C. The endocrinological basis of recurrent miscarriage. Curr. Opin. Obstet. Gynecol., 2005; 17:424–428. Potischman N., et al. Pregnancy hormone concentrations across ethnic groups: implications for later cancer risk. Cancer Epidemiol. Biomarkers Prev., 2005; 14 (6):1514–1520. Pouly J. L., et al. Luteal support after invitro fertilization: Crinone 8 %, a sustained release vaginal progesterone gel, versus Utrogestan, an oral micronized progesterone. Hum. Reprod., 1996; 11:2085–2089. Pritts E. A., Atwood A. K. Luteal phase support in infertility treatment: a meta-analysis of the randomized trials. Hum. Reprod., 2002; 17:2287–2299. Proctor A., et al. Effect of progesterone supplementation in early pregnancy on the pregnancy outcome after in vitro fertilization. Fertil. Steril., 2006; 85:1550–1552. Progesterone. National Toxicology Program, Department of Health and Human Services.Report on Carcinogens, Twelfth Edition, 2011. Publicover S., Barratt C. Progesterone’s gateway into sperm. Nature, 2011; 471:313–314. Publicover S. J., Barratt C. L. R. Sperm motility: things are moving in the lab! Molecular Human Reproduction, 2011; 17 (8):453–456. Qi H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proc. Natl. Acad. Sci. USA, 2007; 104:1219–1223. Quack K. C., et al. Leukocyte activation in the decidua of chromosomally normal and abnormal fetuses from women with recurrent abortion. Hum. Reprod., 2001; 16:949–955. Raber L. Steroid industry honored. ACS News, 1999; 77:78–80. Radulesco J. C. Dydrogesterone in treatment of hypohormonal pregnancy. Mars. Med., 1970; 107:191–196. Raghupathy R., et al. Cytokine production by maternal lymphoctes during normal human pregnancy and in unexplained recurrent spontaneous abortion. Hum. Reprod., 2000; 15:713–718. Raghupathy R., et al. Modulation of cytokine production by dydrogesterone in lymphocytes from women with recurrent miscarriage. Br. J. Obstet. Gynecol., 2005; 112:1096–1101. Raghupathy R. Th1-type immunity is incompatible with successful pregnancy. Immunol. Today, 1997; 18:478–482. Ragusa A., et al. Progesterone supplement in pregnancy: an immunologic therapy? Lupus, 2004; 13:639–642. Rai R., et al. Recurrent miscarriage — an aspirin a day? Hum. Reprod., 2000; 15:2220–2223. Rajaram R. D., Brisken C. Paracrine signaling by progesterone. Mol. Cel. Endocrinol., 2012; 357:80–90. Ralt D., et al. Chemotactic and chemokinesis of human spermatozoa to follicular factors. Biol. Reprod., 1994; 50:774–785. Ralt D., et al. Sperm attraction to a follicular factor (s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. USA, 1991; 88:2840–2844. Raman-Wilms L., et al. Fetal genital effects of first-trimester sex hormone exposure: a metaanalysis. Obstet. Gynecol., 1995; 85:141–149. Rapkin A. J., et al. Relationships among self-rated Tanner staging, hormones, and psychosocial factors in health female adolescents. J. Pediatr. Adolesc. Gynecol., 2006; 19:181–7. Rapkin A. J. YAZ in the treatment of premenstrual dysphoric disorder. J. Reprod. Med., 2008; 53:729–741. Read G. F., et al.The use of salivary progesterone assays in the assessment of ovarian function in postmenarcheal girls. J. Endocrinol., 1984; 102:265–268. Reddy R., et al. Oocyte-specific deletion of Pten causes premature activation of the primordial follicle pool. Science, 2008; 319 (1):611–613. Rees M. C. P. Human Menstruation and Eicosanoids. Reprod. Fertil. Dev., 1990; 2:467–476. Reilly W., et al. Phallic urethra in female pseudohermaphroditism. J. Dis. Child, 1958; 95:9–17. Reins M. S., Barbieri R. L., Friedman A. J. Progesterone: a critical role in the pathogenesis of uterine myomas. Am. J. Obstet. Gynecol., 1995; 172 (1 Pt 1):14–18. Reins M. S. Advances in uterine leiomyoma research: the progesterone hypothesis. Environ Health Perspect, 2000; 108 Suppl 5:791–793. Reiss S., McNally R. J. The expectancy model of fear. In: Reiss, S.; Bootzin, R.R., editors. Theoretical issues in behavior therapy. New York: Academic Press, 1985; 107–122. Ren D. J., et al. A sperm ion channel required for sperm motility and male fertility. Nature, 2001; 413:603–609. Resseguie L. J., et al. Congenital malformations among offspring exposed in utero to progestins, Olmsted County, Minnesota, 1936–1974. Fertil. Steril., 1985; 43:514–519. Revesz C., Chappel C., Gaudry R. Masculinization of female fetuses in the rat by progestational compounds. Endocrinology, 1960; 66:140–143. Reznikoff-Etievant M. F., et al. Low vitamin B12 level as risk factor for very early recurrent abortion. Eur. J. Obstet. Gynecol. Reprod. Biol., 2002; 104:156–159. Rhodes M. E., Frye C. A. Inhibiting progesterone metabolism in the hippocampus of rats in behavioral estrus decreases anxiolytic behaviors and enhances exploratory and antinociceptive behaviors. Cognitive, Affective, & Behavioral Neuroscience, 2001; 1:287–296. Richer J. K., et al. Differential gene regulation by the two progesterone receptor isoforms in human breast cancer cells. Journal of Biological Chemistry, 2002; 277:5209–5218. Riddick D. H., et al. De novo synthesis of prolactin by human decidua. Life Sci., 1978; 23:1913–1921. Riss P. A., Radivojevic K., Bieglmayer C. Serum progesterone and human chorionic gonadotropin in very early pregnancy: implications for clinical management. Eur. J. Obstet. Gynecol. Reprod. Biol., 1989; 32:71–77. Rivier C., Rivest S. Effect of stress on the activity of the hypothalamicpituitary-gonadal axis peripheral and central mechanisms. Biol. Reprod., 1991; 45:523–532. Robiero L. S., Izquierdo L. Effect of progesterone on the cleavage rate of mouse embryos in vitro. J. Reprod. Fert., 1976; 46:475–476. Robker R. L., et al. Progesterone-regulated genes in the ovulation process: ADAMTS-1 and cathepsin L proteases. Proc. Natl. Acad. Sci. USA, 2000; 97:4689–4694. Roblero L. S., Garavagno A. C. Effect of oestradiol-17β and progesterone on oviductal transport and early development of mouse embryos. J. Reprod. Fert., 1979; 57:91–95. Roblero L. S. Effect of progesterone in vivo upon the rate of cleavage of mouse embryos. Reprod. Fert., 1973; 35:153–155. Rock J. A., et al. Fetal malformations following progesterone therapy during pregnancy: a preliminary report. Fertil. Steril., 1985; 44:17–19. Rogers P. A. Endometrial vasculature in Norplant users. Hum. Reprod., 1996; 11 (Suppl 2):45–50. Rojas-Marcos P. M., David R., Kohn B. Hormonal effects in infants conceived by assisted reproductive technology. Pediatrics, 2005; 116:190–194. Roman E. A., Alberman E., Pharoah P. O. Pregnancy order and fetal loss. BMJ, 1980; 280:715. Romero R., et al. Vaginal progesterone in women with an asymptomatic sonographic short cervix in the midtrimester decreases preterm delivery and neonatal morbidity: a systematic review and metaanalysis of individual patient data. Am. J. Obstet. Gynecol., 2012; 206:124.e1–19. Rose D. P., et al. High-fiber diet reduces serum estrogen concentrations in premenopausal women. Am. J. Clin. Nutr., 1991; 54:520–525. Ross, et al. Is it possible to estimate the minimal clinically important treatment effect needed to change practice in preterm birth prevention? Results of an obstetrician survey used to support the design of a trial. BMC Medical Research Methodology, 2012; 12:31. Rossouw J. E., et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA, 2002; 288:321–333. Rouse D. J., et al. A trial of 17 alpha-hydroxyprogesterone caproate to prevent prematurity in twins. N. Engl. J. Med., 2007; 357:454–61. Rubinow D. R., et al. Changes in plasma hormones across the menstrual cycle in patients with menstrually related mood disorder and in control subjects. AJOG, 1988; 158:5–11. Runic R., et al. Effects of Norplant on endometrial tissue factor expression and blood vessel structure. J. Clin. Endocrinol. Metab., 2000; 85:3853–3859. Ryan K. J., Smith O. W. Biogenesis of estrogens by the human ovary. II. Conversion of progesterone-4-C-14 to estrone and estradiol. J. Biol. Chem., 1961; 236:710–714. Saito S., Sakai M. Th1/Th2 balance in preeclampsia. Reprod. Immunol., 2003; 59:161–173. Saito S. Cytokine network at the feto-maternal interface. J. Reprod. Immunol., 2000; 47:87–103. Salafia C., et al. Placental and decidual histology in spontaneous abortion: detailed description and correlations with chromosome number. Obstet. Gynecol., 1993; 82:295–303. Salamonsen L. A., Giudice L. C. ’The Curse’: A 21st Century Perspective of Models of Its Molecular Basis. Endocrinology, 2010; 151 (9):4092–4095. Salamonsen L. A., et al. Production of endometrial matrix metalloproteinases but not their tissue inhibitors is modulated by progesterone withdrawal in an in vitro model for menstruation The Journal of clinical endocrinology and metabolism, 1997; 82:1409–1415. Salamonsen L. A., Lathbury L. J. Endometrial leukocytes and menstruation. Hum. Reprod. Update, 2000; 6 (1):16–27. Salazar E. L., Calzada L. The role of progesterone in endometrial estradiol- and progesterone-receptor synthesis in women with menstrual disorders and habitual abortion. Gynecol. Endocrinol., 2007; 23 (4):222–225. Salazar E. L., Calzada S. L., Escontria M. Estradiol/androgen receptors during aging: microsomal distribution in human benign prostatic hypertrophy. Arch. Androl., 2005; 51:49–53. Salazar E. L., et al. Estrogen receptor in displastic and malignant cervical tissue: expression, localisation and prognostic significance. Med. Sci. Res., 1996; 24:523–524. Salazar E. L., Mercado E., Calzada S. L. Prostatic cancer/benign prostatic hypertrophy. Subcellular distribution of estradiol/androgen receptors. Arch. Androl., 2005; 51:135–139. Salazar E. L., Paredes., Calzada L. Endometrial thickness of postmenopausal breast cancer patients treated with tamoxifen. Gynecol. Endocrinol., 2005; 21:312–316. Salker M., et al. Natural selection of human embryos: impaired decidualization of the endometrium disables embryo-maternal interactions and causes recurrent pregnant loss. PLoS One, 2010; 5 (4):e10287. Salomon L. J., et al. Changes in progesterone-induced-blocking factor expression rates following mifepristone administration in termination of pregnancy at 5 to 8 weeks. J. Matern. Fetal. Neonatal. Med., 2005; 17:353–356. Samalecos A., Gellersen B. Systematic expression analysis and antibody screening do not support the existence of naturally occurring progesterone receptor (PR) — C, PR-M, or other truncated PR isoforms. Endocrinol., 2008; 149:5872–5887. Sanchez-Ramos L., Kaunitz A. M., Delke I. Progestational agents to prevent preterm birth: a meta-analysis of randomized controlled trials. Am. J. Obstet. Gynecol., 2005; 105:273–279. Santen R. J., et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J. Clin. Endocrinol. Metab., 2010; 95:s1-s66. Sarkar N. N. The state-of-the-art of emergency contraception with the cutting edge drug. German Medical Science, 2011; 9:1–7. Sauer M. V., et al. Endometrial responses to various hormone replacement regimens in ovarian failure patients preparing for embryo donation. Int. J. Gynecol. Obstet., 1991; 35:61–68. Savaris R. F., et al. Progesterone resistance in PCOS endometrium: a microarray analysis in clomiphene citrate-treated and artificial menstrual cycles. J. Clin. Endocrinol. Metabol., 2011; 96 (6):1737–1746. Scatchard G. The attraction of proteins for small molecules and ions. Ann. NY. Acad. Sci., 1949; 51:660–672. Schedin P. Pregnancy-associated breast cancer and metastasis. Nat. Rev. Cancer, 2006; 6:281–291. Schindler A. E., et al. Classification and pharmacology of progestins. Maturitas, 2003; 46 (Suppl 1):S7–S16. Schindler A. E. Non-contraceptive benefits of hormonal contraceptives. Minerva Ginecol., 2010; 62:319–329. Schmidt K. L., et al. Progesterone supplementation during early gestation after in vitro fertilization has no effect on the delivery rate. Fertil. Steril., 2001; 75:337–341. Scholer H. F., de Wachter A. Evaluation of androgenic properties of progestational compounds in the rat by the female foetal masculinisation test. Acta Endocrinol. (Copenh.), 1961; 38:128–136. Schoolcraft W., et al. Lower pregnancy rate with premature luteinisation during pituitary suppression with leuprolide acetate. Fertil. Steril., 1991; 55:563–566. Schumacher M., et al. Genomic and membrane actions of progesterone: implications for reproductive physiology and behavior. Behav. Brain. Res., 1999; 105:37–52. Schumacher M., et al. Progesterone and progestins: neuroprotection and myelin repair. Current Opinion in Pharmacology, 2008; 8:740–746. Schumacher M., et al. Progesterone: Therapeutic opportunities for neuroprotection and myelin repair. Pharmacology & Therapeutics, 2007; 116:77–106. Schwarzenbach H., et al. Stimulatory effect of progesterone on the expression of steroidogenic acute regulatory protein in MA-10 Leydig cells. Biol. Reprod., 2003; 68:1054–1063. Schweppe K. W. Progestins and uterine leiomyoma. Gynecol. Endocrinol., 1999; 13 Suppl 4:21–24. Scialli A. R. Developmental effects of progesterone and its derivatives. Reprod. Toxicol., 1988; 2:3–11. Scott J. R. Immunotherapy for recurrent miscarriage. Cochrane Database Syst. Rev., 2003; 1:CD000112. Scully C., et al. Metabolism of progesterone by human leukocytes. Clinical Immunology and Immunopthology, 1982; 22:147–151. Shahar E., Bergman R., Pollack S. Autoimmune progesterone dermatitis: effective prophylactic treatment with danazol. Int. J. Dermatol., 1997; 36:708–711. Shanker Y. G., Sharma S. C., Rao A. J. Expression of progesterone receptor mRNA in the first trimester human placenta. Biochem. Mol. Biol. Int., 1997; 42:1235–1240. Shaw W. The Origin of the Lutein Cells of the Corpus Luteum. Proc. R. Soc. Med., 1926; 19 (Obstet. Gynecol. Sect.): 22–24. Sheehan T., Numan M. Estrogen, progesterone, and pregnancy termination alter neural activity in brain regions that control maternal behavior in rats. Neuroendocrinology, 2002; 75:12–23. Sherman B. M., West J. H., Korenman S. G. The menopausal transition: analysis of LH, FSH, estradiol, and progesterone concentrations during menstrual cycles of older women. J. Clin. Endocrinol. Metabol., 1976; 42:629–636. Shi J., Simpkins J. W. 17 beta-Estradiol modulation of glucose transporter 1 expression in blood-brain barrier. Am. J. Physiol., 1997; 272:E1016–E1022. Shirkey H. C. Human experiences related to adverse drug reactions to the fetus or neonate from some maternally administered drugs. Adv. Exp. Med. Biol., 1972; 27:17–30. Shkolnik K., et al. Reactive oxygen species are indispensable in ovulation. PNAS, January 25, 2011; 108 (4):1462–1467. Shultz T. D., Howie B. J. In vitro binding of steroid hormones by natural and purified fibers. Nutr. Cancer, 1986; 8:141–147. Siiteri P. K., Febres F., Clemens L. E. Progesterone and maintenance of pregnancy: is progesterone nature’s immunosuppressant? Ann. NY. Acad. Sci., 1977; 286:384–397. Sills E. S., Alper M. M., Walsh A. P. H. Ovarian reserve screening in infertility: Practical applications and theoretical directions for research. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2009; 146:30–36. Silver R. I., et al. In vitro fertilization is associated with an increased risk of hypospadias. J. Urol., 1999; 161:1954–1957. Silver R. I. Endocrine abnormalities in boys with hypospadias. Adv. Exp. Med. Biol., 2004; 545:45–72. Šimić N., Santini M. Verbal amd spatial functions during different phases of the menstrual cycle. Psychiatria Danubina, 2012; 24 (1):73–79. Simon J. A., et al. The absorption of oral micronized progesterone: the effect of food, dose proportionality, and comparison with intramuscular progesterone. Fertil. Steril., 1993; 60:26–33. Simon J. A. Micronized progesterone: vaginal and oral uses. Clin. Obstet. Gynecol., 1995; 38:902–914. Simoncini T., et al. Effects of dydrogesterone and of its stable metabolite, 20-a-dihydrogesterone, on nitric oxide synthesis in human endothelial cells. Fertil. Steril., 2006; 86 (Suppl 3):1235–1242. Simoncini T., et al. In vitro effects of progesterone and progestins on vascular cells. Steroids, 2003; 68:831–836. Singh M., Su C. Progesterone and neuroprotection. Horm. Behav., 2013; 63 (2):284–290. Singh M. Progesterone-Induced Neuroprotection. Endocrine, 2006; 29 (2):271–274. Sirrat G. M. Recurrent miscarriage. Lancet, 1990; 336:673–675. Sitruk-Ware R. Progestogens in hormonal replacement therapy: new molecules, risks, and benefits. Menopause. 2002; 9:6–15. Sivin I. Dose- and age-dependent ectopic pregnancy risks with intrauterine contraception. Obstet. Gynecol., 1991; 78:291–298. Slotta K.H., Ruschig H., Fels E. Reindarstellung der Hormone aus dem Corpusluteum. Berichte Deutsche chemische Gesellschaft, 1934; 67 (7):1270–1273. Smith L. J., et al. Effects of ovarian steroids and raloxifene on proteins that synthesize, transport, and degrade serotonin in the raphe region of macaques. Neuropsychopharmacology, 2004; 29:2035–2045. Smitz J., et al. A randomized prospective study comparing supplementation of the luteal phase and early pregnancy by natural progesterone administered by intramuscular or vaginal route. Rev. Fr. Gynecol. Obstet., 1992; 87:507–516. Snyder J. L., Krishnaswamy G. Autoimmune progesterone dermatitis and its manifestation as anaphylaxis: a case report and literature review. Ann. Allergy Asthma Immunol., 2003; 90:469–477. Soares C. N., et al. Efficacy of estradiol for the treatment of depressive disorders in perimenopausal women: a doubleblind, randomized, placebo-controlled trial. Arch. Gen. Psychiatry, 2001;58:529–534. Soares S. R., et al. Cigarette smoking affects uterine receptiveness. Hum. Reprod., 2007; 22:543–547. Soliz J., Joseph V. Perinatal steroid exposure and respiratory control during early postnatal life. Respir. Physiol. Neurobiol., 2005; 149:111–122. Somers S. Ageless: The Naked Truth about Bioidentical Hormones. New York, NY: Crown Publishers; 2006. Sparka M. J., Willis J. Systematic review of progesterone use by midlife and menopausal women. Maturitas, 2012; 72:192–202. Speroff L., Glass R. H., Kase N. G., eds. Menstrual Disorders in Gynecologic Endocrinology and Infertility, 6th Ed. Philadelphia, PA: Lippincott Williams & Wilkins, 1999; 557–574. Speroff L. Alternative therapies for postmenopausal women. Intl. J. Fertil. Womens Med., 2005; 50 (3):101–104. Spitz I. M., Chwalisz K. Progesterone receptor modulators and progesterone antagonists in women’s health. Steroids, 2000; 65:807–815. Springhouse. Amenorrhea: professional guide to signs & symptoms. Ambler, PA: Lippincott Williams & Wilkins, 2006. Stachenfeld N. S., Taylor H. S. Estrogen and progesterone effects on body fluid distribution. J. Appl. Physiol., 2004; 96:1011–1018. Stahl S. M. Basic psychopharmacology of antidepressants, part 2: Estrogen as an adjunct to antidepressant treatment. J. Clin. Psychiatry, 1998; 59 Suppl 4:15–24. Stahl S. M. Natural estrogen as an antidepressant for women. J. Clin. Psychiatry, 2001; 62:404–405. Stanford J. B., Mikolajczyk R. T. Mechanisms of action of intrauterine devices: update and estimation of postfertilization effects. Am. J. Obstet. Gynecol., 2002; 187:1699–1708. Staples L. D., et al. Migration of leukocytes into the uterus after acute removal of ovarian progesterone during early pregnancy in the sheep. Placenta, 1983; 4:339–350. Stearns E. L., Winter J. S., Faiman C. Effects of coitus on gonadotropin, prolactin and sex steroid levels in man. J. Clin. Endocrinol. Metab., 1973; 37:687–691. Stefanick M. L. Estrogens and progestins: background and history, trends in use, and guidelines and regimens approved by the US Food and Drug Administration. Am. J. Med., 2005; 118 (suppl 12B):64–73. Stein D. G. The Case for Progesterone. Ann. NY. Acad. Sci., 2005; 1052:152–169. Steiner M. Premenstrual syndrome and premenstrual dysphoric disorder: guidelines for management. J. Psychiatry Neurosci., 2000; 25 (5):459–68. Stéphanie R., et al. Endometrial vessel maturation in women exposed to levonorgestrel releasing intrauterine system for a short or prolonged period of time. Hum. Reprod., 2007; 22 (12):3084–3091. Stephenson M. D., Awartani K. A.,Robinson W. P. Cytogenetic analysis of miscarriages from couples with recurrent miscarriage: a case-control study. Hum. Reprod., 2002; 17:446–451. Stephenson M. D. Management of recurrent early pregnancy loss. J. Reprod. Med., 2006; 51:303–310. Stewart E. A., Nowak R. A. Leiomyoma-related bleeding: a classic hypothesis updated for the molecular era. Hum. Reprod. Update, 1996; 2:295–306. Stewart E. A., Nowak R. A. New concepts in the treatment of uterine leiomyomas. Obstet. Gynecol., 1998; 92 (4 Pt 1):624–627. Stewart J. A., Bulmer J. N., Murdoch A. P. Endometrial leucocytes: expression of steroid hormone receptors. J. Clin. Pathol., 1998; 51:121–126. Stoll C., et al. Genetic and environmental factors in hypospadias. J. Med. Genet., 1990; 27:559–563. Strauss J. The synthesis and metabolism of steroid hormones. In: Strauss J. F. III, Barbieri R. L., eds. Yen and Jaffe’s Reproductive Endocrinology 6th ed. Philadelphia, PA: Elsevier, 2009:4. Strauss J. F. 3rd. Some new thoughts on the pathophysiology and genetics of polycystic ovary syndrome. Ann. NY. Acad. Sci., 2003; 997:42–48. Strünker T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature, 2011; 471:382–386. Studd J., Nappi R. E. Reproductive depression. Gynecol. Endocrinol., 2012; 28 (S (1)):42–45. Studd J., Panay N. Hormones and depression in women. Climacteric, 2004; 7:338–346. Studd J. A guide to hormone therapy for the treatment of depression in women. Climacteric, 2011; 14:637–642. Studd J. Ovarian cycle syndrome. Gynecol. Endocrinol., 2009; 25:74. Studd J. Spotlight on severe premenstrual syndrome and bipolar disorder: a frequent tragic confusion. Climacteric, 2011; 14:602. Studd J. Why are estrogens rarely used for the treatment of depression in women? Gynecol. Endocrinol., 2007; 23:63–64. Suarez S. S. Control of hyperactivation in sperm. Hum. Reprod. Update, 2008; 14:647–657. Suchowsky G. K., Turolla E., Arcari G. Studies of the so-called virilizing effects of steroids in female rat fetuses. Endocrinology, 1967; 80:255–262. Sun F., et al. Human sperm chemotaxis: Both the oocyte and its surrounding cumulus cells secrete sperm chemoattractants. Hum. Reprod., 2005; 20:761–767. Sun F., et al. Lack of speciesspecificity in mammalian spem chemotaxis. Dev. Biol., 2003; 255:423–427. Sundström-Poromaa I. Action of progesterone and progesterone metabolites in menstrual-cycle — related disorders. Headache, 2008; 48:S90-S98. Sutton-Riley J. M., et al. A single serum test for measuring early pregnancy outcome with high predictive value. Clin. Biochem., 2006; 39:682–687. Suzuki T., et al. Immunohistochemical distribution of progesterone, androgen and oestrogen receptors in the human ovary during the menstrual cycle: relationship to expression of steroidogenic enzymes. Hum. Reprod., 1994; 9:1589–1595. Sweet R. A., et al. Study of the incidence of hypospadias in Rochester, Minnesota, 1940–1970, and a case-control comparison of possible etiologic factors. Mayo Clin. Proc., 1974; 49:52–58. Swyer G., Daley D. Progesterone implantation in habitual abortion. BMJ, 1953; 1:1073–1086. Syed V., Ho S. Progesterone-induced apoptosis in immortalized normal and malignant human ovarian surface epithelial cells involves enhanced FasL expression. Oncogene, 2003; 22 (44):6883–6890. Szamatowicz J., et al. Fibromyomas and uterine contractions. Acta Obstet. Gynecol. Scand., 1997; 76:973–976. Szekeres-Bartho J., et al. Progesterone as an immunomodulatory molecule. Int. J. Immunopharmacol., 2001; 1:1037–1048. Szekeres-Bartho J., et al. Progesterone receptors in lymphocytes of liver-transplanted and transfused patients. Immunol. Lett., 1989; 22:259–261. Szekeres-Bartho J., et al. Reactivity of lymphocytes to a progesterone-specific monoclonal antibody. Cell. Immunol., 1990; 125:273–283. Szekeres-Bartho J., et al. The anti-abortive effect of PIBF in mice is manifested by modulating NK activity. Cell. Immunol., 1997; 177:194–199. Szekeres-Bartho J., Faust Z., Varga P. The expression of a progesterone-induced immunomodulatory protein in pregnancy lymphocytes. Am. J/ Reprod. Immunol., 1995; 34:342–348. Szekeres-Bartho J., Varga P., Petjsik B. ELISA test for detecting a progesterone-induced immunological factor in pregnancy serum. J. Reprod. Immunol., 1989; 16:19–29. Szekeres-Bartho J. Immunological relationship between the mother and the fetus. Int. Rev. Immunol., 2002; 21:471–496. Szlachter N., et al. Myometrial inhibiting activity of relaxin containing extracts of human corpora lutea of pregnancy. Am. J. Obstet. Gynecol., 1980; 136:584–586. Tabibzadeh S., Babaknia A. The signals and molecular pathways involved in implantation, a symbiotic interaction between blastocyst and endometrium involving adhesion and tissue invasion. Human Reproduction, 1995; 10 (6):1579–1602. Tabibzadeh S. The signals and molecular pathways involved in human menstruation, a unique process of tissue destruction and remodelling. Mol. Hum. Reprod., 1996; 2 (2):77–92. Tahboub R., Arafah B. M. Sex steroids and the thyroid. Best Pract. Res. Clin. Endocrinol. Metab., 2009; 23:769–780. Takacs P., et al. The effects of estrogen, progesterone and polypropylene mesh on vaginal smooth muscle cell proliferation. Muscle Res., 2010; 6 (1):9–15. Takasugi N., Tomooka Y. Alteration of the critical period for induction of persistent oestrus by early postnatal treatment with gonadal steroids in neonatally cortisone-primed mice. J. Endocrinol., 1976; 69:293–294. Tam A., et al. The role of female hormones on lung function in chronic lung diseases. BMC Women’s Health, 2011; 11:24. Tantayaporn P., et al. The effect of estrogen and progesterone on the volume and electrolyte content of the uterine luminal fluid of the rat. Endocrinology, 1974; 95:1034–1045. Tapanainen J., Penttinen J., Huhtaniemi I. Effect of progesterone treatment on the development and function of neonatal rat adrenals and testes. Biol. Neonate, 1979; 36:290–297. Tarín J. J., Hamatani T., Cano A. A cute stress may induce ovulation in women. Reprod. Biol. Endocrinol., 2010; 8:53:1–13. Tavaniotou A., Devroey P. Luteal hormonal profile of oocyte donors stimulated with a GnRH antagonist compared with natural cycles. Reprod. Biomed. Online, 2006; 13:326–330. Tavaniotou A., et al. Comparison between different routes of progesterone administration as luteal phase support in infertility treatments. Hum. Reprod. Update, 2000; 6:139–148. Taylor K. C., et al. Associations of Progesterone Receptor Polymorphisms with Age at Menarche and Menstrual Cycle Length. Horm. Res. Paediatr., 2010; 74:421–427 Taylor W. G., et al. Microdetermination of Diosgenin from Fenugreek (Trigonella foenum-graecum) Seeds. J. Agric. Food Chem., 2000; 48 (11):5206–5210. Tempfer C. B., et al. A combination treatment of prednisone, aspirin, folate, and progesterone in women with idiopathic recurrent miscarriage: a matched-pair study. Fertil. Steril., 2006; 86:145–148. Ter Host J. P. Relevance of Stress and Female Sex Hormones for Emotion and Cognition. Cell. Mol. Neurobiol., 2012; 32:725–735. Tesarik J., Mendoza C. Defective function of a nongenomic progesterone receptor as a sole sperm anomaly in infertile patients. Fertil. Steril., 1992; 58:793–797. Teves M. E., et al. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One, 2009; 4:e8211. Teves M. E., et al. Progesterone at the picomolar range is a chemoattractant for mammalian spermatozoa. Fertil. Steril., 2006; 86:745–749. Thakur M. K., Paramanik V. Role of steroid hormone coregulators in health and disease. Hormone Research, 2009; 7:194–200. The ovarian hormone. Lancet, 1926; 207:5340:26–27 The progesterone only pill. InnovAiT, 2011; 4 (9) 515–519. Thibault C., Levasseur M. C. Ovulation. Human Reproduction, 1988; 3 (4):513–523. Thomas P., Meizel S. Phosphatidylinositol 4,5-bisphosphate hydrolysis in human sperm stimulated with follicular fluid or progesterone is dependent upon Ca2+ influx. Biochem. J., 1989; 264:539–546. Thomas S. L., Ellertson C. Nuisance or natural and healthy: should monthly menstruation be optional for women? Lancet, 2000; 355:922–924. Thompson T. L., Moss R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci. Lett., 1997; 229:145–148. Tibbetts T. A., et al. Progesterone receptors in the thymus are required for thymic involution during pregnancy and for normal fertility. Proc. Natl. Acad. Sci. USA, 1999; 96:12021–12026. Tita A. T. N., Rouse D. J. Progesterone for preterm birth prevention: an evolving intervention. Am. J. Obstet. Gynecol., 2009; 200 (3):219–224. Tomic V., et al. Oral micronized progesterone combined with vaginal progesterone gel for luteal support. Gynecol. Endocrinol., 2011; 27 (12):1010–1013. Tone A. A., et al. Decreased progesterone receptor isoform expression in luteal phase fallopian tube epithelium and highgrade serous carcinoma. Endocr. Relat. Cancer, 2011; 18:221–234. Tredway D. R., Warne D. W., Eshkol A., Alam V. Correlation between luteal serum progesterone levels and pregnancy in ovulation induction. Fertil. Steril., 2007; 1:88: S195. Tsuji K., Sowa M., Nakano R. Relationship between human oocyte maturation and different follicular size. Biol. Reprod., 1985; 32:413–417. Tuckey R. C., Bose H. S., Czerwionka I., Miller W. L. Molten globule structure and steroidogenic activity of N-218 MLN64 in human placental mitochondria. Endocrinology, 2004 Apr; 145 (4):1700–1707. Tuckey R. C. Progesterone synthesis by the human placenta. Placenta, 2005; 26:273–281. Tung L., et al. Antagonist occupied human progesterone B-receptors activate transcription without binding to progesterone response elements and are dominantly inhibited by A-receptors. Mol. Endocrinol., 1993; 7:1256–1265. Unfer V., et al. Different routes of progesterone administration and polycystic ovary syndrome: A review of the literature. Gynecological. Endocrinology, August 2005; 21 (2):119–127. Uribe A., Strauss J. F. 3rd, Martinez F. Contact sites from human placental mitochondria: characterization and role in progesterone synthesis. Arch. Biochem. Biophys., 2003; 413 (2):172–181. Urman B., Tiras B., Yakin K. Assisted reproduction in the treatment of polycystic ovarian syndrome. Reprod. Biomed. Online, 2004; 8:419–430. US Food and Drug Administration. Food and Drugs. US Code of Federal Regulations, Title 21, part 556.540, 1977; 364. Vainio S., et al. Female development in mammals is regulated by Wnt-4 signalling. Nature, 1999; 397:405–409. Vallet J. L., Christenson R. K. Effect of progesterone, mifepristone, and estrogen treatment during early pregnancy on conceptus development and uterine capacity in Swine. Biol. Reprod., 2004; 70:92–98. Valley V. T., et al. Serum progesterone and endovaginal sonography by emergency physicians in the evaluation of ectopic pregnancy. Acad. Emerg. Med., 1998; 5:309–312. Van den Berge M., et al. The role of female sex hormones in the development and severity of allergic and non-allergic asthma. Clin. Exp. Allergy, 2009; 39:1477–1481. Van Keep P. A. The history and rationale of hormone replacement therapy. Muturitus, 1990; 12:163–170. Van Kempen T. A., et al. Accelerated Ovarian Failure: A novel, chemically induced animal model of menopause. Brain Research, 2011; 379:176–187. Van Vaerenbergh I., et al. Progesterone rise on hCG day in GnRH antagonist/rec-FSH stimulated cycles affects endometrial gene expression. RBM Online, 2011; 22:263–271. Van Veen F. J., et al. The effects of female reproductive hormones in generalized social anxiety disorder. Intern. J. Psych. Med., 2009; 39:283–295. Vasconcelos C., et al. Autoimmune progesterone urticaria. Gynecol. Endocrinol., 2000; 14:245–247. Veitia R. A. FOXL2 versus SOX9: A lifelong «battle of the sexes». Bioessays, 2010; 32:375–380. Velle W. The use of hormones in animal production. FAO Corporate Document Repository. http://www.fao.org/docrep/004/X6533E/X6533E01.htm Venetis C. A., et al. Is progesterone elevation on the day of human chorionic gonadotrophin administration associated with the probability of pregnancy in in vitro fertilization? A systematic review and meta-analysis. Hum. Reprod. Update, 2007; 13:343–355. Vercellini P., Cortesi I., Crosignani P. G. Progestins for symptomatic endometriosis: a critical analysis of the evidence. Fertil. Steril., 1997; 68:393–401. Verhaegen J., et al. Accuracy of single progesterone test to predict early pregnancy outcome in women with pain or bleeding: meta-analysis of cohort studies. BMJ, 2012; 345:e6077. Vetrivelan R., Mallick H. N., Kumar V. M. Tonic activity of alpha1 adrenergic receptors of the medial preoptic area contributes towards increased sleep in rats. Neuroscience, 2006; 139:1141–1151. Vidal F., et al. FISH preimplantation diagnosis of chromosome aneuploidy in recurrent pregnancy wastage. J. Assist. Reprod. Genet., 1998; 15:310–313. Vitzthum V. J., Spielvogel H.; Thornburg J. Interpopulational differences in progesterone levels during conception and implantation in humans. PNAS, 2004;101 (6):1443–1448. Vlaanderen W., Treffers P. K. Prognosis of subsequent pregnancies after recurrent spontaneous abortion in first trimester. BMJ, 1987; 295:92–93. Von Eye Corleta H., Capp., Cardoso Ferreira M. B. Pharmacokinetics of natural progesterone vaginal suppository. Gynecol. Obstet. Invest., 2004; 58:105–108. Vuorento T., Huhtaniemi I. Daily levels of salivary progesterone during menstrual cycle in adolescent girls. Fertil. Steril., 1992; 58:685–690. Vural P., Akgul C., Yildirim A., Canbaz M. Antioxidant defence in recurrent abortion. Clin. Chim. Acta. 2000; 295:169–177. Wagner C. K., Kinsley C., Svare B. Mice: postpartum aggression is elevated following prenatal progesterone exposure. Horm. Behav., 1986; 20:212–221. Wagner C. K., Nakayama A. Y., De Vries G. J. Potential role of maternal progesterone in the sexual differentiation of the brain. Endocrinol., 1998; 139:3658–3661. Walch K., Hefler L., Nagele F. Oral dydrogesterone treatment during the first trimester of pregnancy: the Prevention of Miscarriage Study (PROMIS). A double-blind, prospectively randomized, placebo-controlled, parallel group trial. J. Matern. Fetal. Neonatal. Med., 2005; 18:265–269. Walch K. T., Huber J. C. Progesterone for recurrent miscarriage: truth and deceptions. Best Practice & Research Clinical Obstetrics and Gynecology 2008; 22 (2):375–389. Wallis C. J., Luttge W. G. Influence of estrogen and progesterone on glutamic acid decarboxylase activity in discrete regions of rat brain. J. Neurochem., 1980; 34:609–613. Wallis M. C., et al. Sex determination in mammals — Before and after the evolution of SRY. Cel. Mol. Life Sci., 2008; 65:3182–3195. Wambach G., Higgins I. Antimineralocorticoid action of progesterone in the rat: correlation of the effect on electrolyte excretion and interaction with renal mineralocorticoid receptors. Endocrinology, 1978; 102:1686–1693. Wang H., et al. Progesterone receptor subtype B is differentially regulated in human endometrial stroma. Mol. Hum. Reprod., 1998; 4:407–412. Ward K., Argyle V., Meade M., Nelson L. The heritability of preterm delivery. Obstet. Gynecol., 2005; 106 (6):1235–1239. Watson N. R., et al. Treatment of severe premenstrual syndrome with oestradiol patches and cyclical oral norethisterone. Lancet, 1989; 2:730–732. Wattanakumtornkul S., Pinto A. B., Williams D. B. Intranasal hormone replacement therapy. Menopause, 2003; 10:88–98. Wegmann T. G., Lin H., Guilbert L., et al. Bidirectional cytokine interactions in maternal-fetal relationship: is successful pregnancy a Th2 phenomenon? Immunol. Today, 1993; 14:353–356. Wegmann T. G. The cytokine basis for cross-talk between the maternal immune and reproductive systems. Curr. Opin. Immunol., 1990; 2:765–769. Wei L. L., Miner R. Evidence for the existence of a third progesterone receptor protein in human breast cancer cell line T47D. Cancer Res., 1994; 54:340–343. Weiser M. J., Foradori C. D., Handa R. J. Estrogen receptor beta in the brain: from form to function. Brain. Res. Rev., 2008; 57:309–320. Wen E., et al. Estradiol, progesterone, testosterone profiles in human follicular fluid and cultured granulose cells from luteinized pre-ovulatory follicles. Reprod. Biol. Endocrinol., 2010; 8:117. Westphal U., Stroupe S. D., Cheng S. L. Progesterone binding to serum proteins. Annals New York Academy of Sciences, 1977; 286:10–28. Wetherington C. L. Sex differences and gonadal hormone influences in drug addiction and sexual behavior: Progress and possibilities. Hormones and Behavior, 2010; 58 (1):2–7. Wharton L. R. Jr., Scott R. B. Experimental production of genital lesions with norethindrone. Am. J. Obstet. Gynecol., 1964; 89:701–715. Whitcomb B. W., et al. Ovarian function and cigarette smoking in the BioCycle Study. Paediatr. Perinat. Epidemiol., 2010; 24 (5):433–440. Whitehead M. I., et al. Absorption and metabolism of oral progesterone. BMJ, 1980; 280:825–827. Whitney R., Burdick H. Effect of massive doses of an estrogen on ova transport in ovariectomized mice. Endocrinology, 1939; 24:45–49. Wilcox A. J., Baird D. D., Weinberg C. R. Time of implantation of the conceptus and loss of pregnancy. N. Engl. J. Med., 1999; 340:1796–1799. Wilcox A. J., et al. Incidence of early pregnancy loss. N. Engl. J. Med., 1988; 319:189–194. Wilcox A. J., et al. Likelihood of conception with a single act of intercourse providing benchmark rates for assessment of post-coital contraceptives. Contraception, 2001; 63:211–215. Wilcox A. J., Weinberg C. R., Baird D. D. Timing of sexual intercourse in relation to ovulation. Effects on the probability of conception, survival of the pregnancy, and sex of the baby. N. Engl. J. Med., 1995; 333:1517–1521. Wilkens J., Critchley H. Progesterone receptor modulators in gynaecological practice. J. Fam. Plann. Reprod. Health Care, 2010; 36 (2):87–92. Wilkins L., et al. Masculinization of the female fetus associated with administration of oral and intramuscular progestins during gestation: non-adrenal female pseudohermaphrodism. J. Clin. Endocrinol. Metab., 1958; 18:559–585. Wilkins L. Masculinization of the female fetus due to the use of certain synthetic oral progestins during pregnancy. Arch. Anat. Microsc. Morphol. Exp., 1959; 48 (Suppl):313–329. Williams N. I., et al. Effects of follicular phase exercise on luteinizing hormone pulse characteristics in sedentary eumenorrhoeic women. Clin. Endocrinol. (Oxf.), 1994; 41:787–794. Williams S. C., Donahue J., Muasher S. J. Vaginal progesterone therapy during programmed cycles for frozen embryo transfer: an analysis of serum progesterone levels and pregnancy rates [abstract P-363]. Fertil. Steril., 2000; 74 (Suppl 1):S209. Wilson K. M., et al. A prospective study of dietary acrylamide intake and the risk of breast, endometrial, and ovarian cancers. Cancer Epidemiol. Biomarkers Prev., 2010 October; 19 (10):2503–2515. Wilson C. W., Loh H. S. Vitamin C and fertility. Lancet, 1973; 2:859–860. Wilson M. A. GABA physiology: modulation by benzodiazepines and hormones. Crit. Rev. Neurobiol., 1996; 10:1–17. Wingo C. S., Greenlee M. M. Progesterone: not just a sex hormone anymore? Kidney International 2011; 80:231–233. Wise D. D., Felker A., Stahl S. M. Tailoring treatment of depression for women across the reproductive lifecycle: the importance of pregnancy, vasomotor symptoms, and other estrogen-related events in psychopharmacology. CNS Spectr, 2008; 13:647–662. Wise P. M., et al. Estrogens: trophic and protective factors in the adult brain. Front Neuroendocrinol., 2001; 22:33–66. Women’s Health. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA, 2002l; 288:321–333. Woods K. S., Reyna R., Azziz R. Effect of oral micronized progesterone on androgen levels in women with polycystic ovary syndrome. Fertil. Steril., 2002; 77:1125–1127. Woods M. N., et al. Hormone levels during dietary changes in premenopausal African-American women. J. Natl. Cancer Inst., 1996; 88:1369–1374. World Health Organization. WHO Laboratory manual for the examination of human semen and semen-cervical mucus interaction. New York: Cambridge University Press, 1993. Wu J. M., Zelinski M. B., Ingram D. K., Ottinger M. A. Models ovarian aging and menopause: current theories, hypotheses, and research. Experimental Biology and Medicine, 2005; 230:818–828. Wu J. T., Dickmann, Johnson D. C. Effects of ovariectomy or hypophysectomy on day one of pregnancy on development and transport of fertilized rat eggs. J. Endocr., 1971; 49:507–513. Wu Y., et al. Promoter hypermethylation of progesterone receptor isoform B (PR-B) in endometriosis. Epigenetics, 2006; 1:106–111. Wyatt K. M., et al. The effectiveness of GnRHa with and without ’add-back’ therapy in treating premenstrual syndrome: a meta analysis. BJOG, 2004; 111:585–593. Xia J., Reigada D., Mitchell C. H., Ren D. CatSper channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biol. Reprod., 2007; 77:551–559. Xiao E., Ferin M. Stress-related disturbances of the menstrual cycle. Ann. Med., 1997; 29:215–219. Yang S., Thiel K. W., Leslie K. K. Progesterone: the ultimate endometrial tumor suppressor. Trends Endocrinol. Metab., 2011b; 22 (4):145–152. Ying C., et al. Progesterone receptor gene expression in preimplantation pig embryos. Eur. J. Endocrinol., 2000; 143:697–703. Yip S. K., et al. Accuracy of clinical diagnostic methods of threatened abortion. Gynecol. Obstet. Invest., 2003; 56:38–42. Yonkers K. A., Pearlstein T., Rosenheck R. A. Premenstrual disorders: bridging research and clinical reality. Arch. Womens Ment. Health, 2003; 6 (4):287–292. Yoshida T. Infertility update: use of assisted reproductive technology. J. Am. Pharm. Assoc., 1999; 39:65–72. Younis J. S., et al. A simple multivariate score could predict ovarian reserve, as well as pregnancy rate, in infertile women. Fertil. Steril., 2010; 94 (2):655–661. Yovel I., et al. High progesterone levels adversely affect embryo quality and pregnancy rates in in vitro fertilization and oocyte donation programs. Fertil. Steril., 1995; 64:128–131. Yui J., et al. Cytotoxicity of tumor necrosis factor-alpha and gammainterferon against primary human placental trophoblast. Placenta, 1994; 15:819–835. Zachariades E., et al. Changes in placental progesterone receptors in term and preterm labour. Placenta, 2012; 33:367–372. Zalanyi S. Progesterone and ovulation. European Journal of Obstetrics, Gynecology and Reproductive Biology, 2001; 98 (2):152–159. Zarrow M. X., Campbell P. S., Clark J. H. Pregnancy following coital-induced ovulation in a spontaneous ovulator. Science, 1968; 159:329–330. Zhang J., et al. Progesterone inhibits activation of latent matrix metalloproteinase (MMP) -2 by membrane-type 1 MMP: enzymes coordinately expressed in human endometrium. Biol. Reprod., 2000; 62:85–94. Zhang J., Salamonsen L. A. In vivo evidence for active matrix metalloproteinases in human endometrium supports their role in tissue breakdown at menstruation. J. Clin. Endocrinol. Metab., 2002; 87:2346–2351. Zhang K., et al. Onset of ovulation after menarche in girls: a longitudinal study. J. Clin. Endocrinol. Metab., 2008; 93:1186–1194. Zhanga Y., et al. Progesterone metabolism in adipose cells. Mol. Cel. Endocrinol., 2009; 298:76–83. Zheng T., et al. How to determine the dosage of oral progesterone among patients with menstrual disorders? Chin. Med. J., 2012; 125 (11):1970–1974. Zhou Y., et al.Cigarette Smoke Increases Progesterone Receptor and Homeobox A10 Expression in Human Endometrium and Endometrial Cells: A Potential Role in the Decreased Prevalence of Endometrial Pathology in Smokers. Biol. Reprod., 2011; 84:1242–1247. Zhou B., et al. Cigarette smoking and the risk of endometrial cancer: a meta-analysis. Am. J. Med., 2008; 121:501–508. Zhu Y., Bond J., Thomas P. Identification, classification, and partial characterization of genes in humans and other vertebrates homologous to a fish membrane progestin receptor. Proc. Natl. Acad/ Sci. USA, 2003a; 100:2237–2242. Zhu Y., et al. Cloning, expression, and characterization of a membrane progestin receptor and evidence it is an intermediary in meiotic maturation of fish oocytes. Proc. Natl. Acad. Sci. USA, 2003b; 100:2231–2236. Zirkin B. R. Where Do Adult Leydig Cells Come From? Biol. Reprod., 2010; 82:1019–1020. Zlotnik A., et al. The Effects of Estrogen and Progesterone on Blood Glutamate Levels: Evidence from Changes of Blood Glutamate Levels During the Menstrual Cycle in Women. Biol. Reprod., 2011; 84:581–586. Zumoff B., et al. The effect of smoking on serum progesterone, estradiol, and luteinizing hormone levels over a menstrual cycle in normal women. Steroids, 1990; 55:507–511.Апресян С. В., Дурандин Ю. М., Семятов С. Д. Эволюция КОК: от дефицита к проблеме выбора. Status Praesens, 2011; 80–84. Майоров М. В. Pro et contra. Прогестины и антипрогестины. Провизор, 2007; 11:19–21. Майоров М. В., Жученко С. И., Черняк О. Л. Лейомиома матки: что нового? Новации тактики и терапии, часть 1. Провизор, 2012; 5:6–9. Майоров М. В., Жученко С. И., Черняк О. Л., Голубова М. А. Эндометриоз: что нового? Новации тактики и терапии. Новости медицины и фармации, 2012; 3 (401);18–22. Майоров М. В., Жученко С. И., Черняк О. Л., Голубова М. А. Эндометриоз: что нового? Новации тактики и терапии. Современная фармация, 2011; 10:52–62. Майоров М. В., Жученко С. И. Современная гормональная контрацепция: опасности мнимые и реальные. Провизор, 2010; 24:28–32. Майоров М. В., Жученко С. И. Гестагенная контрацепция: показания, преимущества, особенности. Провизор, 2011; 42–47. Майоров М. В. DACH-syndrome, PMDD, ПМС (предменструальный синдром): проблемы патогенеза, особенности терапии. Провизор, 2007; 21:33–36. Майоров М. В. Аутоиммунный оофорит. Актуальные особенности патогенеза, диагностики и лечения. Репродуктивное здоровье женщины, 2006; 4 (29):59–61. Майоров М. В. Гестагены в акушерско-гинекологической практике. Провизор, 2004; 7:26–29. Майоров М. В. Заместительная гормональная терапия: панацея или очередная дань моде? Провизор, 2003; 20:42–46. Майоров М. В. Неконтрацептивные свойства оральных контрацептивов. Провизор, 2003; 11:16–18. Майоров М. В. Некоторые аспекты заместительной гормональной терапии. Вісник фармакології та фармації, 2004. Майоров М. В. Синдром непереносимости гестагенов: причины и следствия. Что предпринять? Провизор, 2004; 16:31–33. Майоров М. В. Эстрогены — старые приятели и новые знакомые. Провизор, 2005; 5:27–30.

Последние комментарии
1 час 47 минут назад
17 часов 51 минут назад
1 день 2 часов назад
1 день 2 часов назад
3 дней 9 часов назад
3 дней 13 часов назад